视黄酸对大鼠肝癌细胞γ-丁基甜菜碱双加氧酶的表达及肉碱合成的影响
2019-11-05屈尚蓝任伟伟宋流东冯维杨
屈尚蓝,任伟伟,宋流东,冯维杨
1昆明医科大学基础医学院;2昆明医科大学药学院暨云南省天然药物药理重点实验室,昆明650500
视黄酸(retinoic acid,RA)是天然维生素A在哺乳动物体内代谢产生的活性衍生物,包括全反视黄酸(all-trans-retinoic acid,atRA)、9-顺式视黄酸(9-cis-retinoic acid,9-cis-RA)和13-顺式视黄酸(13-cis-retinoic acid,13-cis-RA)三种异构体,三者可相互转变[1]。RA不仅防癌、抗癌,在脂代谢调节中也具有重要作用[1-4]。研究发现,维甲酸X受体(retinoid x receptors,RXRs)与过氧化物酶体增殖激活物受体(peroxisome proliferator-activated receptors,PPARs)所形成的异源二聚体在脂代谢调节中发挥重要作用[1-4]。在哺乳动物体内,RXRs包括RXRα,RXRβ和RXRγ三种亚型,9-cis-RA是RXRs的天然配体[1]。
L-肉碱在真核细胞的脂肪酸分解代谢中起着不可或缺的作用,其主要功能是作为载体将活化脂肪酸转运到线粒体中进行β-氧化。在哺乳动物中,参与脂肪酸转运的肉碱可以由生物体自身合成[6]。γ-丁基甜菜碱双加氧酶(γ-butyrobetainedioxygenase,γ-BBD,EC 1.14.11.1)是大鼠和人肉碱生物合成途径中一个重要的关键酶,主要在肝脏中催化γ-甜菜碱到L-肉碱的立体特异性羟化[6]。研究发现,γ-BBD抑制剂能抑制L-肉碱的生物合成并降低脂肪酸的转运和氧化率[7,8]。这些研究表明,γ-BBD在大鼠和人肝脏中所催化的反应对肉碱合成及脂肪酸氧化分解具有重要作用。
据报道,肝癌细胞具有明显的脂代谢重编程现象[9,10],而且多项研究已表明RA能增强脂肪酸分解代谢[4,11,12]。但是,γ-BBD的表达在肝癌细胞内是否随脂代谢调节而被调节、是否受RA影响目前尚不清楚。本研究用二乙基亚硝胺(diethylnitrosamine,DEN)建立大鼠原发性肝癌模型,通过western blotting等技术研究了肝癌模型组织中γ-BBD的基因表达;探讨了13-cis-RA对大鼠肝癌细胞γ-BBD基因表达的影响,为阐明RA对肝癌细胞肉碱合成的影响提供理论依据。
1 材料与仪器
1.1 实验细胞
RH-35大鼠肝癌细胞(KCB 92022YJ),购于中国科学院昆明动物研究所。
1.2 实验动物
雄性Sprague Dawley(SD)大鼠,购于昆明医科大学SPF实验动物中心,动物生产许可证号:SCXK(滇)K2015-0002,动物合格证号:53004100000036。
1.3 试剂
N-Nitrosodiethylamine(sigma,N0756);13-cis-RA(sigma,R3255);DMEM,High Glucose,GlutaMAXTM,Pyruvate(Gibco,10569010);胎牛血清(Gibco,10270106);0.25%胰蛋白酶-EDTA消化液(索莱宝,T1300);1×PBS缓冲液(PH7.2~7.4)(索莱宝,P1020);RIPA组织细胞裂解液(索莱宝,R0010);BCA蛋白定量试剂盒(天根,PA115);Anti-Actin antibody(SAB,21338);Anti-Gamma-Butyrobetaine Dioxygenase antibody(abcam,ab96348);Anti-Retinoid X Receptor Gamma antibody(abcam,ab53162);Goat Anti-Rabbit IgG-Hrp conjugated(SAB,L3012);Pro-light HRP化学发光检测试剂(天根,PA112);细胞周期与细胞凋亡检测试剂盒(碧云天,C1052);动物组织总RNA提取试剂盒(天根,DP413);TRNzolA+总RNA提取试剂(天根,DP421);Recombinant DNase I(宝生物,2270A);RevertAid H Minus First Strand cDNA Synthesis Kit(Thermo,K1632);LightCycler®480 SYBR Green I Master(Roche,04707516001)。
1.4 仪器
超高速流式细胞分析分选工作站(Partec,德国);微量核酸蛋白定量仪(BDT,美国);化学发光成像系统(Bio-Rad,美国);实时荧光定量PCR仪(ABI7300,美国)。
2 实验方法
2.1 DEN诱发肝癌
40只雄性SD大鼠,体重160~180 g,适应性饲养4天后,随机分为肝癌模型组(n=20)和正常对照组(n=20)。在常规饮食、饮水基础上,模型组腹腔注射50 mg/kg公斤体重DEN[13],每周一次;正常对照组腹腔注射0.9%NaCl溶液,每周一次。DEN诱导肝硬化和肝癌形成期间,每两周处死一只大鼠,跟踪观察肝硬化和肝癌形成情况,至16周后将所有动物处死。
2.2 肝组织HE染色
肝组织用(10%)甲醛固定、脱水、石蜡包埋切片,按常规操作用苏木精-伊红(HE)染色,光镜下观察肝组织的细胞形态学变化。
2.3 细胞培养
用含10%胎牛血清的DMEM于5%CO2、37 ℃条件下传代培养RH-35细胞。待细胞在25 cm2直角斜颈培养瓶中长满后,弃去培养基,用1×PBS缓冲液(pH7.2~7.4,0.01 mmol/L)清洗细胞两次,加入1 mL 0.25%胰蛋白酶-EDTA消化液,待大部分细胞变成圆形时轻轻拍打培养瓶使细胞悬浮,然后立即加入2 mL完全培养基终止消化。将胰蛋白酶消化细胞转移到50 mL离心管中1 000 rpm离心5 min,弃去上清液,加入13 mL完全培养基并吹打均匀,再将细胞转移至6孔板或25 cm2直角斜颈培养瓶中培养。待细胞长满80%左右时,视黄酸处理组细胞在培养基中加入13-cis-RA使其终浓度为1 μmol/L[14,15],对照组细胞在培养基中按常规继续培养。
2.4 流式细胞术测定细胞周期
视黄酸处理组(n=3)于13-cis-RA处理大鼠肝癌细胞48 h后,与对照组细胞(n=3)一起以PI单染法流式细胞术分析RH-35细胞的细胞周期进程。所有细胞用胰酶消化收集后,经PBS溶液洗涤并加入1 mL冰浴预冷的70%乙醇,4 ℃固定12~24 h,细胞再经PBS洗涤后加入按细胞周期与细胞凋亡检测试剂盒说明书操作配制好的碘化丙啶染色液0.5 mL,37 ℃避光温浴30 min,用流式细胞仪检测并分析DNA含量和细胞周期进程。
2.5 蛋白质印迹技术检测γ-BBD和RXRγ翻译水平的表达
通过Western blotting技术对DEN诱发的肝癌模型组(n=12)、正常肝组织对照组(n=13)的γ-BBD和RXRγ的蛋白表达水平进行测定。分别在视黄酸处理12 h(n=8)、24 h(n=8)和48 h(n=8)后提取RA处理组和对照组(n=24)细胞总蛋白,通过western blotting技术对γ-BBD和RXRγ的蛋白表达水平进行测定。肝组织按RIPA说明书每20 mg加入150~250 μL组织细胞裂解液,6孔板培养肝细胞按每孔细胞加入150~250 μL裂解液裂解肝细胞,裂解液经离心后取上清用BCA法测定总蛋白浓度。取含35 μg总蛋白的裂解液于12%分离胶、5%浓缩胶中进行SDS-PAGE电泳,采用半干转移法将总蛋白转移到PVDF膜上。转膜后用5%脱脂奶粉溶液于室温条件下封闭2 h,按抗体说明书加入适量I抗4 ℃孵育过夜,用含1‰Tween-20的TBS-T洗膜3次,再加入II抗(1∶10 000)室温孵育2 h。用TBS洗膜2次,每次10 min。用化学发光试剂显影,Image-Pro Plus6.0图像分析软件进行灰度分析,以β-actin作为内参进行相对半定量分析。
2.6 实时荧光定量PCR技术检测γ-BBD和RXRγ转录水平的表达
通过real-time PCR技术对DEN诱发的肝癌模型组(n=12)、正常肝组织对照组(n=13)的γ-BBD和RXRγ的mRNA表达水平进行测定。分别在视黄酸处理24 h(n=8)和48 h(n=8)后提取RA处理组和对照组(n=16)细胞总RNA,通过real-time PCR技术对γ-BBD和RXRγ的mRNA表达水平进行测定。肝组织总RNA提取按动物组织总RNA提取试剂盒说明书进行操作,培养肝细胞总RNA提取按TRNzol-A+总RNA提取试剂盒说明书进行操作。所有总RNA样品先用琼脂糖凝胶电泳鉴定质量,随后定量、用DNAase I消化基因组DNA。总RNA样品再定量后按RevertAid H Minus First Strand cDNA Synthesis Kit试剂盒说明书操作将肝细胞内的mRNA逆转录成cDNA,20 μL逆转录反应体系中加入RNA模板2 μg、1 μL通用引物Oligo(dT)18。所有cDNA溶液经定量后按LightCycler®480 SYBR Green I Master说明书计算并配制PCR反应体系,20 μLPCR反应体系中引物的终浓度为0.5 μmol/L、cDNA模板加70 ng。每个样本至少做3个平行反应。PCR反应条件:95 ℃预变性10 min,95 ℃变性5 min,60~62 ℃退火10 s,72 ℃延伸30 s,循环45次。PCR反应结束后,以β-actin作为内参,用2-△△Ct定量方法对基因表达产物进行相对定量分析。β-actin、γ-BBD和RXRγ的引物序列见表1。
2.7 统计学处理方法
采用SPSS22.0软件进行统计学分析,实验结果以平均值±标准差表示,组间比较采用t检验或单因素方差分析,P<0.05为差异有统计学意义。
3 实验结果
3.1 DEN诱发大鼠原发性肝癌
在接受DEN给药方案的大鼠中,大鼠肝脏的外观于12周时开始出现明显变化,肝表面失去原有光泽,颜色变浅、表面粗糙,可见部分结节(图1A)。至DEN给药14周时,肝表面更粗糙,且结节数量明显增多、增大(图1B)。于DEN给药16周时,肝脏表面结节进一步增多且出现数量较多的大结节(图1C),但对照组肝脏外观无任何变化(图1D)。取肝组织行HE染色组织学检查,DEN处理14周时肝组织在光镜下表现为肝脏内弥漫性纤维组织增生,炎性细胞浸润,假小叶形成,小叶内肝细胞排列杂乱,部分细胞出现异型性(图2A)。尤其是,在DEN处理16周后肝组织在光镜下明显表现为细胞大小不一,排列杂乱,细胞核大、深染,形态怪异,异型性细胞明显增多,胞浆嗜碱性,血窦闭塞,部分细胞坏死(图2B);但0.9%NaCl给药14周和16周的对照组肝细胞则有规律地排列成条索状,细胞及细胞核大小一致,染色均匀(图2C,2D)。以上实验表明按50 mg/kg公斤体重的DEN腹腔给药方案在药物作用14周时肝脏出现明显肝硬化和组织增生,在药物作用16周时大鼠肝组织在进行性肝硬化基础之上出现癌变的形态学变化。

表1 PCR反应中使用的引物和条件
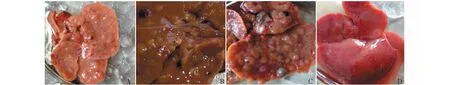
图1 DEN处理的大鼠肝组织与对照肝组织Fig.1 Rat liver tissue treated with DEN and control liver tissue注:(A)DEN处理12周的肝组织;(B)DEN处理14周的肝组织;(C)DEN处理16周的肝组织;(D)0.9%NaCl处理16周的肝组织。Note:(A)Rat liver tissue treated with DEN for 12 weeks;(B)Rat liver tissue treated with DEN for 14 weeks;(C)Rat liver tissue treated with DEN for 16 weeks;(D)Rat liver tissue treated with 0.9%NaCl for 16 weeks.
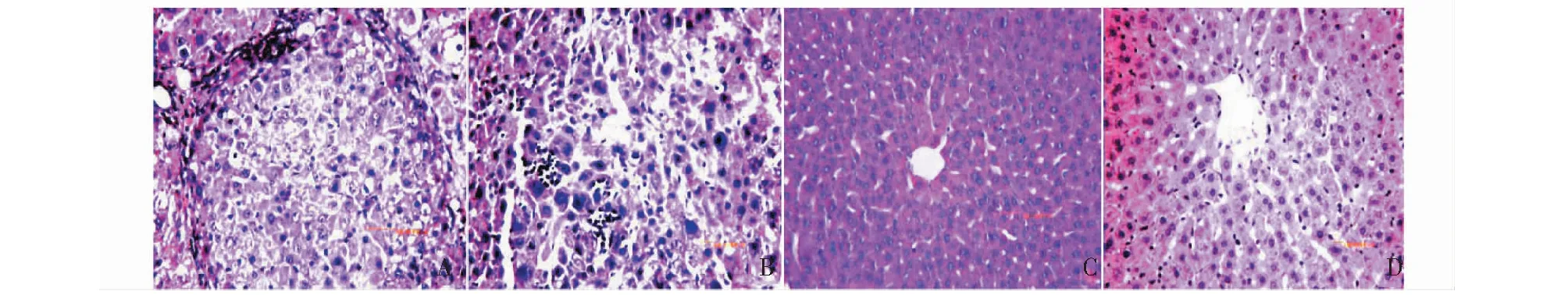
图2 肝组织HE染色(×400)Fig.2 Liver tissue HE staining(×400)注:(A)DEN处理14周的肝组织;(B)DEN处理16周的肝组织;(C)0.9%NaCl处理14周的肝组织;(D)0.9%NaCl处理16周的肝组织。Note:(A)Rat liver tissue treated with DEN for 14 weeks;(B)Rat liver tissue treated with DEN for 16 weeks(C)Rat liver tissue treated with 0.9%NaCl for 14 weeks;(D)Rat liver tissue treated with 0.9%NaCl for 16 weeks.
3.2 γ-BBD在DEN诱发的大鼠原发性肝癌中的表达
与对照组相比,在接受DEN给药方案的大鼠中,肝癌模型组γ-BBD的蛋白表达水平显著低于对照组(P<0.05)(图3);荧光定量PCR分析也发现肝癌模型组γ-BBD的mRNA丰度明显低于对照组(P<0.05)(图4A)。这些结果表明,DEN诱发的大鼠原发性肝癌细胞下调了γ-BBD的表达。
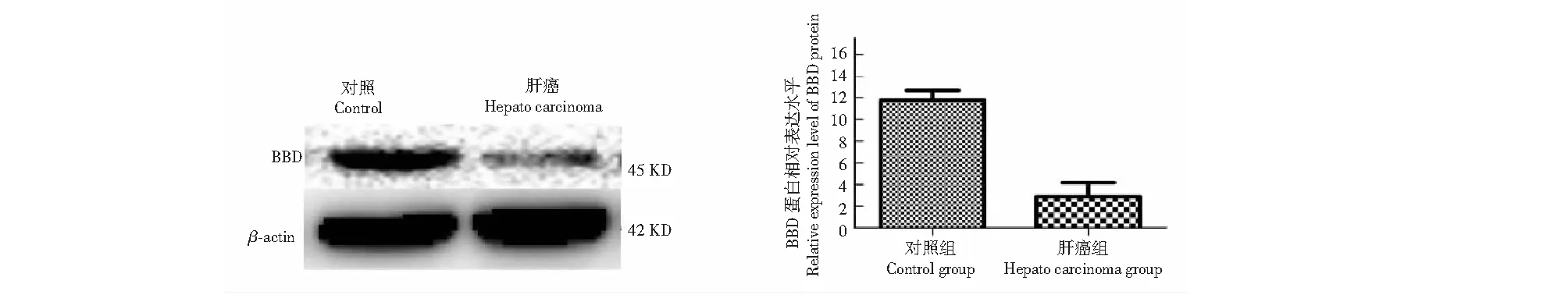
图3 大鼠肝组织BBD的western blotting 分析Fig.3 Western blotting analysis of BBD in rat liver tissue

图4 大鼠肝组织BBD和RXRγ的qRT-PCR 分析Fig.4 qRT-PCR analysis of BBD and RXRγ in rat liver tissue
3.3 RXRγ在DEN诱发的大鼠原发性肝癌中的表达
与对照组相比,肝癌模型组RXRγ的蛋白表达水平显著低于对照组(P<0.05)(图5),荧光定量PCR分析也发现RXRγ的mRNA丰度明显低于对照组(P<0.05)(图4B)。这些结果表明,DEN诱发的大鼠原发性肝癌细胞也下调了RXRγ的表达。

图5 大鼠肝组织RXRγ的Western blotting 分析Fig.5 Western blotting analysis of RXRγ in rat liver tissue
3.4 13-cis-RA对RH-35细胞RXRγ表达的影响
RH-35细胞经1 μmol/L13-cis-RA处理12~48 h后,与对照组比较,RXRγ的蛋白表达水平显著增加,13-cis-RA处理48 h后RXRγ蛋白表达水平增加最为显著(P<0.05,图6)。为了进一步确定13-cis-RA对RH-35细胞RXRγ表达的影响是否发生在转录水平,实时荧光定量PCR技术被用来分析RXRγ转录水平的表达,结果显示,在13-cis-RA处理24、48 h后,与对照组相比,13-cis-RA处理组RXRγmRNA的丰度明显升高(P<0.05,图7A)。这些实验结果表明,13-cis RA能诱导并上调肝癌细胞RXRγ的表达。
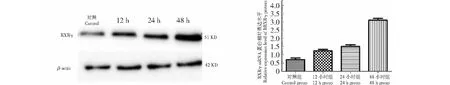
图6 13-cis-RA对RH-35细胞RXRγ蛋白表达的影响Fig.6 The effects of 13-cis-RA on the expression of RXRγ protein in RH-35 cell
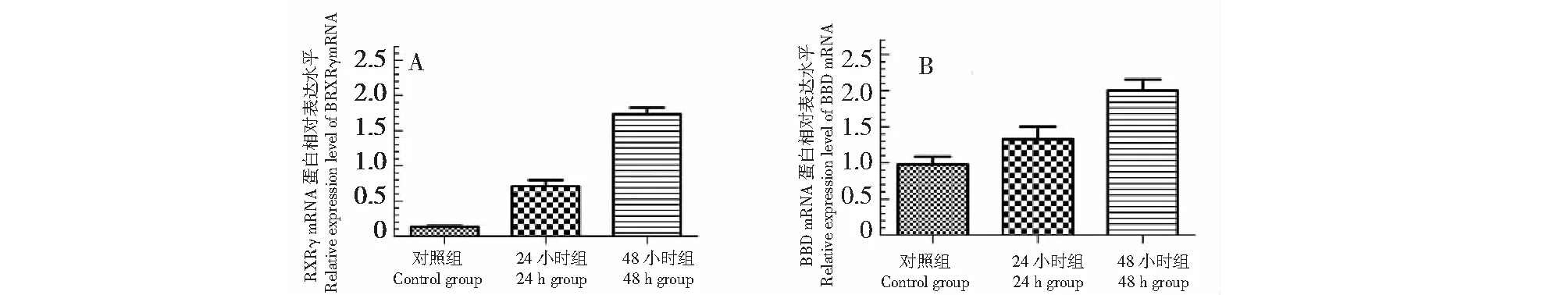
图7 13-cis-RA对RH-35细胞γ-BBD mRNA和RXRγ mRNA表达的影响Fig.7 The effects of 13-cis-RA on the expression of γ-BBD mRNA and RXRγ mRNA in RH-35 cell
3.5 13-cis-RA对大鼠肝癌细胞细胞周期进程的影响
在用1 μmol/L的13-cis-RA处理大鼠肝癌细胞48 h后,与对照组相比较,13-cis-RA处理组的细胞G1期细胞数量分布明显增加(P<0.05),S期细胞数量分布显著减少(P<0.05)(图8),细胞周期分析的定量结果也在表2中显示。以上结果表明,1 μmol/L的13-cis-RA处理RH-35细胞48 h后,细胞周期明显阻滞于G1期,大鼠肝癌细胞处于显著的细胞增殖抑制状态。

图8 13-cis-RA对RH-35细胞周期进程的影响Fig.8 The effects of 13-cis-RA on RH-35 cell cycle progression注:(A)对照组;(B)13-cis-RA处理组。Note:(A)Control group;(B)13-cis-RA-treated group.
表2 13-cis-RA对RH-35细胞周期进程的影响
注:与空白对照组相比,*P< 0.05。
Note:Compared with control group,*P< 0.05.
3.6 13-cis RA对RH-35细胞γ-BBD表达的影响
RH-35细胞经1 μmol/L 13-cis-RA作用12~48 h后,与对照组比较,γ-BBD的蛋白表达水平显著增加,13-cis-RA处理48 h后γ-BBD蛋白表达水平增加最为显著 (P<0.05,图9)。但是,γ-BBD的蛋白表达水平在13-cis-RA处理12 h组与13-cis-RA处理24 h组之间无显著性差异(P> 0.05,图9)。为了进一步确定13-cis-RA对RH-35细胞γ-BBD表达的影响是否发生在转录水平,实时荧光定量PCR技术被用来分析γ-BBD转录水平的表达,结果显示,与对照组相比,在13-cis-RA处理24、48 h后,γ-BBD mRNA的丰度明显升高(P<0.05,图7B)。这些结果表明13-cis-RA在转录和翻译水平上调了γ-BBD的表达。
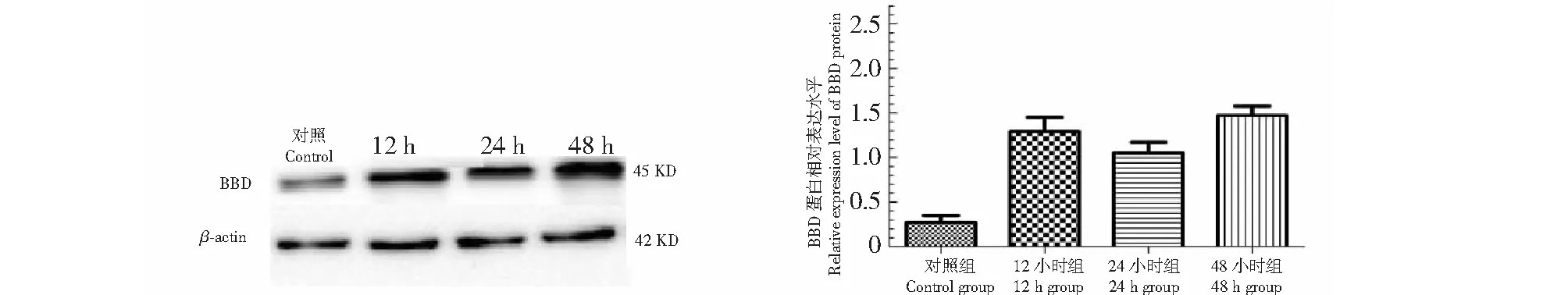
图9 13-cis-RA对RH-35细胞γ-BBD蛋白表达的影响Fig.9 The effects of 13-cis-RA on the of γ-BBD protein in RH-35 cell
4 结论
DEN诱发大鼠肝癌模型因其诱癌成功率高,诱发癌变的病理变化过程与各种原因引起的大鼠和人肝细胞癌变过程相似而被广泛应用[13,16]。不管是什么原因引起的肝癌,其发展过程一般都要经历肝硬化—再生性结节—腺瘤性增生—早期肝癌—进展期肝癌的病理变化过程[13,16]。临床上或肝癌模型制备过程中常以肝脏宏观的形态学变化、HE染色镜下肝硬化形态学变化以及组织、细胞异型性增生的形态学特点作为判断典型癌变肝组织的重要指标。本研究采用Seong Tae Park等[13]的研究方法制备大鼠原发性肝癌模型,肝脏于12周时开始出现肝硬化结节,至DEN给药14周时,肝表面结节数增多、增大,HE染色可见弥漫性纤维组织增生、假小叶形成等典型的肝硬化表现。于DEN给药16周时,肝脏表面出现明显且数量较多的大结节,HE染色组织学检查发现细胞大小不一,排列杂乱,细胞核大、深染,形态怪异,异型性明显。因此,至诱癌16周结束时,大鼠肝组织已表现出典型的肝硬化基础上癌变的病理学特征。而且,这些进行性变化的形态学特征与多项DEN诱发原发性肝癌的报道相似[13,16]。这说明50 mg/kg公斤体重的DEN腹腔给药方案能成功诱发大鼠原发性肝癌。
L-肉碱作为脂肪酸分解代谢必不可少的载体,其合成有可能随脂代谢重编程而被协调调节。本研究用DEN诱发大鼠原发性肝癌,通过western blotting等技术分析了大鼠原发性肝癌模型γ-BBD的表达,结果证实了γ-BBD在进展期肝癌模型组织中转录水平和翻译水平的表达是下调的,提示,DEN诱发的大鼠原发性肝癌模型中的肉碱合成可能下调。研究发现,γ-BBD是PPARα调控的靶基因[17];另有研究还发现RXRγ活化和过表达能上调PPARα的表达[18]。因此,DEN诱导的原发性肝癌模型细胞中γ-BBD表达的调控模式可能与RXRγ的基因表达调控模式有关。本研究通过western blotting等技术证实了DEN诱发的大鼠原发性肝癌模型中RXRγ的表达是下调的,与γ-BBD的调控趋势一致。提示,DEN诱发的原发性肝癌模型中γ-BBD的低表达调控模式可能与与RXRγ的低表达有关。
据报道,RA能上调RXRγ的表达[14,19,20],因此RA干预有可能通过影响肝癌细胞RXRγ的表达进而影响γ-BBD的表达。本研究证实了13-cis-RA在药物诱导48 h这一时间点能显著上调大鼠肝癌细胞RXRγ的表达。一些研究还发现RXRγ在癌细胞中低表达与癌发生、增殖以及低分化有关[15,19],因此本研究用流式细胞术观察RA对大鼠肝癌细胞细胞周期的影响,结果也表明在13-cis-RA作用48 h这一时间点,RH-35细胞表现出显著的G1期阻滞。提示,RA上调肝癌细胞RXRγ的表达可能与癌细胞重分化有关。在此基础之上,本研究通过western blotting等技术检测了13-cis-RA对大鼠肝癌细胞γ-BBD表达的影响,结果也发现在RA作用48 h这一时间点,γ-BBD在转录水平和翻译水平的表达均显著上调。提示,13-cis-RA可能在诱导细胞重分化时期通过上调RXRγ的表达促进PPARα表达,进而影响了γ-BBD的表达。研究发现单独的PPARs不能直接调控靶基因,需与RXRs结合形成异二聚体才能发挥作用[1,2],因此本研究中13-cis-RA还可能在细胞内通过异构成9-cis-RA后,与PPARs:RXRs中的RXRs连接直接活化该异二聚体[1,2,5,20,21],进而增强γ-BBD的转录。
综上所述,DEN诱发的原发性大鼠肝癌模型有可能因γ-BBD下调而下调肉碱合成代谢;但是,13-cis-RA能上调γ-BBD的表达,因此13-cis-RA可能影响RH-35大鼠肝癌细胞的肉碱合成。13-cis-RA对γ-BBD表达的影响可能通过上调肝癌细胞RXRγ的表达,活化并增强PPARs:RXRs的转录活性而发挥作用。
