异质性万古霉素中介金黄色葡萄球菌的筛选和生物被膜形成能力的研究
2019-10-26杨靖娴邵冬华梁国威
王 兵 杨靖娴 邵冬华 梁国威
MRSA作为医院感染的常见病原菌之一,目前治疗主要依赖于糖肽类抗生素。随着万古霉素临床使用的增多,临床上已经出现了耐万古霉素金黄色葡萄球菌(VRSA)、万古霉素中介金黄色葡萄球菌(VISA)及异质性万古霉素中介金黄色葡萄球菌(hVISA),成为医学治疗的难题。目前认为hVISA作为VISA的前体,母代对万古霉素敏感,MIC≤2mg/L,但是子代中却存在少量可以在万古霉素含量≥4mg/L的BHI平皿上生长的亚群,发生率为10-6~10-5,在治疗过程中,随着不断存在的万古霉素的选择压力,导致hVISA克隆的增加,并逐渐发展为VISA,对万古霉素耐药[1]。目前在临床上还没有一种简单方便并且敏感度和特异性都比较高的方法用于hVISA筛选,这也成为困扰临床和实验室工作的难题。本研究以改良菌群分析策略-曲线下面积(PAP-AUC)方法作为金标准,对替考拉宁脑心浸液琼脂平皿筛选方法进行评价,了解笔者医院hVISA的发生率,探索出适合笔者医院检验科hVISA的筛选方法和平台,以便尽早发现并向临床报道hVISA,引起临床的重视[2]。同时,笔者也探索了hVISA菌株的生物被膜形成能力以及生物被膜中细菌对抗生素的敏感度,筛选出对其敏感的抗生素,期待对临床有提示作用,尽早采取措施,避免VISA和VRSA的发生。
材料与方法
1.菌株来源:收集航天中心医院2014~2017年临床分离的139株MRSA菌株,其中痰标本59株,血标本37株,鼻拭子19株,分泌物9株,其他15株,所有菌株均经过VITEK2-Compact仪器鉴定,标准菌株ATCC700698(Mu3)购自美国典型菌种保藏中心。
2.试剂和材料:VITEK全自动细菌鉴定仪和比浊仪购自法国生物梅里埃公司,万古霉素和替考拉宁粉剂购自中国食品药品检定研究院,脑心浸液琼脂(brain heart infusion agar, BHIA)、胰蛋白胨大豆肉汤(tryptic soy broth, TSB)购自英国OXCID公司,刚果红干粉购自美国Sigma公司。
3.hVISA筛选:(1)替考拉宁琼脂平皿筛选法:挑取哥伦比亚血平板上培养过夜的MRSA单个菌落,用0.85%的NaCl溶液配置成0.5麦氏单位的菌悬液,吸取10μl菌液点种在含有替考拉宁5mg/L的BHIA(BHIA5T)上,35℃培养48h,平板上有≥1个菌落为hVISA阳性,每个菌株重复两次。以ATCC25923为阴性对照,Mu3为阳性对照。(2)改良菌群分析策略-曲线下面积法(PAP-AUC):制备不同浓度的万古霉素脑心浸液琼脂平板:每400ml BHI中分别加入10mg/ml的万古霉素母液0、20、40、80、100、160、240、320μl,配置成浓度为0、0.5、1.0、2.0、2.5、4.0、6.0、8.0mg/L 8个浓度的BHI平皿。在8ml的TSB中加入培养过夜的纯菌落,35℃振荡培养24h后形成的菌液定义为原液。将原液用0.85%的NaCl溶液稀释成105CFU/ml和102CFU/ml两种浓度,然后取原液和稀释菌液50μl分别均匀涂布到上述7个含万古霉素的浓度的BHIA上,充分晾干后在35℃温箱培养48h,以Mu3为阳性对照,ATCC29213为阴性对照。利用Graphpad Prism软件绘制菌落数lg对数值对万古霉素浓度的曲线并计算曲线下面积AUC,比较待测菌株的AUC与Mu3的AUC。目前公认的确认标准为(AUC待测菌株/AUCMu3)<0.9为万古霉素敏感的金黄色葡萄球菌(VSSA);(AUC待测菌株/AUCMu3)≥1.3为VISA;0.9≤(AUC待测菌株/AUCMu3)<1.3为hVISA。
4.生物被膜形成能力检测:(1)刚果红琼脂实验:将冻存菌株接种于哥伦比亚血平板上培养过夜,挑取单个菌落接种于刚果红平板上,37℃培养24h后于室温放置24h,观察培养结果。如果出现黑色干燥菌落则提示为生物膜阳性菌株,红色光滑菌落则提示为生物膜阴性菌株。(2)半定量黏附检测:采用96孔板培养、结晶紫染色法进行半定量检测。挑取在哥伦比亚血平板上培养24h的单个菌落,加入8ml的TSB培养液,摇菌过夜;取过夜的菌液用TSB配成0.5麦氏浊度;96孔板中每孔200μl,每个重复3孔,37℃培养24h; 吸取96孔板中的液体,用200μlPBS洗3次,弃去液体; 每孔加入200μl的无水乙醇固定15min,倒掉液体,自然晾干; 每孔加入0.5%的结晶紫200μl,染色2min,PBS洗3次,加入100μl无水乙醇室温放置10min,595nm处测吸光度值(A值)。按照Christensen等1985年提出的生物被膜黏附程度的分类方法,将生物被膜分为不黏附、弱黏附、中等黏附和强黏附4种,采用微孔板法测定生物被膜的临界A值(AC),AC等于空白对照的A均值加上其3倍标准差,因此可以根据以下A范围进行生物被膜分类:A≤AC为不黏附,AC
5.最低抑菌浓度(minimium inhibition concentration, MIC)和最低抑制生物被膜浓度(minimum biofilm inhibitory concentration, MBIC)测定:采用2015年版美国临床和实验室标准协会推荐的微量肉汤稀释法测定MIC。然后,体外制备生物被膜模型,用TSB将万古霉素做梯度稀释,浓度范围为1×MIC~1024×MIC。取200μl加入96孔板生物被膜模型中,无菌TSB作为阴性对照。37℃培养24h,将肉眼观察无浑浊孔的最低药物浓度即MBIC。
结 果
1.替考拉宁琼脂平皿筛选:139株MRSA经过BHIA5T初筛阳性46株。S131、S134和S92菌株在平皿上有菌落生长,为BHIA5T初筛阳性菌株,Mu3为阳性对照,ATCC25923为阴性对照,详见图1。

图1 BHIA5T筛选结果
2.hVISA的临床分离率:139株MRSA经过PAP-AUC方法检测,确定hVISA阳性菌株仅1株,为S92,来源于血标本,因此血标本中hVISA的分离率为2.7%,笔者医院临床上hVISA的总体分离率为0.72%。这例患者的万古霉素MIC的浓度为2μg/ml,之前的研究结果也显示hVISA菌株的万古霉素的MIC一般集中在1~2μg/ml。PAP-AUC结果如图2所示。

图2 菌群分析/曲线下面积(PAP-AUC)图ATCC700698(Mu3)作为阳性质控菌株,ATCC29213作为阴性质控菌株,AUCS92/AUCMu3=1.21,因此S92为hVISA菌株
3.hVISA的生物被膜形成能力:经过刚果红琼脂实验,S92菌株菌落明显变黑,显示有生物被膜形成(图3),随后进行96孔板的培养和结晶紫染色,发现96孔板的底部有明显的生物膜形成,通过分光光度计检测,A值(1.00±0.05)明显高于万古霉素敏感的29213菌株(0.39±0.05),空白对照的Ac为0.14,因此,依据A值范围对生物被膜进行分类,S92属于强黏附的生物被膜菌株。
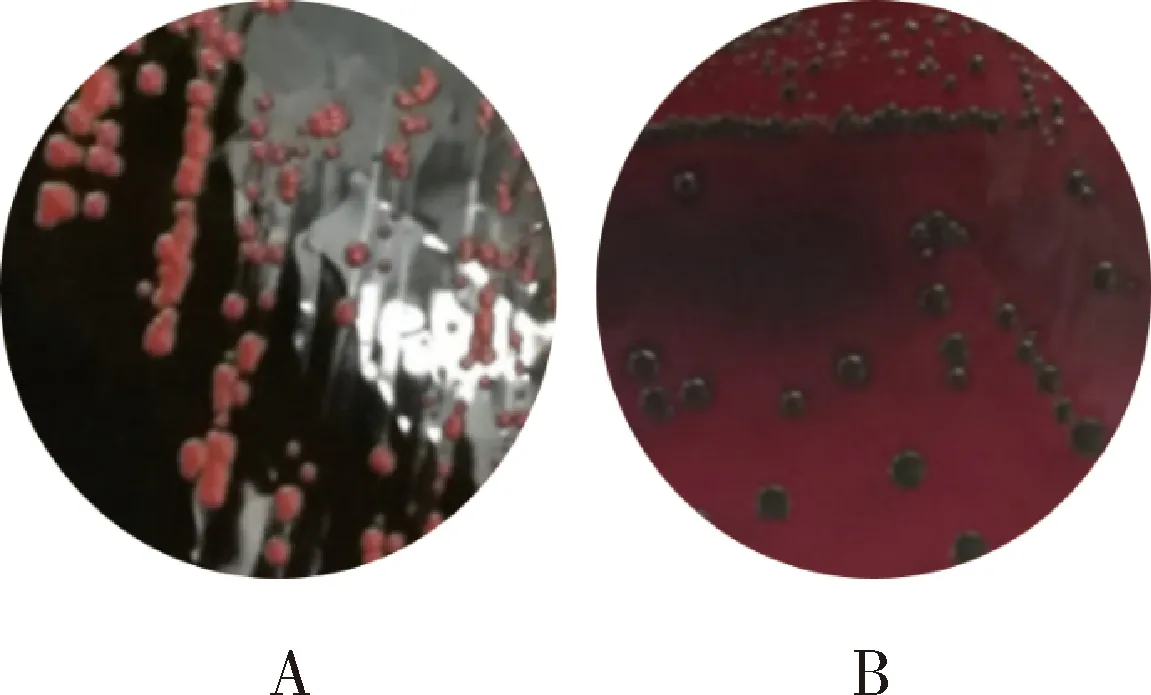
图3 刚果红琼脂实验A.菌落呈现红色,无生物被膜形成;B.菌落呈现黑色,生物被膜形成阳性
4.低浓度的万古霉素对生物被膜的影响:在研究中笔者将培养S92菌株的96孔板中加入了1/4MIC即0.5mg/L的万古霉素,发现此菌株形成生物被膜能力增强了,A值为1.26±0.22,但是万古霉素浓度增加为1mg/L时,形成的生物被膜减弱了,A值为0.57±0.12(图4)。

图4 低浓度万古霉素对生物被膜的影响
5.生物被膜中细菌对万古霉素的敏感度降低:通过研究发现S92菌株的最低抑制生物被膜浓度(MBIC)明显升高,256μg/ml的万古霉素浓度才能完全抑制生物被膜的生长,生物被膜中的细菌对万古霉素的敏感度降低,MIC值升高。
讨 论
自万古霉素1958年被美国FDA批准应用于MRSA引起的感染,一直以来对革兰阳性菌保持着较高的活性,但是自1997年日本首次报道hVISA以来,多个国家也陆续报道发现了hVISA和VISA[4~7]。hVISA存在于VISA前期,虽然hVISA的母代对万古霉素敏感,但是在万古霉素的选择压力下,hVISA克隆增加,最终形成VISA,对万古霉素耐药,并且hVISA存在不同的表型和生物学变化,导致在临床工作中难以辨认,不能及时发现,因此尽早筛选出hVISA菌株并向临床报道就至关重要[8]。目前hVISA的检测方法很多,作为金标准的PAP-AUC方法需要螺旋涂布仪和标准菌株Mu3,耗时费力,无法在临床常规工作中开展。这几年推荐的宏量E试验法,操作简单,重复性好,也有较高的敏感度和特异性,但是需要万古霉素和替考拉宁的E-test条,价格昂贵,也难以在临床工作中推广。Wang等[9]报道显示可以用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)进行hVISA检测,但筛选效果有待进一步的验证。目前应用较多的筛选方法仍然为含万古霉素或者替考拉宁的脑心浸液琼脂平皿筛选法,本研究选用敏感度较高的BHIA5T进行初筛,初筛阳性的菌株再经过PAP-AUC检测。
不同国家和地区的hVISA分离率差异很大。Chung等[10~13]报道亚洲地区hVISA分离率为3.5%,美国为5.9%,2007年我国14个城市hVISA的检出率为9.5%,最新报道的山东省检出率为5.6%。本研究收集了笔者医院的139例菌株进行检测,发现了1例来源于血标本的hVISA,分离率为0.72%。相对于其他医院的报道,目前笔者医院hVISA的发生率是比较低的,分析原因有两点:(1)本研究是一个单中心的研究,纳入的MRSA菌株相对较少,人群单一。(2)本研究纳入的是患者初次入院分离冻存的菌株,没有经过抗生素的选择压力,耐药性相对较弱。
目前笔者对hVISA的耐药机制并不是非常了解,比较肯定的是hVISA菌株的细胞壁增厚,增厚的细胞壁交联会明显减少,使游离的D-丙氨酰-D-丙氨酰侧链含量增加,这些游离的侧链可以与万古霉素结合,导致万古霉素被固定在细胞壁中,无法到达作用的靶点。Gregorio等[14]通过自溶实验分析发现,与万古霉素敏感的金黄色葡萄球菌比较,hVISA/VISA菌株的自溶活性明显降低[15]。另外,近期的研究提示hVISA的耐药可能与生物被膜形成相关,但是对于hVISA菌株的生物被膜形成能力却存在争议。Xu等[15]却报道了hVISA菌株的生物被膜形成能力降低,而Szymanek-Majchrzak等[16]发现对糖肽类抗生素不敏感的MRSA菌株生物被膜形成明显增强。Kaplan[17]报道了低浓度的抗生素可以促进生物膜的形成。Abdelhady等[18]报道了对万古霉素治疗无效的5株MRSA菌株中有4株在低浓度的万古霉素存在时,生物被膜形成能力明显增强。
本研究发现的S92也是一个强黏附的生物被膜菌株,并且在加入低浓度的万古霉素后,S92的生物被膜形成能力增强,显示低浓度的万古霉素对生物被膜有促进作用[17,18]。Chang等[19]研究也证明万古霉素在体外可以诱导hVISA菌株的耐药性增强,并且在诱导过程中,发现与生物被膜黏附、聚集和增殖阶段相关的多个基因如fnbA、atlA、icaA等的mRNA量增加,细菌的生物被膜形成能力逐渐增加。同时,笔者观察到hVISA菌株形成生物被膜后,需要明显提高万古霉素浓度才能抑制细菌的生长。通过K-B法检测研究发现hVISA菌株对利奈唑胺和替加环素依然敏感,这与之前的报道也是一致的[20]。这提示在临床上怀疑有hVISA存在,并且万古霉素治疗时间长,不排除有生物膜形成时,可尝试换用利奈唑胺和替加环素进行治疗。
由于本研究只发现了1株hVISA,无法进行统计分析和分子检测,后续希望能够扩大样本量继续研究,在分子层面探索hVISA的耐药机制以及生物被膜形成能力,为临床治疗提供更加可靠的依据。
本研究是首次检测创建笔者医院hVISA的检测平台,并发现了1株hVISA,它的生物被膜形成能力强,并且低浓度的万古霉素对生物膜的形成有促进作用,这需要引起临床的高度重视,合理使用抗生素尤其是糖肽类药物,也可尝试换用利奈唑胺或替加环素,以避免VISA和VRSA产生,感染控制不佳,临床治疗失败。
