马兜铃酸类成分研究进展*
2019-10-22郭日新马双成
刘 静,郭日新,戴 忠,马双成
(中国食品药品检定研究院 北京 100050)
2017年10月,Science Translation Medicine刊出“台湾及亚洲地区肝癌发病与马兜铃酸及其衍生物高度相关”的文章[1],再次引发社会各界对含马兜铃酸中药安全性的广泛关注与热议。自上世纪90 年代马兜铃酸肾毒性报道以来,许多国家和地区相继禁止使用含有或疑似含有马兜铃酸成分的药材与制剂。我国在2003-2004 年也采取了一些风险控制措施,包括禁止使用马兜铃酸含量高的关木通、广防己和青木香等药材,同时明确对含马兜铃、寻骨风、天仙藤和朱砂莲的制剂严格按处方药管理等[2-11]。但是,一些马兜铃酸成分含量低的中药材饮片与中成药仍在使用中,鉴于马兜铃酸类成分明确的肾毒性、致癌致突变等危害[2-11],有必要进一步加强相关产品的风险评估。因此,本文在总结马兜铃酸类成分信息的基础上,对其检测方法、标准收载及限度规定等研究现状进行了调研分析,为其准确检测提供了技术借鉴与参考,同时也为有关产品的风险控制与安全使用提供了科学依据。
1 成分信息
从结构上看,马兜铃酸类似物是具有硝基菲母核的一类化合物,包括马兜铃酸(aristolochic acids,AAs)和马兜铃内酰胺(aristolactams,ALs)两种结构类型(图1),其中马兜铃内酰胺除在某些植物中存在外,也被认为是马兜铃酸经硝基还原酶还原产生的代谢产物[12-15]。报道显示,马兜铃酸类似物主要存在于马兜铃属及细辛属等马兜铃科植物中,主要包括20 多个化合物,由表1可见其结构非常类似,有的还是同分异构体,结构差异在于羟基和/或甲氧基取代位置的不同(表1)。
马兜铃酸类化合物虽然报道较多,但文献调研显示研究整体集中于马兜铃酸I,分析主要因其含量相对比较高且毒性明确,此外还涉及马兜铃酸II、III、IVa、马兜铃内酰胺I 等成分[16-42,46-53]。例如,陈婧等研究显示辽细辛根和根茎中马兜铃酸IVa的含量高于马兜铃酸I[20]。田禾苗等研究认为由于马兜铃酸类成分是马兜铃药材中的主要有毒成分,因此以马兜铃酸III、7-羟基马兜铃酸I、马兜铃内酰胺I、马兜铃酸I 为指标成分能更全面地评价和控制马兜铃的毒性[27]。
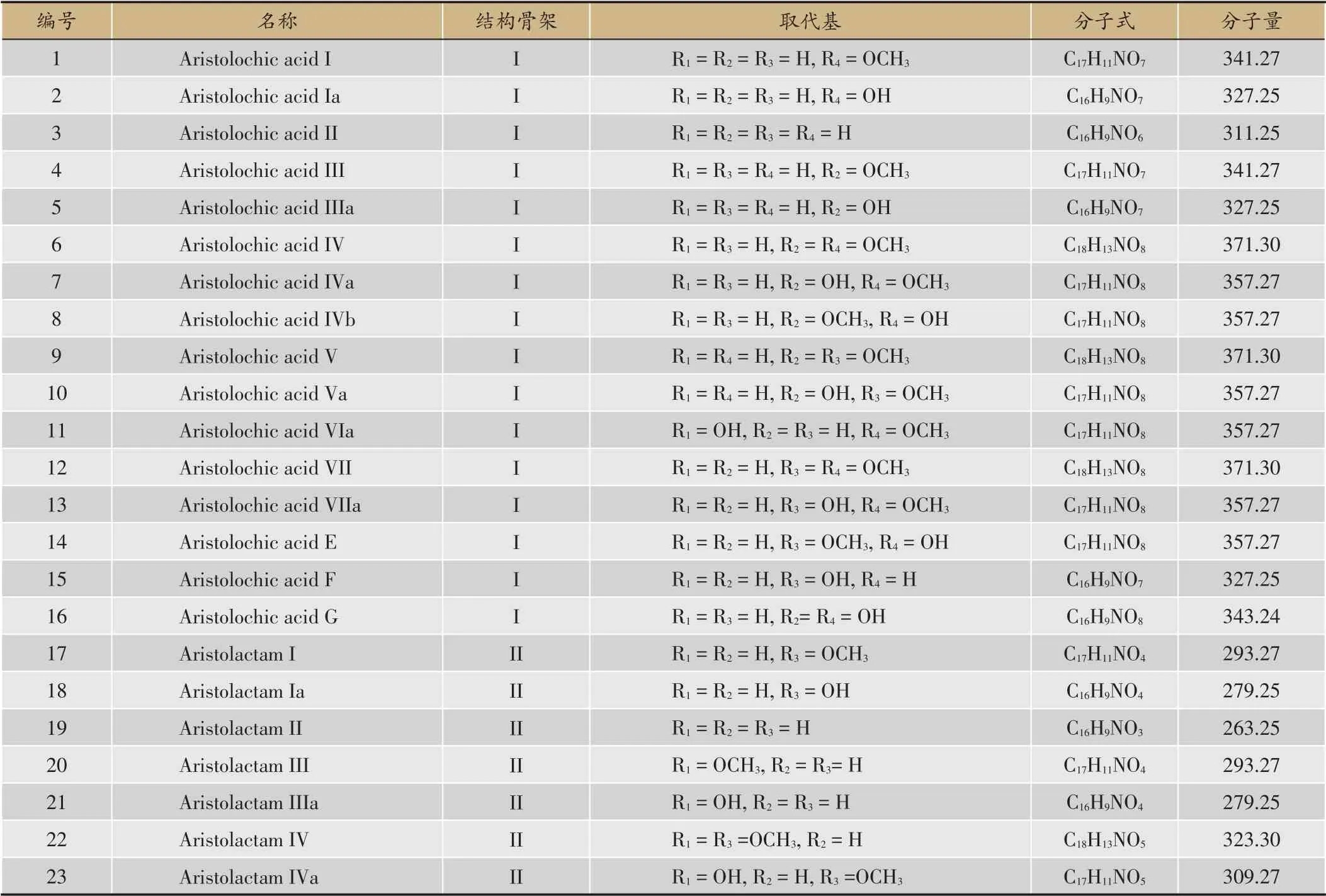
表1 部分马兜铃酸类似物基本信息
2 研究现状
2.1 毒性作用
1993 年,比利时学者在《柳叶刀》(Lancet)杂志报道的马兜铃酸肾病事件,引起人们对于马兜铃酸类成分毒性作用的广泛关注与重视[2-3]。随后十年间,大量文献报道了马兜铃酸类成分的肾毒性、致癌致突变作用,相关成分主要涉及马兜铃酸I 和II[4-10]。近十余年来,马兜铃酸毒性作用相关的文献报道主要集中于作用机制方面的研究[54,55]。
马兜铃酸肾毒性作用的研究报道较多,目前尚无关于损伤机制的统一观点,但有几个主要研究方向,一是肾小管上皮细胞坏死或凋亡机制,研究表明大剂量马兜铃酸可直接损伤肾小管上皮细胞导致细胞坏死或凋亡,其主要分子机制涉及微小RNA、内质网应激和氧化应激。二是肾小管上皮细胞转分化机制,研究显示长期小剂量马兜铃酸导致肾脏损害的重要特征是肾间质纤维化,而肾小管上皮细胞转分化则是肾间质纤维化的主要机制。三是DNA损伤方面,研究表明马兜铃酸与DNA 形成的加合物在肾脏蓄积也可能是马兜铃酸肾毒性机制之一;此外还有细胞毒假说、代谢酶与肾损伤等方面的报道[4-10,54,55]。

图1 马兜铃酸(I)和马兜铃内酰胺(II)结构骨架
马兜铃酸类似物的致癌致突变作用研究显示其主要分子机制是马兜铃酸-DNA 加合物的形成,其中脱氧腺苷-马兜铃酸加合物可导致腺嘌呤(A)与胸腺嘧啶(T)的转换突变,即AT→TA。有研究人员采用Ames波动试验对AAI、AA II、AA III 和AA IV 4 种成分的致突变作用进行了对比研究,结果表明AA I、AA II在-S9和+S9条件下均显示出较强的致突变作用,AA II 致突变作用强于AA I;AA III和AA IV对2株菌株均未显示出明显的致突变作用[56]。
2.2 检测方法
文献调研显示马兜铃酸类成分的检测分析方面的报道较多,其中检测技术涵盖薄层色谱法、液相色谱法、液质谱联用法、酶联免疫法和毛细管电泳法等多种分析技术与方法[16-53],以色谱法最为常用。随着现代分析仪器与技术的快速发展,其中薄层扫描法目前已很少应用,尤以液相色谱及联用技术应用最为普遍。
马兜铃酸类成分的结构决定其具有典型的紫外吸收特征,因此,液相色谱法又以HPLC-UV 最为经典常用,也是《中华人民共和国药典》(2015 版)一部(简称“2015 版药典一部”)收载的方法。总结发现文献报道的主要差别在于检测波长不同(UV 250、252、254、260 nm)、流动相不同(甲醇或乙腈-含酸或缓冲盐系统)以及色谱柱类型及型号不同[19-30]。例如凌鸿等采用Diamonsil C18柱,以乙腈-0.05% 磷酸为流动相,通过HPLC-UV 法(检测波长260 nm)考察不同采收期木通马兜铃不同部位中马兜铃酸I 含量,结果显示马兜铃酸I在根及叶中含量较高,在茎、果实中马兜铃酸Ⅰ的含量最低且比较稳定,含量基本不随生长时间改变[24]。周雪红等采用固相萃取小柱样品前处理方式,以Phenomenex Luna C18柱,乙腈:0.2% 碳酸铵溶液(稀盐酸调节pH 7.5)为流动相,检测波长250 nm,建立了麻黄止嗽丸中马兜铃酸A 的HPLC-UV 限量测定方法[25]。黄可婧等通过样品提取、固相萃取前处理方式,以Phenomenex C18柱,乙腈-1% 冰醋酸(38:62)流动相,检测波长250 nm,建立了六经头痛片中马兜铃酸I 的HPLC-UV 限量检查方法[29]。总结表明,HPLC-UV 法适用于马兜铃酸类成分含量相对高、不存在干扰或通过适当前处理方式可排除干扰的中药材饮片及中成药品种。
对于一些马兜铃酸类成分含量低或者存在干扰的中药品种而言,采用HPLC 法难以实现其准确定性与定量;而液质联用法具有定性准确,灵敏度高,专属性强,不易受干扰等优势,目前已广泛应用于中药材饮片、中成药、保健品等不同样品中马兜铃酸成分以及不同基质中马兜铃酸(Aristolochic Acid,AA)-DNA 加合物的检测与分析[32-45]。马兜铃酸成分检测方面,刘萤等采用超高效液相色谱-电喷雾三重四级杆质谱法,以正离子、多反应监测模式(MRM)测定了柴胡、生甘草、龙胆泻肝丸、减肥茶等14种样品中马兜铃酸A和B的含量,其中马兜铃酸A 以m/z359.1-298.0 为定量离子对,m/z359.1-296.0为定性离子对,马兜铃酸B以m/z329.1-294.0为定量离子对,m/z329.1-268.0为定性离子对[35]。Liu Yiming 等采用HPLC-MS/MS 法,以正离子、MRM 对大鼠血浆中马兜铃酸I 进行了药代动力学研究,分别以m/z359.0-298.2、m/z373.1-305.2 作为马兜铃酸I及内标非那司提的定量离子对[42]。总体而言,液质联用法检测模式以正离子、MRM 为主;为提高离子化效率,流动相中通常加入一定浓度的铵盐添加剂。离子对的选择方面,母离子主要为[M+NH4]+(如马兜铃酸I,m/z359),子离子主要有[M+H-NO2]+、[M+HCO2]+、[M+H-H2O]+(如马兜铃酸I,子离子主要为m/z296,298,324)[31-42];实际检测过程中尚需优化确定碎裂电压、碰撞电压等质谱参数。
AA-DNA 加合物检测方面,由于研究认为此加合物可在肾脏不断蓄积,干扰、阻断转录和DNA复制,导致细胞凋亡甚至癌变,因此目前已用作研究马兜铃酸诱变和致癌的生物标志物[43,45]。相关研究主要集中于AA I和AA II,二者经代谢形成马兜铃酸内酰胺氮离子(AL),AL与DNA碱基(A、G、C)环外氨基结合,形成相应的AA-DNA 加合物(图2)[43,44]。同时,目前多种AADNA 加合物经已可通过LC-MS/MS 体外表征,作为体内相应加合物的定量分析对照,例如Chan Wang 等在制备纯化dA-DNA 加合物的基础上,采用LC-ESI-MS技术实现了给药马兜铃酸后大鼠肾脏和肝脏组织中相应加合物的检测与分析,结果给药5、30 mg·kg-1大鼠肾脏中可检测到dA–AAII、dA–AAI、dC–AAII,同时,以自制dA-AA II 加合物为对照,在假设dA–AAI和dC–AAII 与dA–AAII 的ESI-MS 响应相同的基础上,测定了给药后大鼠体内dA–AAII、dA-AAI 和dCAAII的浓度[43]。Guo Lin等采用UPLC-MS/MS 技术、多反应监测模式,以利血平为内标,实现了给药马兜铃酸后大鼠脱落的尿路上皮细胞中dA-AAI 的定量分析,AA I以10 mg/kg/d的剂量连续口服给药1个月后,大鼠尿路上皮细胞每109 个正常dA 中可检测到2.1 ± 0.3 dA-AAI,方法检出限为1 ng·mL-1;与传统32P-标记和HPLC荧光检测法相比,该方法更专属、准确、快速[44]。
2.3 标准收载情况

图2 马兜铃酸I、II的代谢活化及其DNA加合物的形成[43-44]
通过梳理在用含马兜铃酸类成分的中药材及中成药品种,就中药材而言,我国有法定标准的中药材品种有24种,包括大叶青木香、朱砂莲、天仙藤、马兜铃、防己、汉防己、木防己、木香马兜铃、大青木香和寻骨风以及苕叶细辛、乌金七、湘细辛、细辛、甘肃细辛、毛细辛和金耳环等;其中马兜铃属14 种、细辛属10 种;而2015版药典一部收载的品种仅包括马兜铃、天仙藤和细辛3 种药材[57-59],其余均为地方药材标准所收载;就中成药而言,由于目前没有完整、权威的信息库,所以只能通过多途径交叉检索的方式,据不完全统计,处方含马兜铃科药材的中成药有300 余种,处方仅涉及细辛一种药材的品种有200 多种;其中2015 版药典一部收载处方中含细辛的中成药品种共53种。
2.4 限度规定情况
随着对马兜铃酸类成分毒性作用研究的不断深入,我国在2003-2004 年相继采取了系列风险防控措施:①取消了关木通、广防己和青木香的药用标准;②对含马兜铃、寻骨风、天仙藤和朱砂莲4个药材的中成药品种严格按照处方药管理,并在药品说明书中增加导致肾损害的安全警示信息;③将细辛药用部位由全草修改为根和根茎。此外,限度规定方面,目前仅2015版药典一部天仙藤和细辛项下规定马兜铃酸I的限度分别不得过0.01% (万分之一)和0.001% (十万分之一)[58,59];而马兜铃项下则没有关于马兜铃酸Ⅰ的限量,仅提示本品含有马兜铃酸,可能引起肾脏损害等不良反应,儿童及老年人慎用;孕妇、婴幼儿及背功能不全者禁用[54]。尽管目前马兜铃酸类成分检测技术与方法发展较为成熟,但限度规定相关的研究报道相对较少[27,60,61]。田禾苗等采用文献报道的美国马里兰贝赛斯达鼠(NMRI)雄性小鼠转化后含有量上限作为马兜铃中马兜铃酸I的含有量上限,以人LD5剂量的1/10为安全剂量上限,按平均体重60 kg 计算,并以马兜铃最大服用量9 g计,计算出马兜铃药材中马兜铃酸I的限量应不超过0.02%[27]。研究同时测定了马兜铃酸III、7-羟基马兜铃酸I、马兜铃内酰胺I 的含量,因无相关的LD50报道,作者认为用马兜铃酸I毒性代替此3种马兜铃酸成分具有一定合理性,故暂定以上述4 种马兜铃酸总和进行限量控制[27]。李功辉等以马兜铃酸为例探讨了中药毒性成分限量标准制定方法,认为可以借鉴环保等领域中有毒有害成分限量标准制定,首先应根据中药毒性成分的毒理学评价结果,确立毒性成分的无可见有害作用剂量(no observed adverse effect level,NOAEL),最低有害作用剂量( lowest observed adverse effect level,LOAEL)或者基准剂量( benchmark dose,BMD),结合适宜的安全因子,推导并确定每日允许摄入量,然后根据限量标准理论值计算公式,最终确定中药中毒性成分的限量标准[60]。
3 总结
总体而言,尽管马兜铃酸类似物较多,其毒性作用自首次报道以来即引起国内外广泛关注与重视,并开展了大量的相关研究工作,但是,目前毒性作用研究明确的成分仍主要集中于马兜铃酸I 和II,其余成分的肾毒性及致癌性差异尚难以明确。另一方面,我国仍在使用的含马兜铃酸类成分的中药材饮片及中成药品种较多,尽管研究表明此类成分的检测与分析方法较为成熟,但其中马兜铃酸成分的定性、定量以及限度规定等研究均较为欠缺,因此有必要在明确其中马兜铃酸成分及含量的同时,进一步开展系统的毒理学研究,以充分评估其风险,从而制定出可保障用药安全的限度规定。然而,马兜铃酸成分限度标准的制定工作既备受关注又面临重重难点,这是由于目前我们在中药毒性成分研究方面缺乏明确的限量标准研究方法,而毒性成分限量标准制定方法是建立毒性成分限量标准的前提。此外,中药所含成分会受加工炮制、配伍等因素影响,中药毒性成分的限量还涉及毒性成分本身、服用量、服用时间以及毒理学研究基础等诸多因素。因此,接下来有必要首先对含马兜铃酸成分的相关中药品种进行梳理、调研,通过系统而深入的药学及毒理学基础研究实现其安全性再评价,进而开展相应的风险控制措施,以更好地保障临床用药的安全性。
