马兜铃酸IVa与2′-脱氧核苷体外反应形成加合物的LC-MS/MS 研究*
2019-10-22万晶晶陈瑞雪曹易懿谢天培张新宇
万晶晶,陈瑞雪,奚 晶,3,曹易懿,3,杨 洲,谢天培,张新宇,3**,栾 洋,3**
(1.上海交通大学医学院/公共卫生学院 上海 200025;2.上海诗丹德标准技术服务有限公司 上海 201203;3.中药安全性研究联合实验室 上海 200025)
马兜铃酸(aristolochic acids)是一类天然化合物的统称,主要存在于马兜铃属植物中[1],其结构特征是具有1个硝基菲甲酸的母核。目前已经发现了20余种这一类的化合物,其中马兜铃酸I和马兜铃酸II是大多数植物中含量最高的化合物[2,3],其结构如图1 所示。自然界中含有马兜铃酸的植物达600余种,其中60 余种为药用植物[4,5]。国家食品药品监督管理总局2017 年10 月30 日发布的可能含有马兜铃酸的马兜铃科药材有24种[6],常见的有朱砂莲、天仙藤、马兜铃和细辛等。

图1 3种典型的马兜铃酸化合物结构(环系编号如环内数字所示)

图2 马兜铃酸I/II的代谢活化以及DNA加合物形成过程
由于马兜铃酸I 和马兜铃酸II 可引起严重的肾病以及肾脏和泌尿系统癌症,因此引起广泛关注[7,8]。上世纪中叶发现1 种地方性肾病,称为巴尔干肾病(Balkan endemic nephropathy),主要表现为肾间质纤维化和慢性肾衰合并上尿路上皮癌(urothelial carcinoma of the upper urinary tract),后来发现其病因是误服了1种含有马兜铃酸的马兜铃属植物[8]。上世纪90 年代,比利时一家减肥诊所误用1 种马兜铃属中草药广防己,导致100多名妇女患病,主要表现为迅速进展的肾间质纤维化、肾功能衰竭以及上尿路上皮癌,被称为中草药肾病(Chinese herb nephropathy)[9]。由于含有马兜铃酸的马兜铃属植物是巴尔干肾病和中草药肾病的共同病因,因此二者被合并称为马兜铃酸肾病(aristolochic acid nephropathy)[10,11]。2012 年国际癌症研究中心(International Agency for Research on Cancer)将马兜铃酸I/II列为人类致癌物(Group 1)[12]。美国、英国、德国、澳大利亚和加拿大等国家已禁用了马兜铃物种(species ofAristolochia)中草药[2],我国则取消了广防己、青木香和关木通3种药材的使用[6]。
目前一般认为马兜铃酸I 和马兜铃酸II 致癌性由其本身与代谢活化2 种方式引起(图2)[1,7]。在代谢活化方式中,这些化合物分子中的硝基首先经过酶的部分还原形成羟胺,随即与羧基反应形成N-羟基马兜铃内酰胺,再经酶的转化产生活性中间体马兜铃内酰胺氮正离子,然后与DNA碱基反应形成加合物[1,7,13]。4种加合物已经在给药动物和上尿路上皮癌患者的肿瘤组织中被发现[1,7,14]:7-(2′-脱氧腺嘌呤核苷-N6-基)马兜铃内酰胺I(7-(2′-deoxyadenosin-N6-yl)aristolactam I,dA-AL I)、7-(2′-脱氧鸟嘌呤核苷-N2-基)马兜铃内酰胺I(7-(2′-deoxyguanosin-N2-yl)aristolactam I,dG-AL I)、7-(2′-脱氧腺嘌呤核苷-N6-基)马兜铃内酰胺II(7-(2′-deoxyadenosin-N6-yl)aristolactam II,dA-AL II)和7-(2′-脱氧鸟嘌呤核苷-N2-基)马兜铃内酰胺II(7-(2′-deoxyguanosin-N2-yl)aristolactam II,dG-AL II)(4 种加合物结构见图2)。其中dA-AL I 加合物难以修复,能诱导DNA突变,从而可能引起癌症[1,15]。
在大多数马兜铃属植物中,虽然马兜铃酸I 和马兜铃酸II 通常是含量最高的主要化合物,但这些植物常常还含有其它马兜铃酸化合物。其中1种化合物马兜铃酸IVa(图1)在某些药用植物中也是1 种主要成分[7,16-19],特别是在天仙藤中,马兜铃酸IVa含量远远超过马兜铃酸I和马兜铃酸II[20]。考虑到马兜铃酸IVa与马兜铃酸I 的结构差异仅仅是1 个10 位上的羟基(图1),我们推测马兜铃酸IVa也能经历与马兜铃酸I相似的还原活化过程并形成DNA加合物。但是,关于马兜铃酸IVa形成DNA加合物的研究还没有任何报道。因此,作为对此推测的初步探索,本文使用LC-MS/MS研究 了 马 兜 铃 酸IVa与2′-脱 氧 腺 嘌 呤 核 苷(2′-deoxyadenosine,dA)或2′-脱 氧 鸟 嘌 呤 核 苷(2′-deoxyguanosine,dG)在溶液中的反应,以中性丢失模式搜索可能的2'-脱氧腺嘌呤核苷和2'-脱氧鸟嘌呤核苷加成产物。
1 试剂与方法
1.1 试剂
马兜铃酸IVa从马兜铃(A.debilis)提取纯化,液相色谱-紫外分析表明其纯度为94.6% (检测波长244 nm)。2'-脱氧腺嘌呤核苷和2'-脱氧鸟嘌呤核苷购于Alfa Aesar 公司(Ward Hill,MA,USA),N,N-二甲基甲酰胺和锌尘购于Sigma-Aldrich 公司(St. Louis,MO,USA),乙腈(色谱级)购于Fisher Scientific 公司(Waltham,MA,USA),甲酸(色谱级)、盐酸、二甲亚砜、磷酸二氢钾和氢氧化钾购于国药集团化学试剂有限公司(中国,上海),实验用水由Millipore 超纯水仪制备(Burlington,MA,USA)。
1.2 实验方法
1.2.1 马兜铃酸IVa与2'-脱氧腺嘌呤核苷或2'-脱氧鸟嘌呤核苷的反应
反应参照文献中马兜铃酸I 与2'-脱氧腺嘌呤核苷或2'-脱氧鸟嘌呤核苷的反应条件进行[14]。在多次试验中,使用了不同的反应物量和反应温度。以下给出典型的反应示例。
20 mg 锌尘预先用200 μL 0.2% 盐酸活化1 h,15,000 g 离心5 min,去掉上清液,加入1 mg 马兜铃酸IVa溶于100 μLN,N-二甲基甲酰胺的溶液,再加入2 mg 2'-脱氧腺嘌呤核苷或2'-脱氧鸟嘌呤核苷溶于1 mL pH 5.8磷酸盐缓冲液的溶液,37℃暗处孵育24 h,冰中冷却30 min,15,000 g 离心5 min,小心取出上清液,离心浓缩至干,残余物用40 μL二甲亚砜重溶,LCMS/MS 分析。为提高反应效率,也使用了更高反应温度(50℃)。
1.2.2 LC-MS/MS分析
LC- MS/MS 分 析 在Agilent 1290 HPLC(Santa Clara,California,USA)和Sciex Triple Quad™4500 质谱仪(Framingham,MA,USA)上用Agilent Poroshell 120 EC-C18(2.1×100 mm,2.7 μm)色谱柱进行。流动相为0.1% (v/v)甲酸(A 相)和含有0.1% (v/v)甲酸的乙腈(B 相)。梯度洗脱由1% 的B 相起始,24 min 时升到49% 并维持1 min,从25到28 min,由49% 降到1% 。流速:300 μL ⋅min-1,柱温:40℃。电喷雾离子源,阳离子扫描模式,电压5500 V,离子源温度500℃。其它参数设置如下:气帘气(curtain gas,CUR),30 psi;喷雾气(ion source gas 1,GS1),50 psi;辅助加热气(ion source gas 2,GS2),50 psi;碰撞气(collision gas,CAD),8 psi;去簇电压(declustering potential,DP),60 V;入口电压(entrance potential,EP),10 V;碰撞室出口电压(cell exit potential,CXP),7 V;碰撞能量(collision energy,CE)每隔2 s由20变到30再变到40 eV(在质谱一次扫描时间内)。扫描模式:中性丢失,丢失碎片质量数设置为116,扫描范围m/z200-600 Da,扫描速度200 Da s-1。
高分辨LC-MS/MS 分析在Agilent 1290 HPLC 和Sciex Triple TOF 4600 质谱仪上用Agilent ZORBAX RRHD Eclipse Plus C18(2.1×50 mm,1.8 ćm)进行,流动相为0.1% (v/v)甲酸(A相)和乙腈(B相)。梯度洗脱由10% 的B相起始并维持1 min,6 min时升到95% 再维持3 min,从9 到9.1 min,由95% 降到10% 。流速:400 μL ⋅min-1,柱温:25℃。电喷雾离子源,阳离子扫描模式,电压5000 V,离子源温度500℃。其它参数设置如下:CUR,35 psi;GS1,50 psi;GS2,50 psi;DP,100 V;CE,40 eV;扫描范围m/z50-1500 Da。
2 实验结果
2.1 马兜铃酸IVa与2'-脱氧腺嘌呤核苷反应产物分析
根据马兜铃酸I 的反应[14](图2),预计如果马兜铃酸IVa与2'-脱氧腺嘌呤核苷相似地发生反应,则加合物分子式为C27H22N6O8,分子量558。因此,用中性丢失模式(设置中性丢失部分质量数为116)扫描获得反应混合物总离子流色谱图,再以m/z559 提取色谱图,可以看到7个主要的峰,按保留时间增加的顺序从A1到A7 依次编号(图3A)。检查这些化合物的质谱图,发现A3、A6 和A7 具有较强m/z559 信号(图3B,仅展示A3的质谱图,A6和A7的质谱图相似),而其余四个化合物只有非常弱的m/z559信号。设定m/z559进行产物离子扫描以检测这些化合物的碎裂方式,发现A3的主要碎片是m/z443 和308 的2 种离子(图3C),而A6和A7的主要碎片是m/z443,没有m/z308。

图3 (A)马兜铃酸IVa与2'-脱氧腺嘌呤核苷在pH 5.8,37℃与锌尘暗处孵育24 h后,反应混合物用中性丢失扫描(设置中性丢失部分质量数为116),并以预测的可能加合物的质子化分子离子m/z 559提取的色谱图;(B)图3A中A3的质谱图;(C)图3A中A3的产物离子扫描质谱图
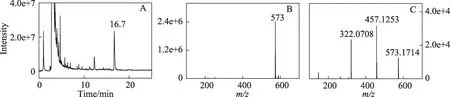
图4 (A)马兜铃酸IVa与2'-脱氧腺嘌呤核苷反应混合物进行中性丢失扫描获得的总离子流色谱图;(B)保留时间16.7 min处产物的质谱图;(C)该产物的产物离子扫描高分辨质谱图

图5 (A)马兜铃酸IVa与2'-脱氧鸟嘌呤核苷在pH 5.8,37℃与锌尘暗处孵育24 h后,反应混合物用中性丢失扫描(设置中性丢失部分质量数为116),并以预测的可能加合物的质子化分子离子m/z 575提取获得的色谱图;(B)图5A中G3的质谱图;(C)图5A中G3的产物离子扫描质谱图
中性丢失扫描的总离子流色谱图在保留时间16.7 min 处有1 个较高的峰(图4A,12.3 min 处较小的峰质谱图上基峰为m/z328,其它峰很弱,故未进一步考察),其质谱图上几乎只有1 个m/z573 峰(图4B)。用产物离子扫描检测该产物的碎裂方式,发现m/z573母离子在m/z457和322处产生2个很强的峰。将该产物用HPLC 分离后再用高分辨质谱检测,获得其母离子精确质量数为573.1714,产生的2 个子离子的精确质量数为457.1253和322.0708(图4C)。
2.2 马兜铃酸IVa与2'-脱氧鸟嘌呤核苷反应产物分析
按照马兜铃酸IVa与2'-脱氧腺嘌呤核苷的反应,预计马兜铃酸IVa与2'-脱氧鸟嘌呤核苷的加合物分子式为C27H22N6O9,分子量574。马兜铃酸IVa与2'-脱氧鸟嘌呤核苷反应混合物用中性丢失模式检测,并设定m/z575 提取色谱图,可以看到4 个峰(图5A),按保留时间增加的顺序从G1到G4依次编号。检查它们的质谱图,发现4 种产物都有强的m/z575 信号(图5B 显示了G3 的质谱图,其它产物质谱图相似)。用产物离子扫描模式检查这些产物母离子的质谱碎裂情况,发现G1、G2 和G3 均产生m/z459 和308 两种子离子(图5C显示了G3 的母离子的碎裂结果),而G4 只产生m/z459子离子。
与马兜铃酸IVa和2'-脱氧腺嘌呤核苷反应混合物情况相似,通过中性丢失扫描获得的总离子流色谱图上可看见一些较明显的峰(图6A)。检查它们的质谱图,发现其中3个峰(按保留时间增加的顺序依次命名为G5、G6和G7)的质谱图上有很强的m/z591峰(此峰是这3 个产物质谱图中的基峰,与图4B 情况相似)。设置m/z591进行产物离子扫描,G5和G6在m/z475和308处产生2个强的峰,m/z308峰是谱图中的基峰,其强度约为m/z475信号的2-3倍。但G7的谱图中则只显示了m/z475的峰(基峰)。用HPLC分离出少量G5,进行高分辨质谱检测,获得其母离子精确质量数为591.1459,产生的2个子离子的精确质量数为475.0936和308.0524(图6B)。

图6 (A)马兜铃酸IVa与2'-脱氧鸟嘌呤核苷在pH 5.8,50℃与锌尘暗处孵育24 h后,反应混合物用中性丢失扫描(设置中性丢失部分质量数为116)获得的总离子流色谱图,其中3个峰G5、G6和G7的质谱图显示了强的m/z 591峰;(B)G5的高分辨质谱图
3 讨论
中性丢失是串联质谱中的1 种扫描模式,通过设定母离子在质谱碎裂过程中丢失的中性碎片的质量数来筛选化合物[21]。2′-脱氧核苷及其加合物存在着1种共通的质谱碎裂方式,即糖苷键断裂,失去2′-脱氧核糖部分的碎裂方式,其结果是产生M-116 的子离子。因此,可以使用中性丢失模式,设定丢失的质量数为116进行2′-脱氧核苷加合物的筛选[21]。
根据已报道的dA/dG-AL I/II加合物的质谱数据[22],失去2′-脱氧核糖部分后的离子,在适当的碰撞能量下还可进一步失去碱基。例如,dG-AL II 的质子化分子离子MH+(m/z529)很容易失去2′-脱氧核糖部分,产生m/z413([MH-116]+)的子离子,在更高的碰撞能量下还可丢失中性的鸟嘌呤碱基(C5H5N5O = 151),产生m/z262([MH-116-151]+)的子离子[22]。因此,通过中性丢失碱基的情况,可获得产物结构的进一步信息。
根据上述质谱碎裂方式,本文首先使用中性丢失模式,设置中性丢失的质量数116 并以预计的加合物质子化分子离子m/z559 在马兜铃酸IVa与2'-脱氧腺嘌呤核苷的反应混合物中进行筛选,发现7 种可能产物,但其中4 种m/z559 信号过弱,故未进一步考虑。其余3种化合物进行产物离子扫描时均观察到m/z443峰,即[MH-116]+子离子。其中1种产物(化合物A3)不仅有较强的m/z443信号,还有m/z308信号(图3C),即[MH-116-135]+子离子,应该是丢失腺嘌呤(C5H5N5=135)引起。依次丢失116和135的中性碎片,说明这3种产物很可能是预期的dA-AL IVa加合物。相似地,在马兜铃酸IVa与2'-脱氧鸟嘌呤核苷的反应混合物中筛选到4 种可能的加合物。无论2'-脱氧腺嘌呤核苷还是2'-脱氧鸟嘌呤核苷都形成多个可能的加合物,可能是由于2'-脱氧腺嘌呤核苷和2'-脱氧鸟嘌呤核苷上有多个反应位点的缘故。
有趣的是,除了上述预期的“常规”加合物外,在2'-脱氧腺嘌呤核苷或2'-脱氧鸟嘌呤核苷的反应混合物中,都发现了非“常规”的可能加合物。在马兜铃酸IVa与2'-脱氧腺嘌呤核苷反应混合物中,发现了1 种分子量为572 的可能加合物,其分子量较“常规”加合物大14,可能意味着含有1 个额外的N 原子或CH2,相应的分子式为C27H22N7O8或C28H24N6O8,其质子化分子离子的精确理论质量数分别为573.1608 或573.1734。高分辨质谱显示该产物质子化分子离子的精确质量数是573.1714,显然说明后者是正确的。因此,该产物应该含有1 个额外的CH2而不是N 原子。由于该产物的质谱碎裂方式是依次失去2′-脱氧核糖和腺嘌呤碱基,表明这个额外的CH2位于马兜铃酸环系上。失去2′-脱氧核糖和腺嘌呤碱基后的离子的化学式分别是C23H17N6O5和C18H12NO5,相应的质量数分别为457.1260和322.0715,与实测值457.1253 和322.0708 符合得非常好,也证明了上述结构推测的合理性。
而在马兜铃酸IVa与2'-脱氧鸟嘌呤核苷的反应混合物中,则发现了3种分子量590的可能加合物,其中1 种通过高分辨质谱进行了验证。由于分子量较“常规”加合物大16,说明这些加合物分子中具有1个额外的O 原子或NH2,相应的分子式为C27H22N6O10或C27H24N7O9,其质子化分子离子的精确理论质量数分别为591.1476或591.1714。高分辨质谱测得的实际精确质量数是591.1459,说明前者是正确的,即该产物分子中较“常规”的加合物多1个O原子。高分辨质谱结果显示该产物母离子依次丢失2′-脱氧核糖和1 个质量数167.0412 的碎片;由于鸟嘌呤碱基的质量数是151.0494,如果含有1 个额外的O 原子,则质量数变为167.0443,这表明这个额外的O 原子很可能位于鸟嘌呤碱基环系上。按此推测,丢失2′-脱氧核糖和含有1个额外O 原子的鸟嘌呤碱基后,所获得的离子的化学式应该分别为C22H15N6O7和C17H10NO5,相应的质量数分别 为475.1002 和308.0559,与 实 测 值475.0936 和308.0524 符合较好,说明对此化合物结构的推测是合理的。
质谱本身只能提供化合物分子式的信息。对于已知化合物,可以通过谱图数据库搜索或与文献报道数据比较从而确定化合物的结构;而对于未报道的化合物,只能通过分析质谱碎裂过程推测其结构,但推测的结构通常不能作为确定的证据。因此,本文结果仅仅表明在体外特定条件下(pH 5.8 溶液中以锌作为化学还原剂),马兜铃酸IVa与2'-脱氧腺嘌呤核苷和2'-脱氧鸟嘌呤核苷可发生反应形成若干种可能的加合物。由于这些可能的加合物的结构尚不能确定,且反应是在非生理条件下获得的,因此马兜铃酸IVa是否能形成DNA 加合物,尤其是在活体内形成DNA 加合物,仍然是不清楚的。这些是下一步实验将要解决的问题。同时,本实验室正在进行马兜铃酸IVa与2'-脱氧腺嘌呤核苷和2'-脱氧鸟嘌呤核苷形成的可能加合物的分离和纯化,以获得足够的量通过核磁共振光谱确定结构,并为未来的体内实验提供标准样品和建立相应的分析方法。
