补肺汤对慢传输型便秘模型大鼠结肠内5-HT和SP的影响
2019-10-21陈显韬杜位良
陈显韬,杜位良
慢传输型便秘(slow transit constipation,STC)是指结肠的传输功能障碍,肠内容物传输缓慢所致的便秘[1]。目前认为,肠神经递质的异常改变是STC发病的重要机制之一[2]。肺与大肠相表里最早见于《黄帝内经》,是指肺与大肠生理和病理上相互联系。而现代研究亦证实,肺肠在进化发育、表面活性物质、黏膜免疫及神经-内分泌-免疫网络都存在着一定的相关性[3]。5-羟色胺(5-hydroxy tryptamine,5-HT)、P 物质(substance P,SP)都是同时存在于肺、肠并通过发挥生物学作用而影响肺、肠的生理病理变化[4-5]。本研究拟通过观察补肺汤对STC模型大鼠结肠内5-HT、SP表达的影响,为临床基于“肺与大肠相表里”理论从肺论治STC提供动物实验依据。
1 材料与方法
1.1 动物 清洁级Sprague-Dawley(SD)大鼠30只,体重150~180 g,雌雄各半。由泸州医学院实验动物中心提供。随机分为空白对照组(A组),模型对照组(B组),补肺汤治疗组(C组)。
1.2 药物 (1)复方地芬诺酯片(compound diphenoxylate,DC),郑州复升药业有限公司。配制成DC混悬液(2.5 g/L)。(2)补肺汤(《云岐子保命集》卷下)由泸州医学院附属医院临床药物实验中心提供。组成:黄芪(炙)30 g,人参15 g,熟地黄20 g,紫菀15 g,桑白皮15 g,五味子5 g。传统水煎,熬制成含成药1 g/mL浓缩液。(3)活性炭混悬液。称取阿拉伯树胶50 g,加水400 mL,煮沸至溶液透明。称取活性碳25 g,加至上述溶液中煮沸3次。待溶液凉后,加水定容成500 mL混悬液(50 g/L),于冰箱4 ℃保存。使用前玻璃棒搅拌混匀。
1.3 试剂与仪器 大鼠5-HT、SP一抗免疫组化试剂盒(北京博奥森生物有限公司);PBS缓冲液、二抗免疫组化检测试剂盒(PV-6001,北京中衫金桥生物有限公司);HRP-DAB底物显色试剂盒[天根生化科技(北京)有限公司]。石蜡切片机HM325(德国MICROM公司);光学显微镜BX-70(日本Olympus光学有限公司)。
1.4 STC大鼠模型 参照文献[6-7]拟定方案。大鼠适应性喂养后,随机分为A组10只和STC造模组20只(包括B组、C组,每组各10只)。A组每日给予生理盐水0.2 mL/10 (g·d)灌胃,造模组每日给予DC混悬液15 mg/(kg·d) 灌胃。连续灌胃21天,期间不限食水。
1.5 给药 参考徐叔云《药理实验方法学》人和动物药物用量,按体表面积折算的等效剂量比值为0.018计算。造模成功后,A组与B组给予蒸馏水0.2 mL/10 (g·d)灌胃治疗,C组给予补肺汤浓缩液10.5 g [10.5 mL/(kg·d)] 灌胃治疗。疗程为14天。
1.6 活性碳推进试验 造模结束及药物灌胃治疗结束,大鼠在活性炭推进实验前禁食不禁水24 h,每只大鼠用活性炭混悬液2 mL灌胃,分笼饲养观察,不禁食水。分别观察记录每只大鼠首粒黑便排出时间及24 h内大便粒数及湿重,以测定各组大鼠肠道传输功能及STC改善程度。
1.7 5-HT、SP免疫组化检测 活性炭推进实验结束,各组大鼠颈椎脱臼处死。打开腹腔,剪取回盲部近端结肠1~1.5 cm,用4 ℃生理盐水洗净肠内容物及血液。放入4%多聚甲醛内固定,选取固定待检的大鼠结肠组织,再行脱水、透明、石蜡包埋,制成石蜡块。作5 μm厚的组织切片编号。采用免疫组化SP法测定结肠组织5-HT、SP含量,具体操作按试剂盒说明进行。
1.8 图像分析 在高倍镜下(×400)对每张切片随机选取5个具有代表性的视野,测量各视野平均光密度值(density mean,MD)。
1.9 统计学方法 采用SPSS17.0对各组数据进行处理,所得数据结果均以均数±标准差()表示,多组均数差异显著性的比较采用单因素方差分析,多个样本均数的两两比较用SNK法(q检验),P<0.05时表示差异有统计学意义。
2 结果
2.1 活性炭推进实验 A组大鼠首粒黑便排出时间小于B、C组(P<0.05),而24 h大便粒数、24 h大便湿重均大于B、C组(P<0.05);B、C组分别对三项检测指标分别行组间比较,差异无统计学意义(P>0.05)。证明已成功建立了大鼠STC模型。见表1。

表1 STC造模结束活性炭推进实验结果
中药治疗结束,B组和C组大鼠首粒黑便排出时间大于A组(P<0.05),而24 h大便粒数、24 h大便湿重小于A组(P<0.05);B组与C组比较大鼠首粒黑便排出时间,24 h大便粒数以及24 h大便湿重差异均无统计学意义(P>0.05)。见表2。
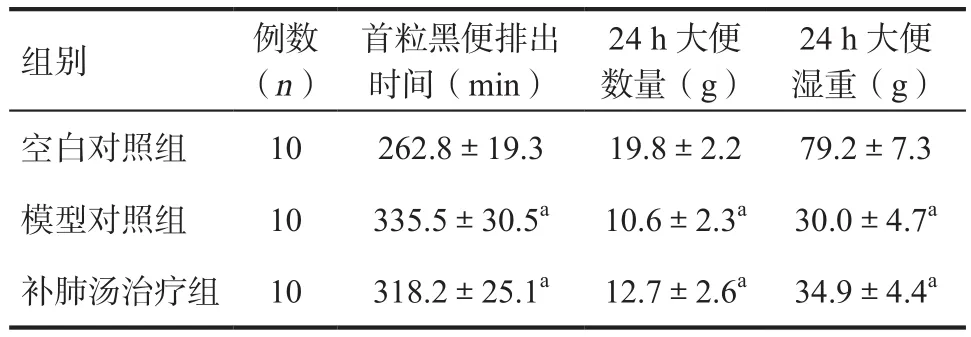
表2 治疗后各组大鼠活性炭推进实验结果及大便基本情况检测情况
2.2 5-HT、SP免疫组化检测 免疫组化阴性对照见图1,5-HT、SP免疫组化阳性对照分别见图2、图3;实验观察发现,大鼠结肠内5-HT主要表达于结肠黏膜层、黏膜下层,主要分布于肠绒毛上皮细胞以及肠腺上皮之间,着色细胞呈棕黄色,胞核无色染。如图4~图6。而结肠内SP主要表达于结肠肌间神经丛神经元细胞胞浆内及黏膜下神经丛,着色细胞呈棕黄色,胞核无色染。如图7~ 图 9。

图1 免疫组化阴性对照(结肠,×400)

图2 免疫组化阳性对照(5-HT,×400)

图3 免疫组化阳性对照(5-HT,×400)
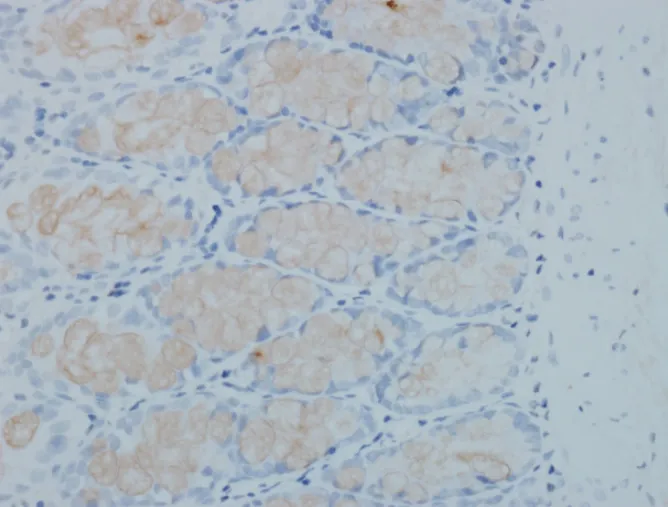
图4 A组结肠5-HT(5-HT,×400)
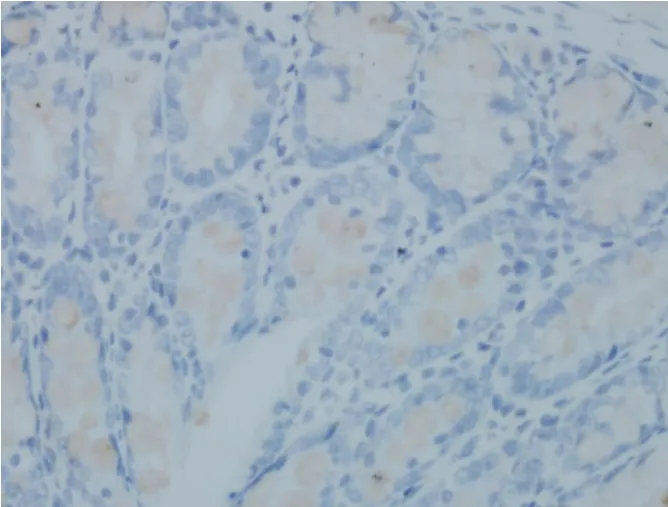
图5 B组结肠5-HT(5-HT,×400)

图6 C组结肠5-HT(5-HT,×400)

图7 A组结肠SP(SP,×400)

图8 B组结肠SP(SP,×400)

图9 C组结肠SP(SP,×400)
结肠内5-HT、SP MD比较,B组均低于A、C组(P<0.05),C组低于A组(P<0.05)。见表3。
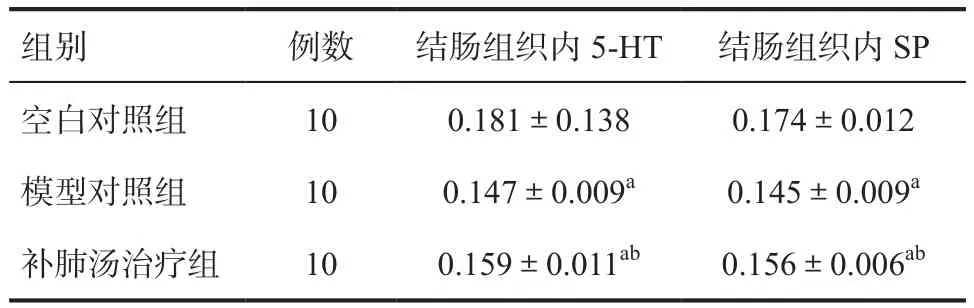
表3 治疗后各组大鼠结肠组织免疫组化5-HT、SP表达MD比较
3 讨论
基于“肺与大肠相表里”从肺论治便秘由来已久。《医经精义》点明“理大便必须调肺气也”。STC老年多发[8],多为本虚标实之证,属中医学虚秘的范畴。相关文献分析便秘的证侯发现气虚、阴虚、阳虚、血虚共占总频数的54.4%,反映了STC以正虚为主的特点,而肺气虚占一定的比例,是其常见的证型[9-10]。实验研究亦发现便秘小鼠皮毛失去光泽,皮肤出现菲薄、干燥,正如《素问·五脏生成》云:“肺之合皮也,其荣毛也”[11]。故从肺论治便秘具有重要实际意义。临床治疗中[12-13]以补肺健脾法、调肺润肠、宣肺养阴等治疗慢传输型便秘,均获良效。补肺汤出自《云岐子保命集》卷下,以桑白皮(蜜炙)、熟地黄、人参、紫菀、黄芪(蜜炙)、五味子为主要组成药物,诸药合用,共奏补肺益气之功效。补肺汤已广泛运用于肺炎、气管炎、慢性阻塞性肺疾病等的治疗,临床亦有报道补肺汤配合针刺治疗术后腹胀具有较好的临床疗效[14]。实验研究[15-16]发现补肺汤可减轻肺气虚证大鼠支气管、肺组织病理学变化,增强大鼠免疫功能有作用;加速细胞外基质的降解,抑制肺纤维化的形成。
高健群等[17]研究发现,基于肺与大肠相表里理论运用肃肺润肠汤可以提高药物依赖性便秘大鼠肠道杯状细胞、免疫反应细胞5-HT的形态分布和数量,从而促进胃肠蠕动,改善胃肠道的传输功能。同时研究表明,5-HT、SP均为肠神经系统分泌的兴奋性神经递质,5-HT能激活肠黏膜下传入神经纤维,通过肠神经系统来调节胃肠道局部的兴奋和抑制,并能够加速结肠运动和传输[18]。SP可以刺激胃肠壁内神经元的去极化,调节胃肠局部血流及改变血管通透性,增强对胃肠道环行肌和纵行肌的双重收缩作用[19]。均具有促进肠道的蠕动与排空的功能。
本实验以补肺汤为治疗药物,研究发现,模型组大鼠结肠内5-HT、SP表达明显低于空白对照组,证明STC模型组大鼠结肠内存在肠兴奋性神经递质5-HT、SP降低的情况。补肺汤治疗组大鼠结肠内5-HT、SP表达均虽低于空白对照组,但较模型对照组均有不同程度的增加。这与相关文献报道中药通过增加结肠内5-HT的量而改善肠道传输功能的结果相符[17]。治疗后,大鼠结肠活性炭推进实验显示,补肺汤治疗组大鼠结肠传输功能明显低于空白对照组,且与模型对照组无统计学差异。实验综合表明,补肺汤不能有效改善STC模型大鼠结肠的传输功能,但能增加STC模型大肠结肠内5-HT、SP在结肠内的表达,对STC的治疗有一定协助作用。本实验为从肺论治STC的机理提供了一定的动物实验依据,但如何完全揭示从肺论治STC的机理仍需进一步研究。
