TPF方案4周期诱导化疗联合同步放化疗治疗N3期鼻咽癌的疗效与毒性分析:Ⅱ期临床试验
2019-10-15张莹莹林庆良唐天兰徐本华
张莹莹,林庆良,唐天兰,徐本华
在我国,鼻咽癌好发于南方五省,临床确诊时多数已处于中晚期。随着放疗技术的发展,鼻咽癌的5年局部控制率已达90%以上,但仍有40%的患者因发生远处转移而导致死亡,远处转移是鼻咽癌治疗失败的主要原因[1-3]。N3期鼻咽癌远处转移率高达57%,3年无远处转移生存率(distant metastasis-free survival, DMFS)仅56%[4]。越来越多的研究认为,N分期是远处转移相关因素,是影响生存的独立预后因素,建议对N3期鼻咽癌患者采用更高强度的化疗[4-6]。笔者前期进行一项前瞻性、非随机对照临床试验,结果显示,N3期鼻咽癌患者在接受同期放化疗的基础上,加4周期TP诱导化疗,近期疗效较好,3年生存率达90.9%,且患者的耐受性良好[7]。在此临床试验的基础上,本课题组采用TPF三药联合的4周期诱导化疗模式治疗N3期鼻咽癌患者,通过提高化疗强度来减少远处转移,提高生存率。现将该治疗方案的近期有效率及急性毒副反应报道如下。
1 对象与方法
1.1对象 收集2013年6月-2017年7月住院并接受治疗的N3期鼻咽癌患者19例,男性14例,女性5例,年龄中位数42岁(25~62岁)。WHO病理分型2级9例,3级10例;T1期4例,T2期2例,T3期3例,T4期10例;治疗前EB病毒DNA(EBV-DNA)拷贝数≥5 000拷贝/mL 4例,<5 000拷贝/mL 15例。入组标准:(1)经病理确诊;(2)参照T1-4N3M0IVB期美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第七版分期;(3)年龄为18~70岁;(4)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态(performance status, PS)评分为0~2分;(5)无血液系统疾病,入组前白细胞>4×109L-1,血小板>100×109L-1,血红蛋白>80 g/L;肝功能(丙氨酸转氨酶或天冬氨酸转氨酶≤正常值上限的2.5倍);双侧肾功能均正常:肌酐清除率>60 mL/min。排除标准:(1)首诊即出现远处转移;(2)严重心、肝、肾功能损害;(3)有其他恶性肿瘤病史;(4)怀孕或哺乳期妇女;(5)精神异常者;(6)PS评分≥3分。该研究经医院伦理委员会审批通过。
1.2治疗方法
1.2.1化疗 诱导化疗4周期。诱导化疗方案如下:紫杉醇135 mg/m2,第1天;顺铂20 mg/m2,第1~3天;氟尿嘧啶600 mg/m2,第1~5天,每3周为1个周期。紫杉醇治疗前预处理方法:化疗前一天,口服地塞米松20 mg,每天两次,紫杉醇治疗前0.5 h予地塞米松5 mg静脉推注、非那根25 mg肌内注射、西咪替丁500 mg静脉滴注。紫杉醇治疗前及治疗期间均予心电监护。同步化疗采用顺铂80 mg/m2,3周1次。药物剂量调整:化疗后对患者进行抽血监测及病情随访,如出现4度骨髓抑制或发热性粒细胞缺乏、3度肝功能异常、3度肾功能异常及3度神经毒性,则化疗剂量予减量25%。
1.2.2放疗 患者首次诱导化疗前及4周期化疗后分别行增强CT模拟定位,根据国际辐射单位和测量委员会(ICRU)62号报告的定义进行靶体积勾画:原发灶大体肿瘤体积(gross tumor volume of the nasopharynx, GTVnx)及颈部转移淋巴结大体肿瘤体积(gross tumor volume of the lymph nodes, GTVnd)根据化疗后CT定位及MR影像进行勾画;临床靶体积1(clinical tumor volume, CTV1)即GTVnx外扩0.5 cm,包括鼻咽的全部黏膜及黏膜下0.5 cm;临床靶体积2(clinical tumor volume, CTV2)即CTV1外扩0.5 cm,包括鼻咽腔、鼻腔后部、上颌窦后部、翼腭窝、部分后组筛窦、咽旁间隙、颅底、1/3颈椎或斜坡以及第Ⅱ~Ⅴ组淋巴结引流区。剂量:GTVnx68 Gy,GTVnd66 Gy,CTV160 Gy,CTV254 Gy。采用三维适形放疗或调强放疗,30次。所有计划均经放射治疗计划系统(treatment planning system, TPS)计算剂量,处方剂量评估为95%的靶区体积所接受的照射剂量。根据美国肿瘤放射治疗协作组(Eastern Cooperative Oncology Group, RTOG)0225进行危及器官勾画及剂量限制,根据剂量体积直方图(dose volume histogram, DVH)结合每层定位CT图像的剂量线对靶区和危及器官进行剂量评价[8]。
1.3疗效及毒性 疗效评价参照实体瘤治疗后评价标准(response evaluation criteriain solid tumors, RECIST 1.1)[9]:完全缓解(complete response, CR),指所有目标病灶消失;部分缓解(partial response, PR),指病灶长径总和缩小≥30%;稳定(stable disease, SD),病灶长径总和缩小,但未达PR,或增加但未达进展(progressive disease, PD);PD指病灶长径总和增加≥20%或出现新病灶。分别对鼻咽原发病灶及转移淋巴结进行疗效评价,CR+PR评价为有效,最终疗效确定时间为放疗结束3月。化疗毒副反应评价采用美国毒副反应常规标准(national cancer institute common terminology criteria for adverse events, NCI-CTCAE3.0)[10]。放疗期间反应采用RTOG的急性放射损伤分级标准[11]。
1.4临床随访 所有患者放化疗期间每周行体检及血液学检查。分别在2周期化疗后3~4周(第3周期化疗前)、4周期化疗后3~4周(放疗前)、放疗结束1月及3月行电子鼻咽镜、鼻咽及颈部MR、胸部CT、腹部B超检查了解肿瘤情况。放疗结束后2年内每3月、第3~5年每半年、5年以后每年随访1次。随访内容包括:体格检查、血液学检查(包括EBV-DNA)、电子鼻咽镜、鼻咽及颈部MR(平扫+增强)、胸部CT、腹部B超。
1.5统计学处理 采用SPSS 17.0软件进行统计学处理。生存率采用Kaplan-Meier法计算。观察指标定义如下:总生存率(overall survival, OS),从治疗开始时间到因任何原因引起死亡的时间或末次随访时间;无进展生存率(progression-free-survival, PFS),从治疗开始时间到患者出现肿瘤进展或死亡的时间或末次随访时间;无转移生存率(distant metastasis-free survival, DMFS),从治疗开始时间到发生远处转移的时间或末次随访时间;无复发生存率(locoregional relapse-free survival, LRFS),从治疗开始时间到首次鼻咽或颈部淋巴结复发时间或末次随访时间。
2 结 果
2.1近期疗效 19例患者均按期完成4周期诱导化疗;14例患者(73.7%)完成了同步化疗。4周期化疗后鼻咽部病灶有效率100%(CR 15.8%,PR 84.2%),颈部淋巴结有效率100%(CR 21.1%,PR 78.9%)。治疗结束后3月,鼻咽部CR 16例(84.2%),PR 3例(15.8%),鼻咽部有效率为100%,颈部CR 19例(100%)(表1)。
表1诱导化疗及同步放化疗期间的疗效评价
Tab 1Response to induction chemotherapy and chemoradiotherapy
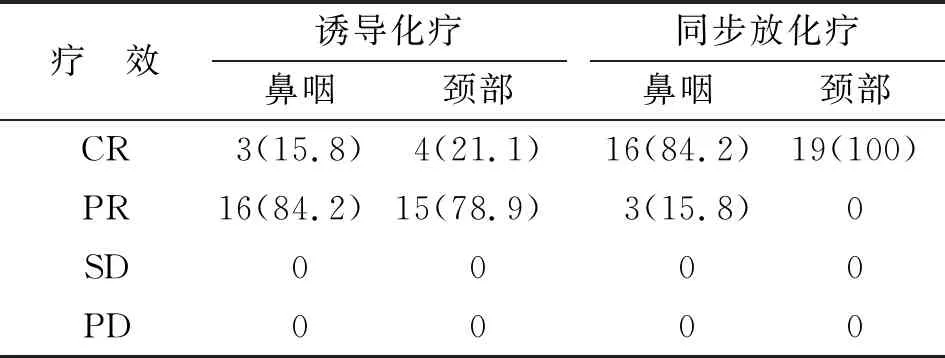
疗 效诱导化疗鼻咽颈部同步放化疗鼻咽颈部CR3(15.8)4(21.1)16(84.2)19(100)PR16(84.2)15(78.9)3(15.8)0SD0000PD0000
表中数据为n(%). CR:完全缓解;PR:部分缓解;SD:稳定;PD:进展.
2.2毒副反应
2.2.1化疗的毒副反应 化疗期间主要血液学毒性是1~2度的粒细胞减少和贫血,无粒细胞减少性发热。2例患者均在第4周期化疗后出现3度粒细胞减少,治疗后血象恢复。非血液学毒性主要表现为1~2度的恶心、呕吐、乏力及肝功能损害。1例患者在1周期化疗后出现3度肝功能损害,后证实患者乙肝病毒DNA阳性,后经保肝及抗乙肝病毒治疗后恢复正常(表2)。

表2 诱导化疗期间的急性毒性
表中数据为n(%).
2.2.2放化疗期间的毒副反应 1例出现3度粒细胞减少,治疗后血象恢复。1例出现3度贫血,予补铁等治疗后恢复正常。2例出现3度胃肠道反应,对症治疗后好转。1例同时出现3度放射线皮炎和黏膜炎,暂停放疗,并局部对症处理(表3)。
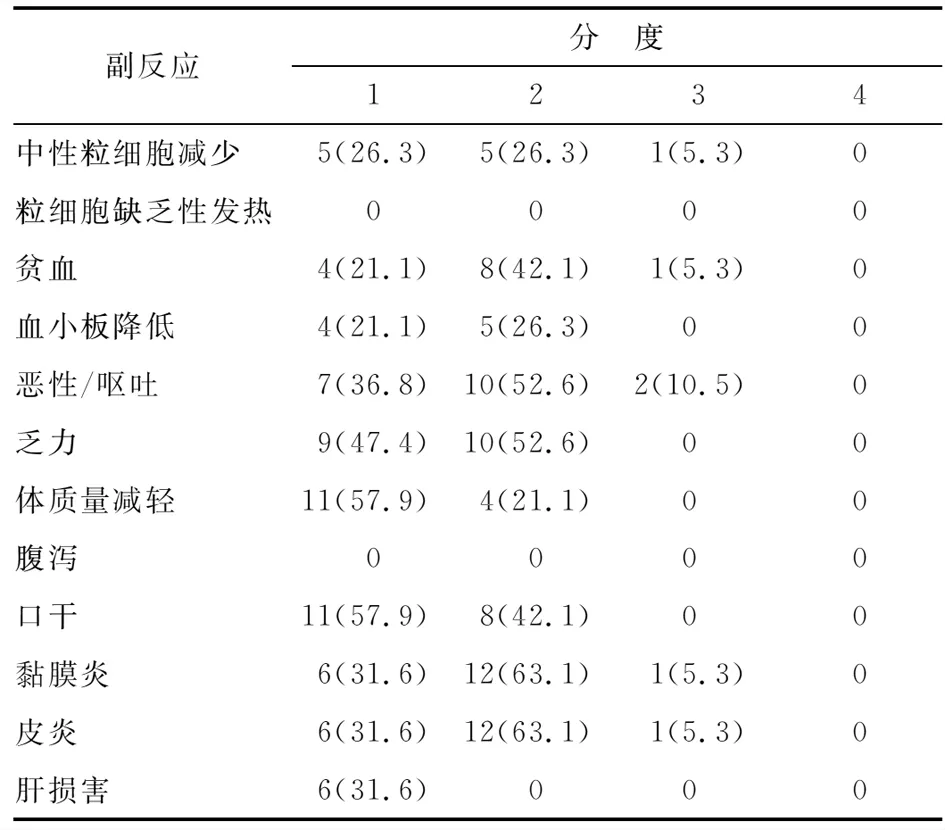
表3 同期放化疗期间的急性毒性
表中数据为n(%).
2.3随访和生存率 末次随访时间为2018年4月1日,共随访30月(7~57月)。治疗后22月,因肝转移而死亡1例;治疗后14月,因脊髓转移而死亡1例;治疗后32月,出现胸椎转移1例,经放疗加化疗及靶向治疗,目前仍存活;治疗后17月,出现肝、骨转移1例,目前仍存活;治疗后39月,因复发而死亡1例;治疗后鼻咽仍残留1例,目前仍化疗中。2年PFS,DMFS,LRFS和OS分别为84.2%,84.2%,100%及89.5%;3年PFS,DMFS,LRFS及OS分别为78.9%,78.9%,100%及89.5%。
3 讨 论
鼻咽癌是一种对化疗敏感的肿瘤,局部晚期的患者在放疗的基础上联合化疗可明显改善预后,但目前放化疗结合的最佳方式仍未明确。数个随机对照研究及荟萃分析均证实,同期放化疗可使鼻咽癌患者的OS提高8%~30%[12-13],辅助化疗则因耐受性差而越来越受到质疑[14]。诱导化疗以其良好的依从性及耐受性、较高的化疗后缓解率、明显降低肿瘤负荷及消灭微转移病灶等优势越来越被重视[15]。2016年,马骏的一项多中心Ⅲ期随机对照试验显示,诱导化疗加同期放化疗降低了治疗失败率及远处转移率,改善了OS[16]。因此,在同期放化疗基础上的诱导化疗成为目前局部晚期鼻咽癌研究的热点。
N分期是影响鼻咽癌预后的重要因素。N3期鼻咽癌患者更易复发、转移,预后更差,可能与N3期患者治疗初就存在微转移有关[12]。因此,多数学者认为,应对肿瘤负荷较大的T4、N2-3期鼻咽癌患者采用高强度化疗,以减少远处转移,提高生存率。许婷婷等报道,采用诱导加同期放化疗的N3期患者5年无转移生存率为72%,认为同期放化疗基础上的诱导化疗或辅助化疗比单纯同期放化疗更具优势[6]。然而,诱导化疗的最佳疗程数尚未确定。林焕新等采用2周期TPF方案诱导化疗加顺铂同期放化疗治疗40例鼻咽癌,其有效率较Bae等报道的3周期化疗偏低(81.6%vs97%)[17-18],二者有效率的差异,原因可能是后者的研究中增加了诱导化疗强度跟周期数,使有效率提高。Paccagnella等发现,N3期鼻咽癌患者行4个疗程诱导化疗,随着疗程数的增加,患者的CR率升高[19]。因此,对于易出现远处转移的N3期鼻咽癌患者,目前采用的2~3周期诱导化疗方案似乎达不到杀灭远处转移病灶需要的化疗强度,足量、多周期的诱导化疗加同期放化疗或许是一个较好的选择。基于以上观点,笔者设计了4周期TP方案诱导化疗加同期放化疗治疗N3期鼻咽癌的前瞻性研究。该研究入组了22例患者,4周期诱导化疗后,鼻咽部病灶有效率为100%(CR 22.7%,PR 77.3%),颈部转移淋巴结为95.5%(CR 27.3%,PR 68.2%),3年PFS,DMFS,LRFS及OS高达81.8%,90.9%,100%及90.9%,且患者耐受性较好,3~4度不良反应发生率也仅为4.5%~13.5%。目前研究显示,TPF方案在鼻咽癌等头颈部肿瘤的化疗中显示了较好的疗效。因此,如果在TP两药的基础上加入氟尿嘧啶进一步增加化疗强度,能不能在不增加患者毒副反应的情况下进一步提高疗效,进而带来生存的获益呢?基于以上假设,本课题组提出了TPF三药联合的4周期诱导化疗方案。
本研究结果显示出较高的近期有效率,4周期化疗后鼻咽部病灶有效率为100%(CR 15.8%,PR 84.2%),颈部淋巴结有效率100%(CR 21.1%,PR 78.9%)。治疗结束后鼻咽部CR 16例(84.2%),PR 3例(15.8%);颈部淋巴结CR 19例(100%)。本研究中,化疗后鼻咽的CR率较之前报道的低(15.8%vs22.7%),而颈部淋巴结的有效率较之前高(100%vs95.5%)。另外,本研究中3年的PFS,DMFS,OS均较之前的报道低(78.9%vs81.8%,78.9%vs90.9%,89.5%vs90.9%)[7],可能与本研究中T4患者较多(52.6%)有关。
本研究结果也显示,4周期诱导化疗患者耐受性较好,入组的19例患者均完成4周期诱导化疗。73.7%的患者完成了同步化疗,较之前的研究高(50%)[7]。血液学毒性主要是1~2度的粒细胞减少和贫血,无粒细胞减少性发热,仅2例(10.5%)出现3度粒细胞减少,无4度不良反应发生。仅有3例出现血小板轻度降低,较之前研究低[7],考虑与该方案中顺铂较奈达铂有更低的降低血小板的副作用有关。但该研究中出现肝功能异常的患者达63.2%,较之前的研究高[7],具体原因有待进一步探讨。在放化疗期间,主要反应是1~2度的中性粒细胞减少、贫血、乏力、口干、放射性黏膜炎和皮炎。本研究显示,3~4度粒细胞减少、黏膜炎及皮炎的发生率均为5.3%,比Rischin等报道的(19%,31%,23%)低[20]。该研究中2度不良反应的发生率(粒细胞减少、黏膜炎及皮炎)较之前报道的低,分别是26.3%,36.1%,36.1%。
本研究显示,在治疗初期,78.9%患者的EBV-DNA拷贝数<5 000拷贝/mL。EBV-DNA拷贝数>5 000拷贝/mL的4例患者中,1例治疗开始时拷贝数较高,两周期化疗后拷贝数继续升高,4周期化疗后降至正常;1例治疗初期拷贝数在监测线以下,两周期化疗后拷贝数升高,4周期后降至正常;另两例化疗1周期后拷贝数降至0。EBV-DNA化疗后升高是否与EB病毒释放入血有关?仍待进一步研究证实。目前,本研究中EBV-DNA的阳性率较低,建议进行试剂及操作的标准化,进一步提高阳性率及准确率,真正根据EBV-DNA的变化情况来指导临床的治疗。
总之,4周期TPF方案诱导化疗有效率较高,毒副反应较低,患者耐受性较好,未影响同期放化疗的进行。至于远期疗效,尚待进一步随访,并仍需大规模前瞻性研究。
