逆向技术用于冠状动脉慢性完全闭塞病变治疗的回顾性分析
2019-10-14胡光欣李奔赵停婷马列徐清斌刘志军仇玉民
胡光欣 李奔 赵停婷 马列 徐清斌 刘志军 仇玉民
冠状动脉慢性完全闭塞(chronic total occlusion,CTO)病变是目前经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的难点及热点。随着介入治疗器械的革新,导丝的升级,逆向技术的发展,CTO手术成功率逐渐增高[1-5]。逆向技术的产生源于CTO病变的病理和影像学特点,即多数CTO病变都存在前向或逆向的侧支循环,利用导丝通过侧支逆向穿过CTO病变进入正向指引导管中,进而体外化,可明显提高手术成功率[6]。在多数注册研究中,CTO手术失败的主要原因为导丝不能通过CTO病变或因手术并发症终止手术[7-9]。本研究分析了近2年内宁夏医科大学总医院心脑血管病医院行逆向技术CTO-PCI的患者,总结经验教训,以便更好地提高技术水平,服务于临床。
1 对象与方法
1.1 研究对象
回顾分析自2016年12月至2018年12月宁夏医科大学总医院心脑血管病医院行逆向技术CTO-PCI患者。纳入标准:手术中使用逆向技术的所有CTO-PCI患者,包括直接使用逆向技术或正向技术失败后转为逆向技术。排除标准:使用正向技术成功的CTO患者,包括正向夹层再进入(antegrade dissection reentry,ADR)技术。
1.2 手术策略
1.2.1 围术期用药 所有患者术前均给予负荷剂量阿司匹林300 mg,氯吡格雷300~600 mg或替格瑞洛180 mg,术中应用肝素100 U/kg,每1 h追加肝素2000 U或监测活化凝血时间(activated coagulation time,ACT)维持在250~350 s。术后长期给予阿司匹林100 mg、每日1次,氯吡格雷75 mg(术后第1个月150 mg)、每日1次或替格瑞洛90 mg、每日2次。
1.2.2 PCI术 穿刺入径:双侧桡动脉,右侧桡动脉+右侧股动脉,双侧股动脉。鞘管选择:使用6 F、7 F桡动脉或股动脉鞘。指引导管:左冠状动脉多使用6 F或7 F EBU3.5、EBU3.75指引导管,右侧冠状动脉使用SAL0.75、SAL1.0、AL0.75、AL1.0、JL3.5指引导管。导丝选择:工作导丝多使用Sion、Sion blue、Runthrough等。CTO导丝使用:Sion、Fielder XT、Fielder XTR、Fielder FC、Miracle3、Miracle6、Gaia1、Gaia2、Gaia3、Conquest pro、Conquest pro8-20等。微导管:Corsair 135 cm、Corsair 150 cm、Finecross 130 cm、Finecross150 cm、Caravel。球囊选择:预扩张球囊直径小于靶血管直径的0.5~1.0 mm,一般为2.0~2.5 mm,常规预扩张球囊无法通过时选择直径更小的球囊(1.0 mm、1.25 mm或1.5 mm),反向控制性前向与逆向内膜下寻径(reverse controlled anterograde and retrograde subintimal tracking,rCART)多使用2.0~2.5 mm球囊。支架选择:与靶血管直径比为(1~1.1),长度均超过病变近端和远端的2~3 cm或参照血管内超声(intravascular ultrasound,IVUS)测量结果选择。
1.3 记录资料及相关定义
收集患者病历一般资料,包括姓名、性别、年龄,危险因素如高血压病、糖尿病、吸烟史、既往心肌梗死及PCI病史及冠状动脉旁路移植术(coronary artery bypass grafting,CABG)史,血脂情况,冠状动脉影像学资料及手术资料等。
CTO病变是指闭塞血管前向血流心肌梗死溶栓治疗试验(thrombo lysisinmyocardia linfarction,TIMI)血流分级0级,且闭塞时间至少3个月。采用J-CTO评分评估病变的复杂程度[10],包括:(1)近端纤维帽圆钝;(2)迂曲角度大于45°;(3)闭塞段长度大于20 mm;(4)CTO病变中出现钙化;(5)前次手术失败。以上五项各1分,并将病变分为容易(0分)、一般(1分)、困难(2分)、非常困难(3分以上)。使用CC分级评估CTO侧支循环[11]:(1)CC 0级为不连续的细小侧支;(2)CC 1级为分支状侧支直径<300 μm;(3)CC 2级为连续分支样侧支直径>400 μm。CTO病变逆向技术主要并发症包括:靶血管夹层或破裂,侧支血管破裂,需要心包穿刺引流的心脏压塞,急性冠状动脉血栓形成,死亡等。逆向成功标准:使用逆向技术,导丝成功通过闭塞病变,支架置入术后血流达TIMI血流分级Ⅲ级,最小管腔直径狭窄到小于30%。
1.4 统计学分析
所有数据采用SPSS 22.0软件进行统计分析。计数资料用例数(百分比)表示,组间比较采用卡方检验。正态分布计量资料用均数+标准差表示,非正态分布计量资料用中位数(四分位间距)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较
CTO-PCI患者47例,包括成功组患者32例,失败组患者15例。两组患者在年龄、男性、体重指数、吸烟史、高血压病、糖尿病、既往PCI史、CABG史、左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左心室射血分数(left ventricular ejection fraction,LVEF)及多支病变等比较,差异均无统计学意义(均P>0.05,表1)。
2.2 两组患者侧支循环的影像学特征比较
失败组平均J-CTO评分较高为(2.73±0.6)分,成功组为(2.34±0.6)分,差异有统计学意义(P=0.043),且失败组中J-CTO评分≥3分比例显著高于成功组(80.0%比34.4%,P=0.040),但J-CTO评分2分显著低于成功组(13.3%比59.4%,P=0.030)。右冠状动脉为主要靶血管(36/47,76.6%),逆向侧支中高达91.4%(43/47)的患者选用室间隔支。失败组中CC分级0级显著高于成功组(46.7%比9.4%,P=0.040),差异有统计学意义。失败组中闭塞近端成刀割状患者比例高于成功组(66.7%比37.5%,P=0.062),但差异无统计学意义。两组患者在靶血管,闭塞长度大于20 mm、闭塞段迂曲大于45°、闭塞段钙化、既往尝试失败等方面比较,差异均无统计学意义(均P>0.05,表2)。
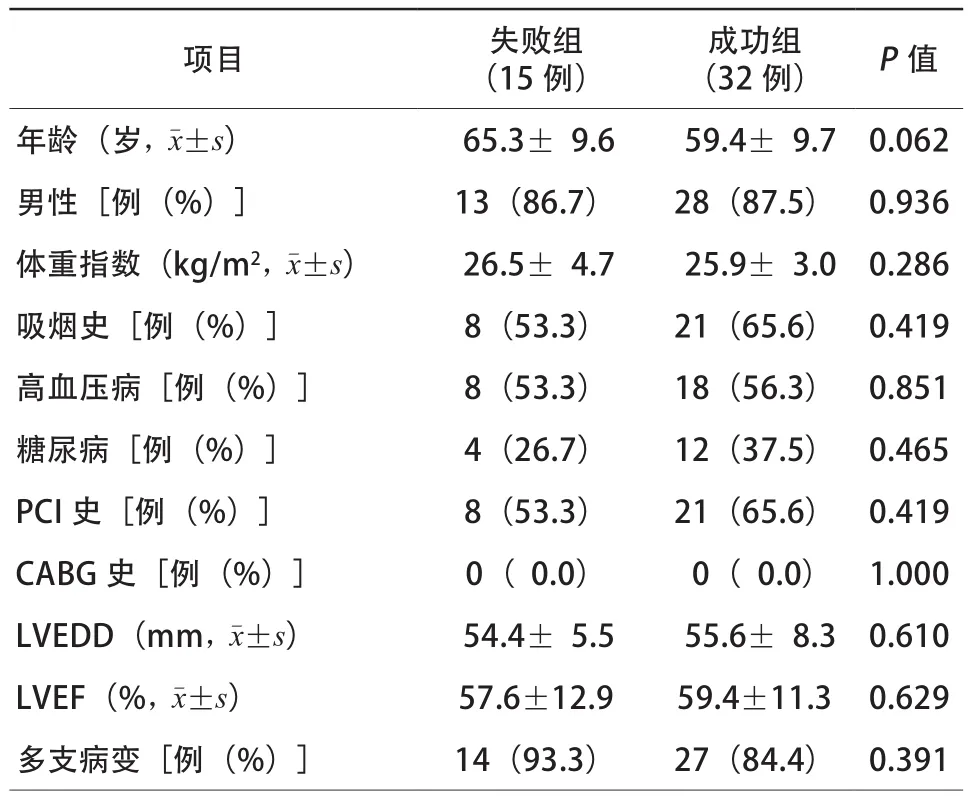
表1 两组患者一般资料比较

表2 两组患者侧支循环的影像学特征[例(%)]
2.3 两组患者手术成功率及并发症发生率比较
失败组中33.3%患者直接使用逆向技术,66.7%患者因前向技术失败转为逆向技术。而成功组中直接逆向为12.5%,前向失败转逆向占87.5%。失败组中rCART的使用率(20.0%比65.6%,P=0.005)、延长导管使用比例(6.7%比53.1%,P=0.002)显著低于成功组,差异均有统计学意义。失败组与成功组IVUS在逆向技术CTO-PCI使用率比较(13.3%比18.8%,P=0.645)、对比剂用量比较[220(140,300)ml比252(140,450)ml,P=0.097],差异均无统计学意义(表3)。
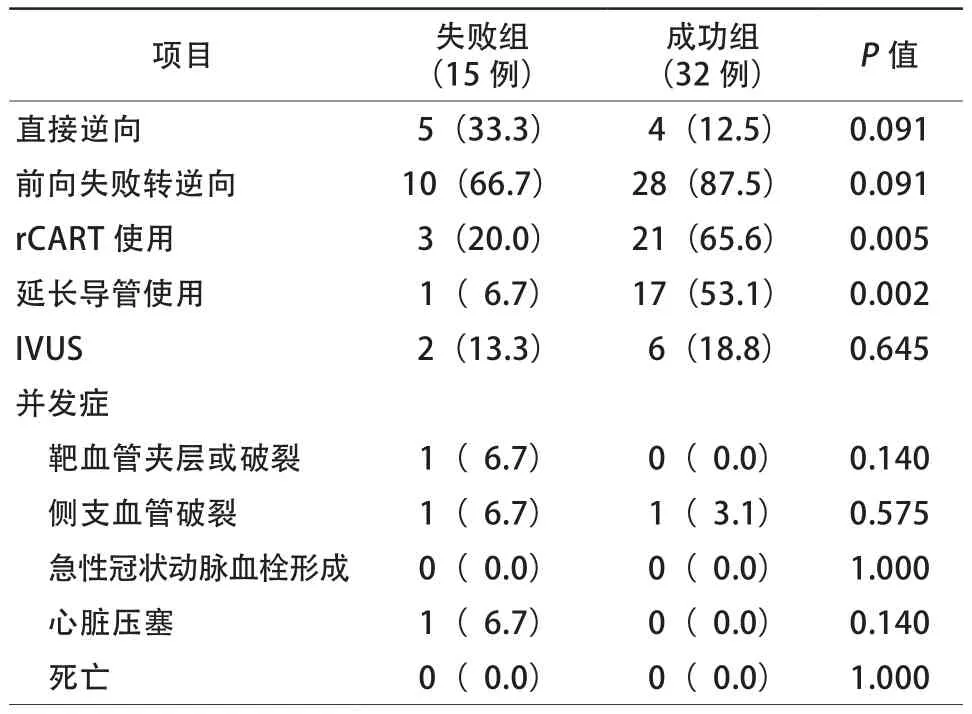
表3 两组患者手术成功率及并发症发生率[例(%)]
失败组患者中并发症总体高于成功组,其中1例患者出现靶血管夹层(AL1.0指引导管所致),使用“乒乓技术”置入支架。1例患者出现间隔支破裂,成功使用凝胶海绵封堵。1例患者出现心脏压塞,行心包穿刺引流术。成功组患者中1例患者逆向成功后出现间隔支对比剂渗漏,使用脂肪颗粒成功栓塞。
2.4 逆向技术开通CTO失败原因
使用逆向技术共47例,失败15例。15例失败患者中逆向导丝不能通过侧支4例(26.7%);逆向导丝未能通过CTO病变共5例(33.3%),其中包括2例直接rCART失败,1例IVUS引导下rCART失败,1例IVUS引导下未能找到CTO开口失败,1例因闭塞段严重钙化导丝未能通过;3例(20.0%)因微导管不能通过CTO病变失败;2例(13.3%)因并发症终止手术,其中包括1例(6.7%)因术中逆向Knuckle导丝后出现心脏压塞终止手术,另1例因间隔支破裂,使用凝胶海绵封堵后失去逆向通路;1例患者因腰椎疾病不能坚持手术。
3 讨论
逆向技术治疗CTO病变已经逐渐成为重要的手术方式之一。该技术对冠状动脉介入医师要求较高,且手术时间较长,对比剂用量较多。本研究中,使用逆向技术患者总体J-CTO平均评分为(2.54±0.6)分,手术难度相对较高,IVUS在逆向技术CTO-PCI平均使用率为17%,对比剂平均用量为236 ml,总体逆向手术成功率为68.1%(32/47)。与既往许多注册研究类似,逆向失败组患者平均年龄较成功组高,侧支循环差[12-13],如本研究中逆向失败组CC分级0级占比达46.7%。本中心CABG术后CTO患者均使用正向技术开通,未纳入本研究中。既往研究资料显示,77.8%患者逆向失败是由于导丝不能通过侧支[14]。在本研究中,分析逆向失败原因,导丝不能通过侧支仅占26.7%;33.3%逆向失败是由于逆向导丝未能通过CTO病变;20.0%是由于逆向微导管不能通过CTO病变;13.3%因手术并发症而不能不终止手术。
本研究逆向技术CTO-PCI患者中,80.9%患者首先尝试正向,正向失败后转为逆向,19.1%患者则直接启动逆向技术,考虑与患者双向造影结果,如近端纤维帽特点,远端血管直径,是否钙化、迂曲、分叉、逆向侧支、手术策略、术者技术水平及经验等因素有关。目前,rCART已经成为逆向CTO-PCI的重要组成部分,本研究中,成功组中65.6%患者使用rCART,53.1%患者使用延长导管(GuidezillaTM)。使用延长导管辅助下rCART有效地改进了rCART,缩短手术时间,提高手术效率。分析其优势如下:增强正向指引导管的支撑力及器械的输送性;缩短逆向导丝及微导管与正向指引导管之间的距离;以延长导管为目标,逆向穿刺更为易行;作为临时通道维持正向内膜下假腔,并减少逆向导丝行走进入分支可能[15-17]。
本研究中对使用IVUS的逆向技术CTO-PCI患者进行分析,左前降支IVUS使用率高于右冠状动脉(42.8%比22.2%),考虑与血管特点有关。当逆向导丝通过左前降支开口或其分支病变时,使用IVUS可确保导丝位于真腔,避免左主干夹层及重要分支闭塞[10,18-19]。本研究中,2例患者(13.3%)因术中出现并发症而不得不终止手术,分析原因与逆向技术所需手术时间较长(2~6 h),往往需要强支撑指引导管(如AL1.0,SAL0.75,该系列指引导管所致靶血管夹层较其他指引导管多)及手术操作方式方法等因素有关[8,20]。逆向手术对术者要求较高,需熟练使用多种强支撑指引导管及掌握多种手术技巧,同时应掌握逆向技术常见并发症处理技巧及应对策略,如侧支穿孔致对比剂渗漏、血管破裂、心脏压塞及股动脉血肿等。
本研究存在一定的局限性,为单中心,非随机对照研究。多数患者为本中心单独术者完成(该术者CTO手术成功率达90%以上),少数患者为国内顶尖专家手术演示完成,且样本量相对较小,需要更大样本量研究。
综上所述,逆向技术CTO-PCI失败主要原因为逆向导丝未能通过CTO病变,逆向导丝不能通过侧支,rCART失败,微导管不能通过CTO病变,手术并发症终止等。总结失败的CTO病例经验,以利于提高逆向技术CTO-PCI的手术成功率[21-23]。
