异甘草酸镁注射液与注射用环磷腺苷葡胺配伍的稳定性*
2019-10-11赵雯雯豆兴茹黄春燕陈明圆李轶
赵雯雯,豆兴茹,黄春燕,陈明圆,李轶
(苏州大学附属第一医院药学部,苏州 215000)
异甘草酸镁注射液为临床常用的甘草酸制剂,是用于抗炎保肝的一线药物[1]。注射用环磷腺苷葡胺是环磷腺苷与葡甲胺(摩尔比为1:1)的盐,是一种非洋地黄类强心剂。有研究发现,注射使用环磷腺苷能直接补充血浆和肝细胞内cAMP含量,促进肝细胞内ATP合成,还能抑制炎症细胞的粘附和浸润,从而减轻肝脏的炎症反应、恢复肝功能[2]。
临床上常选择异甘草酸镁注射液与注射用环磷腺苷葡胺配伍的方案用于某些特殊的情况,说明书未提及二者之间是否存在配伍禁忌,也未检索到两种药品在不同输液中配伍的报道。因此,笔者将异甘草酸镁注射液与注射用环磷腺苷葡胺配伍溶于5%葡萄糖注射液、10%葡萄糖注射液、0.9%氯化钠注射液、5%葡萄糖氯化钠注射液、转化糖注射液,考察其配伍后稳定性,为患者的用药安全提供初步的理论支持,报道如下。
1 仪器与试药
1.1仪器 Agilent Technologies 1100型高效液相色谱仪(美国安捷伦公司),包括G1314A可变波长扫描紫外检测器、G1316A柱温箱、G1379A脱气机、G1311A四元泵、G1313A自动液体进样器,Agilent ChemStation for LC and LC/MS systems数据分析系统;电子分析天平(METTLER TOLEDO公司,型号:XS105 DualRange,感量:0.01 mg);pH/ORP测试仪(上海罗素科技有限公司,型号:RPB1000);;GWJ-5微粒检测仪 (天津天大天发科技有限公司)。
1.2药品与试药 异甘草酸镁标准品(中国食品药品检定研究院,批号:100879-201302);环磷腺苷标准品(中国食品药品检定研究院,批号:140709-201404);异甘草酸镁注射液(正大天晴药业集团股份有限公司,批号:171222204);注射用环磷腺苷葡胺(无锡凯夫制药有限公司,批号:17111164);乙腈(色谱纯);磷酸(分析纯)。
2 方法与结果
2.1色谱条件 色谱柱[依利特,填料:SinoChrom ODS-BP(4.6 mm×150 mm,5 μm)];流动相:1%磷酸-乙腈(55:45);流速:1 mL·min-1;检测波长:250 nm;柱温:25 ℃;进样量:10 μL。
2.2溶液的制备
2.2.1标准品溶液 分别精密称取异甘草酸镁标准品11.02 mg和环磷腺苷标准品10.00 mg,分别置于10 mL量瓶,加纯化水定容,摇匀制成浓度均为1.0 mg·mL-1的标准品储备液。分别取异甘草酸镁和环磷腺苷标准品储备液适量,配制成浓度为0.4,0.5,0.6,0.7,0.8 mg·mL-1的异甘草酸镁和环磷腺苷标准品溶液。
2.2.2供试品溶液 按照临床配伍的浓度,将异甘草酸镁注射液200 mg和注射用环磷腺苷葡胺180 mg溶于250 mL的5%葡萄糖注射液、10%葡萄糖注射液、0.9%氯化钠注射液、5%葡萄糖氯化钠注射液、转化糖注射液,5种不同的溶媒配制成含有异甘草酸镁0.69 mg·mL-1、注射用环磷腺苷葡胺0.62 mg·mL-1的混合溶液作为供试品溶液,考察2种药物配伍在不同溶媒中24 h的稳定性。以此方法配制2份,第1份置于25 ℃常温避光保存,作为供试品溶液一,第2份置于4 ℃保存,作为供试品溶液二。
2.3方法学验证
2.3.1专属性实验 取0.6 mg·mL-1异甘草酸镁标准品溶液、0.6 mg·mL-1环磷腺苷标准品溶液、5%葡萄糖注射液、10%葡萄糖注射液、0.9%氯化钠注射液、5%葡萄糖氯化钠注射液、转化糖注射液按上述色谱条件依次进样,每个样品分析6 min,记录色谱图,见图1。结果表明,在此色谱条件下,空白溶媒对异甘草酸镁和环磷腺苷的含量测定并无较大影响,同时,两者的峰对称性良好,且互不干扰,其专属性良好。
2.3.2线性关系考察 将浓度为0.4,0.5,0.6,0.8,1.0 mg·mL-1异甘草酸镁和环磷腺苷标准品溶液,按上述色谱条件依次进样,分析时间为6 min,以峰面积(Y)为纵坐标与浓度(X)绘制标准曲线,得到回归方程:Y1=7 264.6X+5.972 4,r=0.999 8和Y2=18 639X+1 394.1,r=0.999 0。结果表明,异甘草酸镁和环磷腺苷的浓度在0.4~1.0 mg·mL-1范围内与峰面积线性关系良好。
2.3.3精密度实验 取0.5 mg·mL-1异甘草酸镁和环磷腺苷标准品溶液按上述色谱条件各连续进样6次,每次分析6 min。记录峰面积,计算峰面积相对标准偏差(RSD)值,异甘草酸镁RSD为0.09%,环磷腺苷RSD为0.05%。连续3 d重复上述操作,记录峰面积,计算RSD值,异甘草酸镁为0.29%,环磷腺苷为0.45%,表明精密度良好。

A.5%葡萄糖注射液;B.10%葡萄糖注射液;C.0.9%氯化钠注射液;D.5%葡萄糖氯化钠注射液;E.转化糖注射液;F.异甘草酸镁标准品;G.环磷腺苷标准品;1.异苷草酸镁;2.环磷腺苷。
2.3.4稳定性实验 取0.7 mg·mL-1异甘草酸镁标准品两份,分别在25和4 ℃保存条件下,于0,1,3,6,10,24 h依次进样,测定峰面积,计算其RSD分别为0.31%和0.34%。取0.6 mg·mL-1环磷腺苷标准品两份,同法测定峰面积,计算其RSD分别为0.54%和0.34%。表明两种标准品在25和4 ℃保存条件下,24 h内基本稳定。
2.3.5加样回收实验 精密量取含异甘草酸镁0.69 mg·mL-1、环磷腺苷葡胺0.62 mg·mL-1的5%葡萄糖注射液9份,每份0.5 mL,分别精密加入含异甘草酸镁标准品0.276,0.345,0.414 mg的储备液制成混合溶液,每个浓度平行配置3份,摇匀,取液按以上述色谱条件进样,记录异甘草酸镁峰面积,根据标准曲线计算异甘草酸镁含量和回收率,并计算平均回收率为102.25%。结果表明,该方法测定异甘草酸镁含量的准确度良好。
同法精密加入含0.248,0.310,0.372 mg环磷腺苷标准品的储备液,制成混合溶液按以上述色谱条件进样,记录异甘草酸镁峰面积,根据标准曲线计算异甘草酸镁含量和回收率,并计算回收率的平均值为102.47%。结果表明,该方法测定环磷腺苷含量的准确度良好。
2.4供试品外观及pH值测定 按临床常用量将“2.2”项配制好的供试品溶液5组,分别在25和4 ℃放置,加药后于0,1,3,6,10,24 h取样,观察其外观变化,测定pH值,结果见表1。结果发现,5组溶液于不同温度下外观在24 h内均呈现无色澄清透明,无沉淀产生。
2.5供试品含量测定 将“2.2”项配制好的供试品溶液于0,1,3,6,10,24 h取样,进行异甘草酸镁注射液和注射用环磷腺苷葡胺的含量测定。实验结果见表2。在25和4 ℃条件下,24 h内含量变化在95%~105%,在临床用药的有效范围内,24 h色谱图无其他吸收峰产生。
2.6不溶性微粒的检测 《中华人民共和国药典》2015年版规定,标识装量≥100 mL的静脉用注射液,除另有规定外,每毫升中含粒径≥10 μm微粒数不得超过25粒,含粒径≥25 μm微粒数不得超过3粒[3]。
将上述“2.2”配制好供试品溶液5组,分别在25和4 ℃放置,加药后0,1,3,6,10,24 h取样,对供试品溶液的不溶性微粒进行检测,实验结果见表3,微粒变化不超过《中华人民共和国药典》要求。

表1 不同温度下24 h内pH值变化
3 讨论
HPLC测定含量需要探索适合的色谱条件,笔者参考文献[4-6],确定流动相为1%磷酸:乙腈(55:45),配伍溶液在进样6 min内出现明显环磷腺苷和异甘草酸镁峰,两者峰对称性良好,且互不干扰,峰形良好。由于环磷腺苷葡胺中葡甲胺在反相色谱中几乎不保留,故将环磷腺苷作为含量测定对象[7-8]。含量测定的方法学研究主要考察了专属性、精密度和线性关系,考察指标均显示良好,该方法具有较高的可行性。
本次研究考察临床常用异甘草酸镁注射液和注射用环磷腺苷葡胺配伍溶于5种不同溶媒分别在25和4 ℃下放置,24 h内外观、pH值、含量以及不溶性微粒的变化,发现配伍溶液在24 h外观均呈现无色澄清透明,无沉淀产生,不溶性微粒符合要求。溶液配置24 h内,除以0.9%氯化钠注射液为溶媒的配伍溶液pH值约为6.0,其他配伍溶液pH值均保持在5.2~5.6。5种溶酶中异甘草酸镁和环磷腺苷含量变化均在(100±5)%。实验结果表明,异甘草酸镁200 mg和注射用环磷腺苷葡胺180 mg配伍溶于250 mL的5%葡萄糖注射液、10%葡萄糖注射液、0.9%氯化钠注射液、5%葡萄糖氯化钠注射液、转化糖注射液,24 h内稳定性良好,可配伍使用,从而为临床用药提供了初步的理论依据。
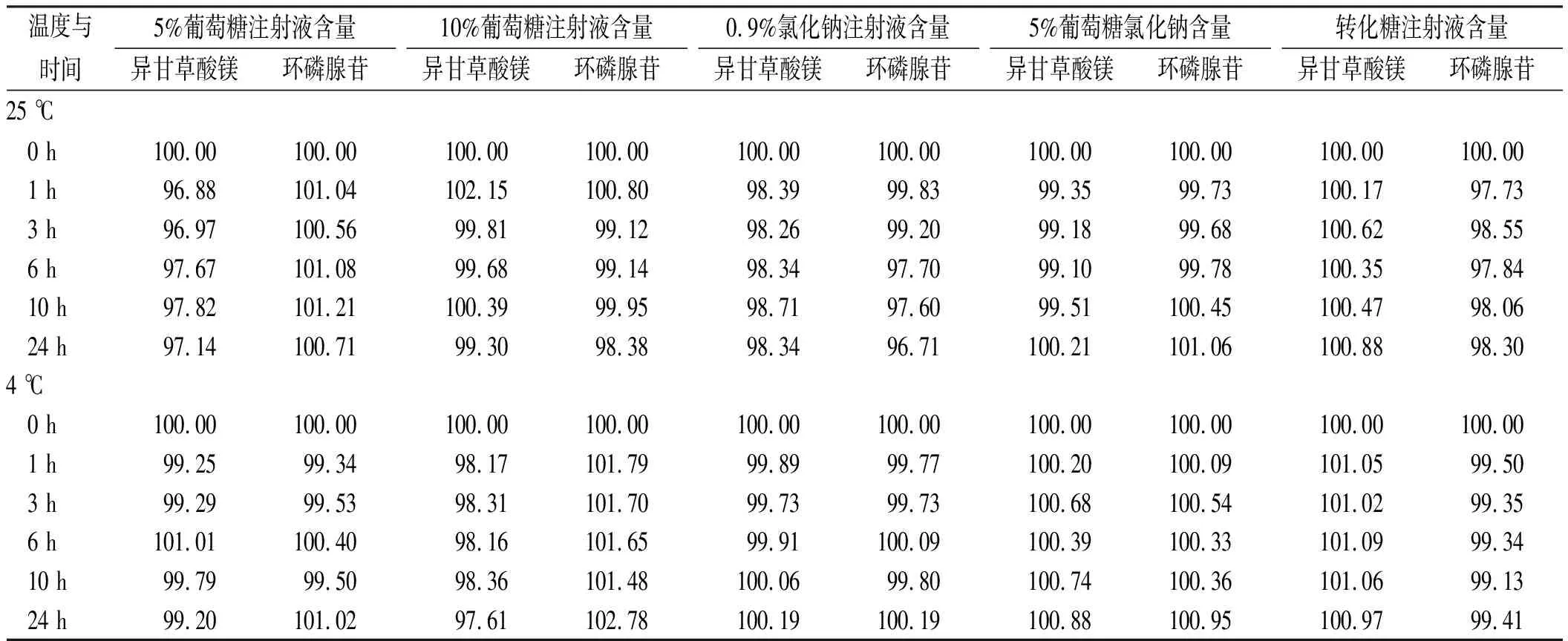
表2 不同温度下24 h内含量变化
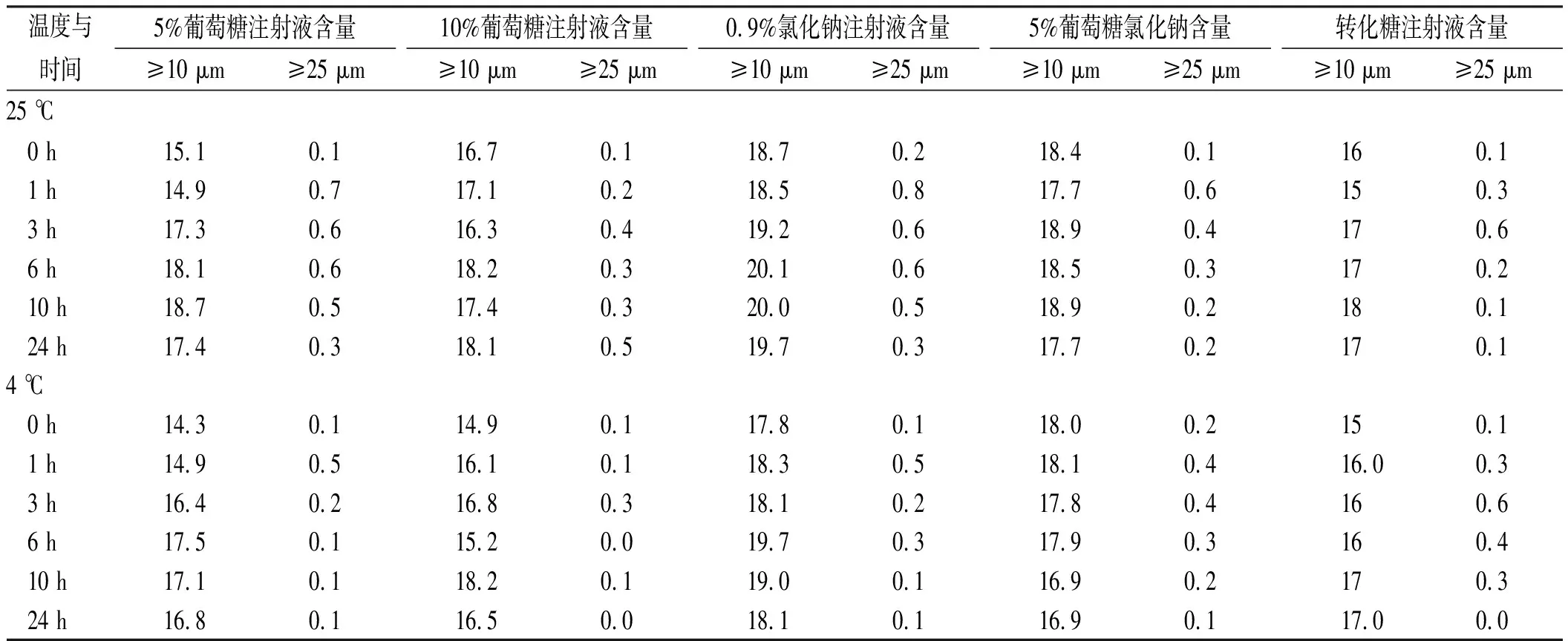
表3 不同温度下24 h内不溶性微粒的变化
