不同厂家注射用甲磺酸帕珠沙星中甘露醇的含量测定*
2019-10-11晏菊姣汪鑫陈蓉王珺
晏菊姣,汪鑫,陈蓉,王珺
(武汉药品医疗器械检验所,武汉 430075)
甲磺酸帕珠沙星是日本研究开发的第3代喹诺酮类广谱抗菌药,对厌氧菌有较强的抗菌活性[1]。我国目前有甲磺酸帕珠沙星大容量注射液,小容量注射液及冻干粉针三个注射剂型。甘露醇通常可作冻干粉针剂载体,使用较多。《中华人民共和国药典》2015年版四部通则0102仅对注射剂中常用抗氧剂与抑菌剂规定一般浓度范围[2],对其他添加的辅料仅仅描述为“适量”,注射用辅料的用量不规范影响药物的疗效和安全性。在甲磺酸帕珠沙星系列制剂国家评价性抽验中,笔者收集7家药品生产企业23批次注射用甲磺酸帕珠沙星样品,其中6家生产企业都使用甘露醇,仅1家未使用。从生产企业提供的处方来看,使用量差别比较大。辅料甘露醇的用量不一,可影响产品稳定性和使用时渗透压不一致,易出现不良反应[3-5]。同时甘露醇具有一定的药理活性,使用得当可增加制剂的稳定性并降低毒副作用[3];使用不当则会增加药物不良反应的发生率。注射剂中应尽量少加添加剂,或用量尽量少达到最好的效果来减少风险。因此,有必要对辅料的含量进行控制[6],更不能违法添加。笔者采用高效液相色谱-蒸发光散射检测(HPLC-ELSD)法测定注射用甲磺酸帕珠沙星中甘露醇含量,并进行方法学考察,为该品种的辅料用量控制提供参考。
1 仪器与材料
1.1仪器 WATERS高效液相色谱仪(带四元泵);ALLTECH2000蒸发光散射检测器;自动进样器;XS105电子天平(梅特勒-托利多仪器公司,感量:0.01 mg)。
1.2试药 甘露醇对照品(中国食品药品检定研究院,含量测定用,批号:100533-201103,含量:98.5%);乙腈为HPLC级,实验用水为超纯水。注射用甲磺酸帕珠沙星(生产企业7家,23批)。
2 方法与结果
2.1色谱条件 采用依利特NH2色谱柱(4.6 mm×200 mm,5 μm),流动相:乙腈-水(90:10),流速:1 mL·min-1,柱温:30 ℃。蒸发光散射检测器,漂移管温度:90 ℃;空气流速:2.0 L·min-1。
2.2溶液的制备
2.2.1对照品溶液的制备 取甘露醇对照品40 mg,精密称定,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得。
2.2.2供试品溶液的制备 取供试品适量,加水制成相当于每毫升含甘露醇0.4 mg的溶液,即得。
2.2.3阴性样品溶液的制备 按注射用甲磺酸帕珠沙星处方制备不含甘露醇的阴性样品,按“2.2.2”项下方法制备阴性样品溶液。
2.3专属性实验 分别精密吸取对照品溶液、供试品溶液与阴性样品溶液,按“2.1”项色谱条件注入液相色谱仪,记录色谱图。见图1。结果供试品溶液与对照品溶液色谱呈现保留时间相同的色谱峰,阴性样品溶液无干扰。在此实验条件下甘露醇与其他组分分离良好。理论板数按甘露醇峰计算应不低于3000。
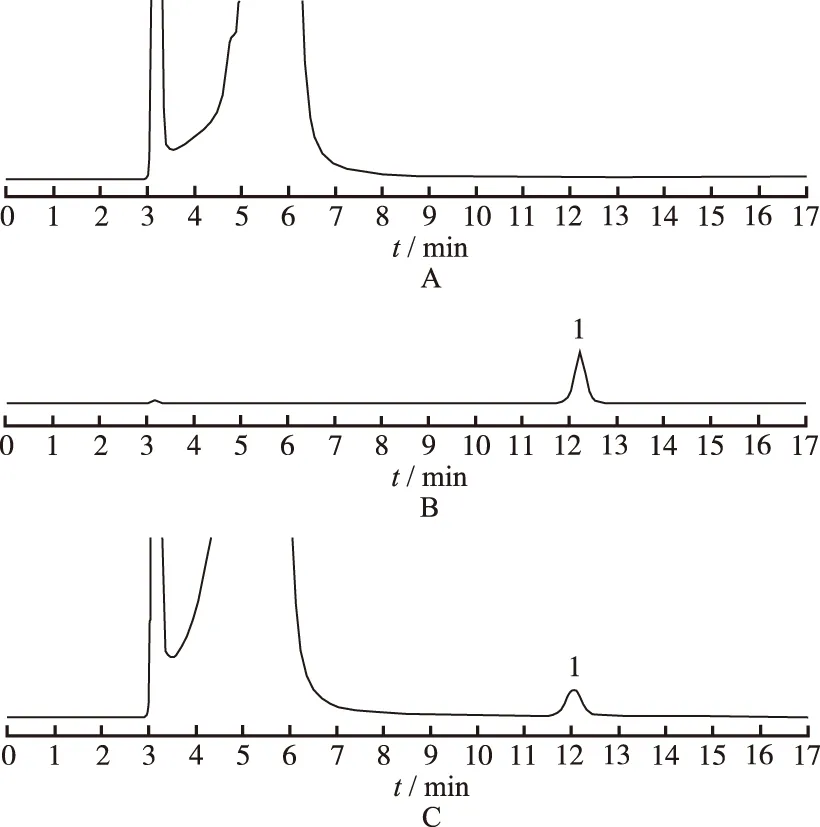
1.甘露醇
2.4线性关系实验 分别精密吸取对照品溶液2,4,5,10,15,20 μL(含甘露醇0.792,1.580,1.979,3.928,5.937,7.916 μg),按“2.1”项下色谱条件注入液相色谱仪,记录色谱图,以峰面积常用对数(Y)对进样质量(μg)常用对数(X)进行线性回归,得回归方程为:Y=1.581X+5.774,r=0.999 5,线性范围为0.792~7.916 μg。表明在此范围内甘露醇进样质量对数与峰面积对数呈良好的线性关系。
2.5精密度实验 取“2.2.1”项对照品溶液,按“2.1”项下色谱条件连续进样6次,峰面积RSD为0.42%。结果表明仪器精密度良好。
2.6稳定性实验 按“2.2.2”项下方法制备供试品溶液1份,分别于0,2,8,12,24 h进样,进样量为10 μL,结果峰面积的RSD为0.98%,表明供试品溶液在24 h内稳定。
2.7重复性实验 取某企业样品(批号:130203),按“2.2.2”项下方法制备,取含量测定浓度的80%、100%、120%溶液各3份,注入液相色谱仪进行测定,计算9份样品中甘露醇的含量,结果平均值为14.7 mg·g-1,含量的RSD=1.26%(n=9),结果表明方法的重复性良好。
2.8准确度实验 精密称取已测定甘露醇含量的样品(批号:130203,含量14.7 mg·g-1)适量,精密加入甘露醇,按“2.2.2”项下方法分别配制含量测定浓度80%、100%、120%的溶液各3份,注入液相色谱仪进行测定,计算9份样品的回收率,分别为:100.77%,103.01%,104.68%,100.33%,97.83%,100.82%,98.72%,102.04%,102.88%;平均回收率为101.2%,RSD=2.1%。
2.9样品测定结果 取7个厂家生产的注射用甲磺酸帕珠沙星23批次,依法测定,结果其中G生产企业6个批次均未检出甘露醇,其他企业测定结果见表1。
3 讨论
3.1方法的必要性 药用辅料是制剂一个重要组成成分,直接进入到人体,辅料质量的好坏、量的多少与人的生命健康息息相关。冻干粉针由于辅料和工艺的原因,吸湿性一般均较强[7],易影响药物质量,同时鉴于甘露醇自身的生理活性问题(作降压剂、利尿剂、脱水剂,对人体肠道的清理和轻微的脱水作用)[8],为保证安全用药,有必要考察辅料的投料情况。
3.2方法实用性 企业在研发过程中可通过此测定方法筛选样品工艺,确定甘露醇的用量,保证药品质量。从收集到样品来看,各企业的甘露醇用量为0~345.16 mg·g-1,差异很大,甘露醇虽然利于复溶,但其本身的质量和加入量会影响制剂的质量,包括细菌内毒素[9]、不溶性微粒、溶液的澄清度和颜色、水分等。某企业甘露醇加入与主药比达到1:1,冻干过程中甘露醇量大,空隙致密,水分不易逸出,这也是该企业产品水分较其他企业偏高的原因之一。辅料量影响药物制剂的稳定性,并增加安全风险,因此各企业的甘露醇处方量值得商榷。
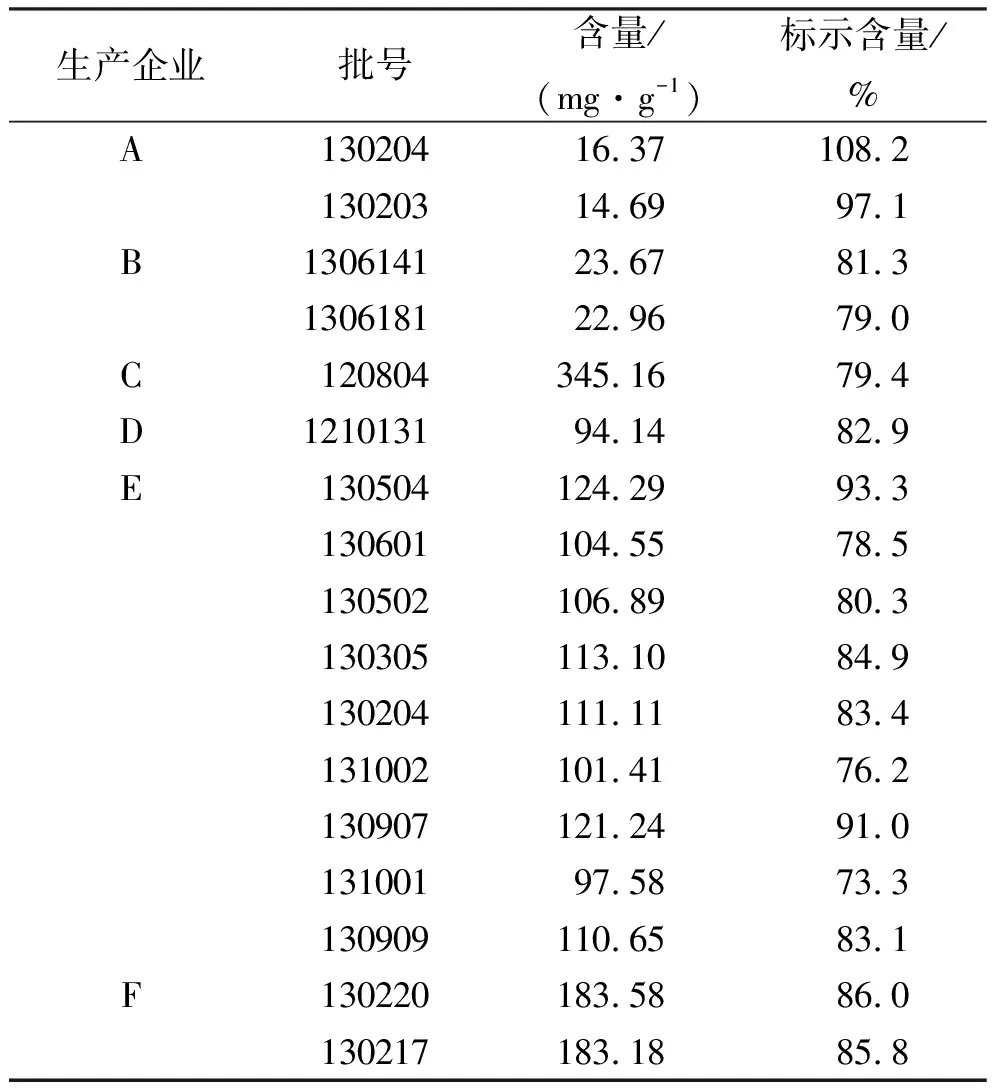
表1 不同生产企业注射用甲磺酸帕珠沙星中甘露醇含量
生产企业和监管部门通过此测定方法对生产过程中添加的辅料进行监控,以利于企业严格按规范进行生产,保证药品的安全性。从检验结果来看,各企业甘露醇为标示量73.3%~108.2%,投料基本符合处方,但部分企业批次间波动较大,不利于产品质量控制。
3.3测定方法的选择 甘露醇自身没有紫外吸收。其属于六元醇极性化合物,在常规的C18柱上几乎无保留。文献有采用高效液相色谱法(氨基柱[10]或强阳离子交换柱[11-12])-RID及HPLC-ELSD[13],但强阳离子交换柱较昂贵,蒸发光散射器适用范围广,比RID受外界因素干扰较少[10-13]。考虑到测定对象是注射剂中辅料,主药含量较大,为避免主药和其他辅料的干扰,选择使用氨基柱和ELSD。适当增强乙腈的比例,检测器的基线噪声降低、分离度变高。该实验中乙腈-水(90:10)时分离度较好。结果表明本研究中方法专属性强,精密度、稳定性较好,准确度较高,能客观反映甘露醇的含量,可作为注射用甲磺酸帕珠沙星中辅料甘露醇的含量检测方法。
