盐酸丁螺环酮大鼠在体肠吸收特征*
2019-10-11王柯玉牟雄军林宁
王柯玉,牟雄军,林宁
(湖北中医药大学药学院,武汉 430065)
盐酸丁螺环酮(buspirone hydrochloride,BUS)为氮杂螺环癸烷二酮化合物,于1985年由德国Bristol-Myers上市,目前已在世界上很多国家广泛使用。该药物在临床上主要用于广泛性焦虑症,还适用于更年期综合征、抑郁症、注意力缺乏、精神分裂症等[1]。丁螺环酮作为新一代非苯二氮类抗焦虑药,几乎无依赖性与耐药性,能长期服用,且无镇静催眠作用,对认知无影响,被认为是较为理想的抗焦虑药[2]。
BUS生物半衰期约2.6 h,血药峰值浓度较低,目前市场上出售大多为普通片,其存在服药次数多、顺应性差、生物利用度较低等问题,因此开发BUS缓释、控释制剂具有临床应用价值[3]。目前关于BUS肠道吸收及其机制研究的报道较少,研究药物肠道吸收机制和吸收动力学对于指导口服药物的剂型设计,尤其对缓释、控释制剂的剂型设计具有重要意义。因此,本研究选用大鼠在体肠灌流法,采用高效液相色谱(HPLC)法测定循环灌流液中BUS浓度,考察药物在大鼠肠道的吸收动力学特征,为BUS的缓释、控释制剂的研究与设计提供生物药剂学依据[4]。
1 材料与仪器
1.1实验动物 斯泼累格·多雷(SD)大鼠,雄性,体质量(250±50)g,购自华中科技大学同济医学院动物实验中心,实验动物生产许可证号:SCXK(鄂)2011-0009,实验动物使用许可证号:SYXK(鄂)2013-0072。动物饲养于湖北中医药大学实验动物中心,温度18~35 ℃,相对湿度45%~75%,适应性喂养1周后开始实验,手术前禁食12 h,自由饮水。
1.2试药 BUS原料药(上海玉博生物科技有限公司,批号:20150722,含量≥99.9%);BUS对照品(原料药精制,批号:201610);酚红(国药集团化学试剂有限公司,批号:20150424);戊巴比妥钠(中国医药集团上海化学试剂公司,进口分装,批号:F20141216);甲醇(色谱纯,TEDIA);乙腈(色谱纯,TEDIA);其他试剂均为分析纯;水为超纯水。
1.3仪器 戴安P680高效液相色谱仪(美国戴安);UV-1800型紫外-可见分光光度计(日本岛津);BP211D电子天平(德国赛多利斯天平有限公司,感量:0.01 mg);HL-2恒流泵(上海沪西分析仪器厂);DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);SK2200H型超声波清洗仪(上海科导超声仪器有限公司)。
2 方法与结果
2.1肠循环液中BUS的含量测定
2.1.1溶液的配制 K氏缓冲液的制备:称取氯化钙0.37 g、葡萄糖1.40 g,置烧杯中,用适量水溶解;再称取氯化钠7.8 g、氯化钾0.35 g、氯化镁0.22 g、碳酸氢钠1.37 g、磷酸二氢钠0.32 g,依次加入另一烧杯中溶解;二者混合并定容至1 000 mL,测得pH值为7.4。空白肠循环液的制备:将配置好K氏液经肠循环装置,以5.0 mL·min-1流速冲洗大鼠肠道约45 min,收集,滤过,即得空白肠循环液。对照品溶液的制备:精密称取BUS对照品适量,用空白肠循环液溶解并定容,配制成含BUS浓度为0.101 mg·mL-1的对照品溶液。供试品溶液的制备:精密称取BUS和酚红适量,用空白肠循环液溶解并定容,配制成BUS浓度为20.12 μg·mL-1,酚红浓度为20.07 μg·mL-1的混合供试品溶液。
2.1.2色谱条件 色谱柱:Agilent SB-C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-1%甲酸(40:60);检测波长:238 nm;流速:1.0 mL·min-1;柱温:35 ℃;进样量:20 μL。
2.1.3系统适应性实验 按照“2.1.2”项色谱条件,取对照品溶液、供试品溶液、空白肠循环液进样测定。结果见图1,BUS保留时间为6.33 min,样品液主峰保留时间与对照品一致;空白肠循环液在BUS出峰处无干扰;供试品的分离度不少于1.5,理论板数不少于5 000。
2.1.4线性关系与方法学考察 精 密量取BUS对照品溶液适量,配制成4.04,8.08,12.12,16.16,20.20,30.30 μg·mL-1系列浓度标准溶液,于上述色谱条件下分别进行HPLC测定;以峰面积(A)对BUS浓度(C,μg·mL-1)进行线性回归,得回归方程:A=0.049 9C+0.007 3(R2=0.999 1);BUS在4.04~30.30 μg·mL-1浓度范围内峰面积与浓度的线性关系良好。精密度实验中日内RSD=0.52%(n=5),日间RSD=0.84%(n=3);稳定性实验中将BUS对照品溶液室温放置24 h,其峰面积RSD=1.54%(n=5),说明在实验过程中,BUS稳定性良好;加样回收率实验中配置浓度为20.12 μg·mL-1的BUS标准溶液,分别加入相当于标准溶液含量80%,100%,120%的样品,测定BUS的浓度,其平均回收率为99.73%,RSD=1.12%(n=3);均符合要求[5-7]。
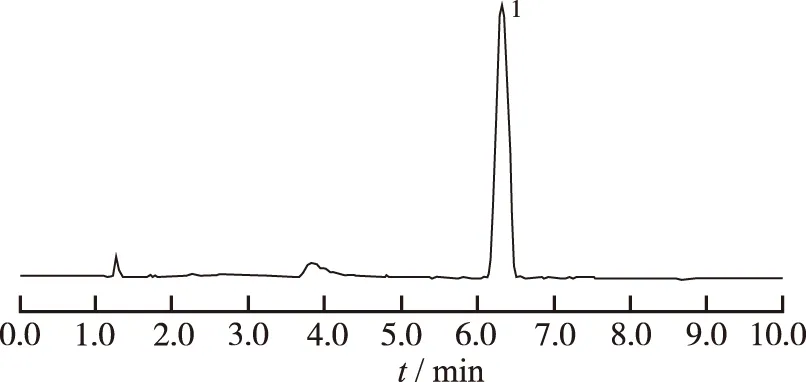
1.盐酸丁螺环酮
2.2肠循环液中酚红浓度的测定
2.2.1测定方法 采用可见-紫外分光光度法测定肠循环液中酚红的浓度。在波长200~600 nm范围进行紫外扫描,酚红在558 nm处有最大吸收,其他成分在此处无吸收,对酚红无干扰,故在波长558 nm处测定酚红的吸光度(A值)。
2.2.2酚红标准曲线的制备 精密称取酚红适量,配制浓度为5.03,10.06,20.12,30.18,35.21 μg·mL-1的酚红系列标准溶液,分别取酚红标准溶液0.5 mL置于10 mL具塞试管中,加入0.2 mol·L-1氢氧化钠溶液 5 mL,摇匀,用孔径0.45 μm微孔滤膜滤过,弃去初滤液,取续滤液,以0.2 mol·L-1氢氧化钠溶液为空白,在波长558 nm处测定,以A值对酚红浓度(C,μg·mL-1)进行线性回归,标准曲线回归方程为:A=0.009 8C+0.038 1(R2=0.999 7)。结果表明,酚红在浓度范围5.03~35.21 μg·mL-1内有良好的线性关系[8]。精密度实验中日内RSD=0.43%(n=5),日间RSD=0.75%(n=3);稳定性实验中将酚红溶液室温放置24 h,其峰面积RSD=1.32%(n=5),说明在实验过程中,酚红稳定性良好;加样回收率实验中配置浓度为20.07 μg·mL-1的酚红标准溶液,分别加入相当于标准溶液含量80%,100%,120%的样品,测定酚红的浓度,其平均回收率为99.52%,RSD=1.26%(n=3);均符合要求。
2.3大鼠在体肠道吸收实验
2.3.1肠道吸收实验方法 大鼠禁食、正常饮水18~20 h;麻醉,背位固定在手术台上,沿腹中线剪开腹腔;选取所需肠段,两端剪口,插管扎紧;用预热至37 ℃的0.9%氯化钠溶液冲洗肠道,再通入空气排净0.9%氯化钠溶液[9]。先用BUS供试品溶液以5 mL·min-1的流速循环10 min,然后将流速调节为2.5 mL·min-1;分别于不同时间点从供试液中分别取2和0.5 mL作为BUS和酚红的待测液,随即补充同浓度酚红供试品溶液2.5 mL;按上述方法测定各时间点BUS峰面积值(采用外标法)和酚红吸光度值,按文献方法计算吸收速率常数(Ka)和吸收百分率(ρ)[10-11]。
2.3.2不同肠段对药物在体肠吸收的影响 将十二指肠、空肠、回肠及结肠作为考察肠段,取含BUS浓度为20.12 μg·mL-1、酚红浓度为20.07 μg·mL-1的供试品溶液。按“2.3.1”项下方法操作,于0,0.5,1,1.5,2,2.5,3,3.5,4 h取样,计算吸收参数,结果见表1。对数据进行方差分析及两两间多重比较,结果显示不同肠段Ka差异有统计学意义(P<0.05)。各肠段吸收速率常数按十二指肠、空肠、回肠、结肠的顺序依次下降。十二指肠为药物最佳吸收部位,但药物在整个肠段均有一定吸收。
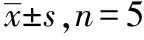
表1 盐酸丁螺环酮在大鼠各肠段吸收参数
2.3.3不同浓度对药物在体肠吸收的影响 选取全肠段为考察肠段,取含BUS浓度分别为10.06,20.12,30.18 μg·mL-1、酚红浓度为20.07 μg·mL-1的供试品溶液。按“2.3.1”项下方法操作,于0,0.5,1,1.5,2,2.5,3,3.5,4 h取样,计算其吸收参数,结果见表2。对Ka进行配对t检验,结果表示在不同药物浓度下,吸收速率常数Ka差异无统计学意义(P>0.05),表明浓度在10.06~30.18 μg·mL-1,药物的吸收量与浓度成正比,Ka无明显变化,无饱和吸附现象,符合Ficks扩散原理,提示BUS的小肠吸收为被动扩散的机制。
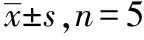
表2 不同浓度盐酸丁螺环酮小肠吸收实验结果
2.3.4pH值对药物在体肠吸收的影响 选取吸收速率常数最大的十二指肠,用pH值为5.4,6.8,7.4的K氏液分别配制含BUS浓度为20.12 μg·mL-1、酚红浓度为20.07 μg·mL-1的供试品溶液。按“2.3.1”项下方法操作,于0,0.5,1,1.5,2,2.5,3,3.5,4 h取样,计算其吸收参数,结果见表3。对Ka进行配对t检验,结果表示在不同环境pH值下,吸收速率常数Ka差异无统计学意义(P>0.05)。说明在pH值5.4~7.4范围内,BUS的吸收不受介质pH值的影响。
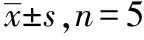
表3 不同pH值下盐酸丁螺环酮小肠吸收实验结果
3 讨论
在体肠循环法研究大鼠肠道吸收情况,通常认为大鼠肠道不仅吸收药物,同时也可能吸收或排出水分,所以在循环时会导致供试品溶液体积的改变[12]。一般可在循环液中加入酚红,由于酚红为大分子络合物,较难被肠道所吸收,因此可通过酚红浓度的变化来对肠循环液体积进行校正,即得不同时刻的剩余药量[13]。
从实验结果可以看出,以循环液中BUS剩余药量的对数lgD对时间t作线性回归,所得相关系数r均大于0.9,线性关系较好,提示BUS在大鼠小肠的吸收符合表观一级动力学过程,吸收以被动扩散为主;且BUS的吸收不受药物浓度和pH值的影响;大鼠各肠段间药物的吸收速率常数差异有统计学意义,按十二指肠、空肠、回肠、结肠依次减小,但药物在整个肠段均有一定程度的吸收,提示盐酸丁螺环酮可以制备缓释、控释制剂[14-15]。
