表没食子儿茶素对小鼠离体脑片及氧糖剥夺损伤HT-22细胞系的保护作用*
2019-10-11尹雄章肖珊马郁文方春香张晓雪
尹雄章,肖珊,马郁文,方春香,张晓雪
(1.华中科技大学同济医学院附属同济医院药学部,武汉 430030;2.华中科技大学同济医学院附属武汉市中心医院药学部,武汉 430014;3.武汉市第四医院、华中科技大学同济医学院附属普爱医院检验科,武汉 430034)
儿茶素是茶多酚中主要活性物质,具有抗菌、抗氧化以及抗肿瘤等多种生物活性[1]。儿茶素主要包括4种单体,包括表儿茶素(epicatechin, EC)、表儿茶素没食子酸酯(epicabechin gallate, ECG)、表没食子儿茶素(epigallocatechin, EGC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)。近年来,儿茶素在脑缺血损伤中保护作用备受关注。研究表明:EC可通过作用于转录因子NF-E2相关因子2(NF-E2-related factor 2, Nrf2)通路减轻小鼠脑梗死后氧化应激损伤,保护脑组织[2-3];EGCG可作用于 PI3K/AKT/eNOS信号通路、抑制炎症反应以及抑制内质网应激等从而减轻缺血-再灌注所致的脑组织损伤[4-6]。在人脑微血管内皮细胞的缺血复灌模型中,ECG也被证实能促进新血管形成,减轻细胞凋亡和自噬,促进细胞增殖[7]。然而,EGC在脑缺血损伤中作用研究甚少,其对脑缺血的保护作用尚不清楚。为了更好地阐明儿茶素的生物活性和药理作用,笔者利用小鼠离体脑片及海马神经元HT-22细胞培养模型,研究EGC对缺血损伤的保护作用。
1 材料与方法
1.1实验动物 健康清洁级雄性昆明小鼠,体质量20~25 g,由华中科技大学同济医学院实验动物中心提供。动物合格证号:00020736;实验动物生产许可证号:SCXK(鄂)2010-0009。小鼠随机分笼饲养,室温保持在20~22 ℃,自由饮水与进食,光照遵循自然节律。本实验方案在华中科技大学同济医学院动物伦理委员会审批后实施。
1.2细胞系 实验用小鼠海马神经元HT-22细胞系购自广州吉妮欧生物科技有限公司。用含10%胎牛血清(fetal bovine serum ,FBS)的达尔伯克改良伊格尔培养基(DMEM)培养,置于37 ℃含5%二氧化碳(CO2)的培养箱中。培养基每2 d换液一次,细胞系每3 d进行一次传代。
1.3主要药品和试剂 表没食子儿茶素(上海源叶生物科技有限公司,批号:970-74-1,含量:98%);乌拉坦(医药集团上海化学试剂公司,批号:07032)。乳酸脱氢酶(LDH)试剂盒(批号:20140107),超氧化物歧化酶(SOD)试剂盒(批号:20140115),考马斯亮蓝试剂盒(批号:20110303)均购于南京建成生物工程研究所。CCK-8试剂盒(日本同仁公司,货号:CK04)。2,3,5-三苯基氯化四氮唑(2, 3, 5 -triphenyltetrazolium chloride,TTC)购自Sigma公司(批号:BE 090326),用双蒸水配成20 g·L-1的溶液,常温避光保存。其他试剂均为市售分析纯。人工脑脊液(artificial cerebrospinal fluid, ACSF)由实验人员配制,其组成为(mmol·L-1):氯化钠(NaCl )126, 氯化钾(KCl)3.5, 磷酸二氢钠(NaH2PO4)1.2, 氯化镁(MgCl2)1.3, 氯化钙(CaCl2)2.0, 葡萄糖[D-(+)-glucose]11, 碳酸氢钠(NaHCO3)25。孵育脑片时预先以含95% 氧气(O2)和5% CO2的混合气饱和。无糖ACSF以10 mmol·L-1蔗糖代替葡萄糖。
1.4脑片及细胞OGD损伤模型的制备 小鼠腹腔注射20%乌拉坦0.1 mL·(10 g)-1,迅速处死取脑,浸入4 ℃预饱和95%O2+5% CO2的ACSF中。分离双侧皮质和海马,沿冠状面于组织切片机上将皮层,海马分别切成厚400 μm的脑片。冲洗后,采用简单随机法将脑片分为正常对照组及模型对照组,并分别置于3 mL ACSF的孵育瓶中(持续通95%O2+5%CO2的混合气体),每瓶含脑片6片(脑片不重叠)。在35 ℃水浴槽中孵育30 min,模型对照组迅速换成无葡萄糖并预饱和95%氮气(N2)+5% CO2的ACSF孵育。皮层脑片孵育15 min,海马脑片孵育10 min。正常对照组进行换液操作,但不做OGD处理。EGC小、中、大剂量组在进行OGD处理时,分别给予1,3和10 mg·L-1EGC共同孵育。
HT-22细胞OGD:将培养液换成不含FBS的无糖DMEM,置于含5%CO2、95% N2的培养箱中,连续培养3 h。空白对照组进行换液操作但不做OGD处理。药物干预组在进行OGD处理时,给予浓度为3 mg·L-1EGC共孵育。
1.5脑片TTC染色法 参照文献[8]。培养结束后分别将皮质和海马脑片与TTC溶液在37 ℃条件下避光孵育30 min,随后取出,0.9%氯化钠溶液漂洗,吸去表面水分,称湿重,以脑片1 g加入抽提液(乙醇:二甲亚砜=1:1)20 mL中,避光24 h后按每孔皮质200 μL、海马100 μL加至96孔板,酶标仪测定各孔在490 nm波长处吸光度值(A490)。
1.6LDH释放量的测定 培养结束后,收集各组孵育液,按照LDH试剂盒说明书进行测定。通过酶标仪测定其在440 nm处A值,求出每毫克脑片组织LDH含量。每次实验前,通过绘制标准曲线确定样本的取样量。
1.7SOD活力的测定 培养的皮层及海马组织用0.9%氯化钠溶液匀浆,培养的细胞系用磷酸盐缓冲液(PBS)匀浆,4 ℃,3000 r·min-1离心20 min。收集上清液保存于-70 ℃冰箱中。参照SOD试剂盒说明书,测定SOD活力。通过酶标仪测定其在550 nm波长处A值,求出每毫克总蛋白的SOD活力。在每次实验前,利用考马斯亮蓝试剂盒绘制标准曲线确定样本的取样量。
1.8CCK-8检测细胞活力 将1×105·mL-1细胞悬液接种于96孔培养板中(每孔100 μL)。实验分为3组:正常对照组,模型对照组,EGC组。OGD结束后,每孔加入CCK-8溶液10 μL,在培养箱内孵育1 h后,于全自动酶标仪在450 nm处检测各组A值。取4孔A值的平均数,按公式计算细胞活力:细胞活力(%)=处理组A值/对照组A值×100%,重复3次。

2 结果
2.1EGC对小鼠皮质及海马脑片OGD损伤TTC染色的影响 脑片TTC染色A490值显示:小鼠皮质和海马经OGD后脑组织均受到明显损伤,与正常对照组比较差异有统计学意义(皮质:t=7.77,P<0.01;海马t=5.75,P<0.01)。与模型对照组比较,EGC小、中、大剂量组损伤明显改善,差异有统计学意义(皮质:t=1.84,2.55,3.47,P<0.01;海马:t=1.96,2.16,4.21,P<0.01)。见图1,表1。
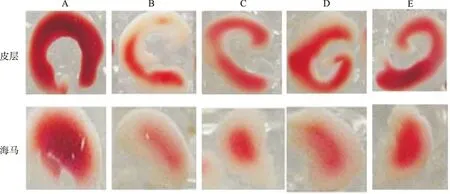
A.正常对照组;B.模型对照组;C.EGC小剂量组;D.EGC中剂量组;E.EGC大剂量组。

表1 5组小鼠皮质及海马脑片TTC染色后A490检测值
2.2EGC对小鼠皮质及海马脑片OGD损伤组织LDH释放量的影响 与正常对照组比较,模型对照组LDH的释放量显著增加(皮质:t=4.68,P<0.01;海马:t=5.09,P<0.01)。与模型对照组比较,EGC小、中、大剂量组皮质及海马脑片组织中LDH的释放量显著降低,差异有统计学意义(皮质:t=3.62,4.70,6.06,P<0.01;海马:t=2.09,2.83,5.48,P<0.05或P<0.01)。结果见表2。
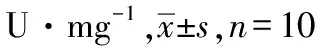
表2 5组小鼠皮质及海马脑片组织LDH释放量
2.3EGC对小鼠皮质及海马脑片OGD损伤组织SOD活力的影响 与正常对照组比较,模型对照组皮质及海马组织SOD活力明显下降(皮质:t=3.48,P<0.01;海马:t=8.58,P<0.01)。与模型对照组比较,EGC小、中、大剂量组皮质及海马脑片组织中SOD活力明显升高(皮质:t=2.06,2.56,7.83,P<0.01;海马:t=4.71,6.08,11.03,P<0.01)。结果见表3。
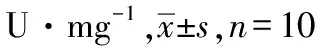
表3 5组小鼠皮质及海马脑片组织SOD活力检测值
2.4EGC对HT-22细胞系OGD损伤后细胞活力及SOD活力的影响 与正常对照组比较,HT-22细胞系经OGD处理后细胞活力明显下降(t=11.03,P<0.01),SOD活力明显降低(t=8.55,P<0.01)。给予3 mg·L-1EGC处理后HT-22细胞系的细胞活力及SOD活力明显升高(t=7.76,t=5.04,均P<0.01)。结果见表4。
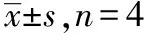
表4 EGC对HT-22细胞系OGD损伤后细胞活力及SOD活力的影响
3 讨论
离体脑片及细胞培养技术是神经科学研究领域中常用的一种技术手段。对离体培养的脑片或细胞进行氧糖剥夺处理,可模拟脑缺血的病理模型,从而评价药物对脑缺血损伤的保护作用。在本实验中,离体培养的小鼠脑片及海马神经元HT-22细胞经氧糖剥夺处理后可出现明显损伤。在氧糖剥夺的同时给予EGC共孵育,发现EGC可逆转OGD对小鼠离体脑片及HT-22细胞的损伤作用。
脑缺血损伤与自由基的产生及其引发的氧化、过氧化病理反应密切相关,因此,应用抗氧化剂对其进行有效防治已经成为近年来研究热点[9]。正常生理下,体内氧自由基的产生和清除处于平衡。一旦自由基代谢失衡,即可导致细胞损伤。EGC属多酚类化合物,有强效的抗氧化作用和自由基清除能力。研究表明,EGC能抑制脂质过氧化[10],猝灭单线态氧[11],以及清除一氧化氮和超氧化物[12]等,从而发挥强大的抗氧化作用。本研究发现,给予EGC可逆转OGD所致的SOD活力下降。SOD是生物体内清除自由基的首要物质,可把有害的超氧自由基转化为过氧化氢,继而被过氧化氢酶和过氧化物酶分解为完全无害的水。所以,此结果提示EGC可以抑制脑缺血所致的氧化应激反应,从而发挥保护作用。笔者目前还未见有研究报道指出EGC对脑缺血损伤有保护作用。但结果显示儿茶素能够通过抑制缺氧/复灌所致的氧化应激而发挥细胞保护作用[13];并且儿茶素对大鼠脑缺血复灌也具有很好的保护作用[14]。EGC是儿茶素中的主要成分之一,这可以从侧面上佐证EGC对脑缺血的保护作用,与本研究的结果相对应。
综上所述,EGC对小鼠离体脑片及HT-22细胞OGD损伤具有明显的保护作用,其作用机制可能与提高组织SOD活力有关。但其更详细的作用机制,尚有待进一步深入研究。
