初探流体切应力在肝癌细胞迁移中的作用
2019-10-11刘子逸戴征伟王利娟闫志平徐彬
刘子逸 戴征伟 王利娟 闫志平 徐彬△
(1. 成都市第七中学高新校区,四川 成都 610041;2. 四川大学华西基础医学与法医学院,四川 成都 610041)
肿瘤细胞的迁移和侵袭受到肿瘤组织所处肿瘤微环境的影响[1]。肿瘤微环境包括肿瘤周围的组织、免疫细胞、血管、细胞外基质等多种成分[2,3]。力学微环境作为肿瘤微环境的重要组成部分,在调控肿瘤细胞的侵袭和转移中发挥重要作用[4]。由于肿瘤组织中血管发育不良、内皮层不完善,使肿瘤细胞直接暴露于流动的组织间液中[5]。研究表明,肿瘤细胞受到的流体切应力大约为0.01~0.2 Pa[6]。
上皮-间充质转化(Epithelial-mesenchymal transition,EMT)是一种广泛参与机体生理调节和病理性改变的重要机制[7]。肿瘤细胞发生EMT后,失去其上皮样特征,而获得间充质样表型。EMT使细胞发生形态学和极性改变,细胞骨架发生重排,进而提升了肿瘤细胞的迁移能力[8-9]。紧密连接常见于上皮细胞中,主要起到固定细胞,辅助细胞极性,以及防止小分子穿越细胞间隙的作用[10]。紧密连接相关蛋白包括Claudin-5、Occludin、ZO-1等,这类蛋白表达的降低,代表着肿瘤上皮表型的失去,以及细胞间通透性的升高[11]。
本研究以肝癌HepG2细胞为研究对象,在体外培养条件下,利用平行平板流动腔提供稳定层流切应力,对HepG2细胞施加1.4 dyn·(cm2)-1流体切应力作用,研究流体切应力对肝癌HepG2细胞迁移能力的影响。在此基础上,分析其细胞间紧密联接的变化以及上皮、间充质标志物的变化,初步探讨流体切应力诱导肝癌细胞迁移的分子机制。
1 材料与方法
1.1 材料与试剂
人肝癌细胞株HepG2购自中科院生物化学与细胞生物学研究所,由四川大学华西医学中心生物医学工程实验室保存;RPMI 1640细胞培养基、胎牛血清、胰蛋白酶购自Invitrogen公司;一抗(E-钙粘蛋白,N-钙粘蛋白)购自Sana Cruz公司;辣根过氧化物酶标记的羊抗兔/鼠二抗、FITC标记荧光二抗购自中杉金桥公司;细胞核染料DAPI购自赛默飞公司;显影液ECL plus购自碧云天公司。
1.2 细胞培养
HepG2细胞接种于含10%胎牛血清、链霉素(100 mg·(mL)-1)、青霉素(1×105U·L-1)的RPMI1640完全培养基中,并置于37℃恒温、5%CO2含量孵箱中,饱和湿度,静止条件下培养。待细胞长至80%~90%融合时,用0.25%胰酶消化后传代再培养,细胞接种密度为2×105个·(mL)-1,取对数生长期的细胞进行实验。
1.3 流体切应力加载实验
实验中的流体切应力由平行平板流动腔提供[12]。整个实验装置包括蠕动泵、储液瓶、橡胶管道及单层流动腔。蠕动泵为实验系统提供了稳定的定常流(Steady flow),灌流液体为无血清RPMI1640(37℃时,粘度为0.83 mPa·s-1)。将HepG2细胞接种于75 mm×25 mm的载玻片上,待细胞融合至90%后,将玻片置于平行平板流动腔,并通过蠕动泵控制培养基的流速。加载切应力时,整个流场温度保持37℃,缓冲体系可维持pH(7.2-7.4)。灌流系统的相关数据经前期计算并校正,实验选取流体切应力为1.4 dyn·(cm2)-1。实验分组按照切应力加载时间分为:静态培养的对照组、加力2 h组、4 h组、8 h组以及先力学加载再力学松弛的8 h+4 h组和8 h+8 h组(即加载力8 h后再分别静态培养4 h、8 h)。
1.4 划痕实验评估细胞迁移能力变化
对HepG2细胞加载1.4 dyn·(cm2)-1大小的流体切应力,分别作用2 h、4 h和8 h后,从平行平板流动腔取出玻片,行划痕实验,洗涤后置于培养皿中静态培养,取培养0 h、4 h、8 h、12 h和24 h各时间点观察细胞迁移情况,并与静态培养的对照组比较。
1.5 免疫荧光法观察细胞骨架F-actin变化
HepG2细胞不同组处理后,PBS漂洗2次·(5 min)-1,4%多聚甲醛固定,PBS漂洗3次·(5 min)-1孵育一抗(E-钙粘蛋白,N-钙粘蛋白),4℃过夜。PBS漂洗3次·(5 min)-1,孵育荧光二抗,37℃、0.5 h,PBS漂洗3遍·(5 min)-1,37℃孵育DAPI 15 min。最后加入荧光封片剂,制片。样品利用激光共聚焦显微镜(Leica TCS SP5,Germany)观察。
1.6 Western Blot测定相关蛋白表达变化
HepG2细胞不同组处理后,PIPA裂解液(含蛋白酶抑制剂,磷酸酶抑制剂和PMSF)裂解细胞,收集蛋白。BCA定量后,加入上样缓冲液,100℃变性8 min。经跑胶、转膜后,5%脱脂奶粉封闭2 h,孵育一抗;4℃过夜。TBST漂洗3遍,孵育二抗;TBST漂洗3遍,加入ECL显影液,凝胶成像系统观察结果。用Image J分析蛋白条带,用光密度比值代表蛋白的相对表达量。
1.7 透射电镜观察细胞间紧密连接的变化
PBS漂洗细胞,细胞刮子收集细胞入1.5 mL离心管中,用2000 r·(min)-1,离心15 min,弃上清。沿管壁缓慢加入0.5%戊二醛固定液,在4℃环境中静置10 min。12000 r·(min)-1,离心15 min,弃上清。再沿壁缓慢加入3%戊二醛固定液。制作好细胞样品,送至透射电镜实验室待检。选取5000×倍数下的三张TEM图片,计算细胞与细胞间紧密连接的距离。
1.8 统计学分析
2 结果
2.1 流体切应力对HepG2迁移的影响
对照组HepG2细胞迁移距离在8 h内无显著性差异,12 h后迁移距离与0 h、4 h、8 h比较有统计学差异(P<0.05)。切应力作用2 h组与对照组相比,4 h时间点的迁移距离与2 h时间点比较即出现显著的差异,时间越长,迁移距离远大。加力4 h组及8 h组与对照组相比,在2 h时间点即发生明显的迁移(P<0.05),时间越长,迁移距离远大。因此,流体切应力促进HepG2细胞迁移,迁移距离随着切应力加载时间的延长而增大,见图1。
2.2 流体切应力对HepG2细胞骨架F-actin的影响
流体切应力可诱导HepG2细胞骨架的重排,从而改变细胞形态,并促进了细胞的迁移。通过对F-actin染色发现(图2),对照组肝癌细胞呈现不规则的多边形,细胞骨架未见明显的丝状结构。切应力加载后,细胞铺展拉伸,呈长梭形,面积增加,并且在流体切应力方向上形成明显的应力纤维。撤销切应力4 h及8 h后,细胞应力纤维逐渐消失,但F-actin的排列仍保持规整。以上结果表明,流体切应力诱导HepG2骨架重排,有利于肝癌细胞的迁移。
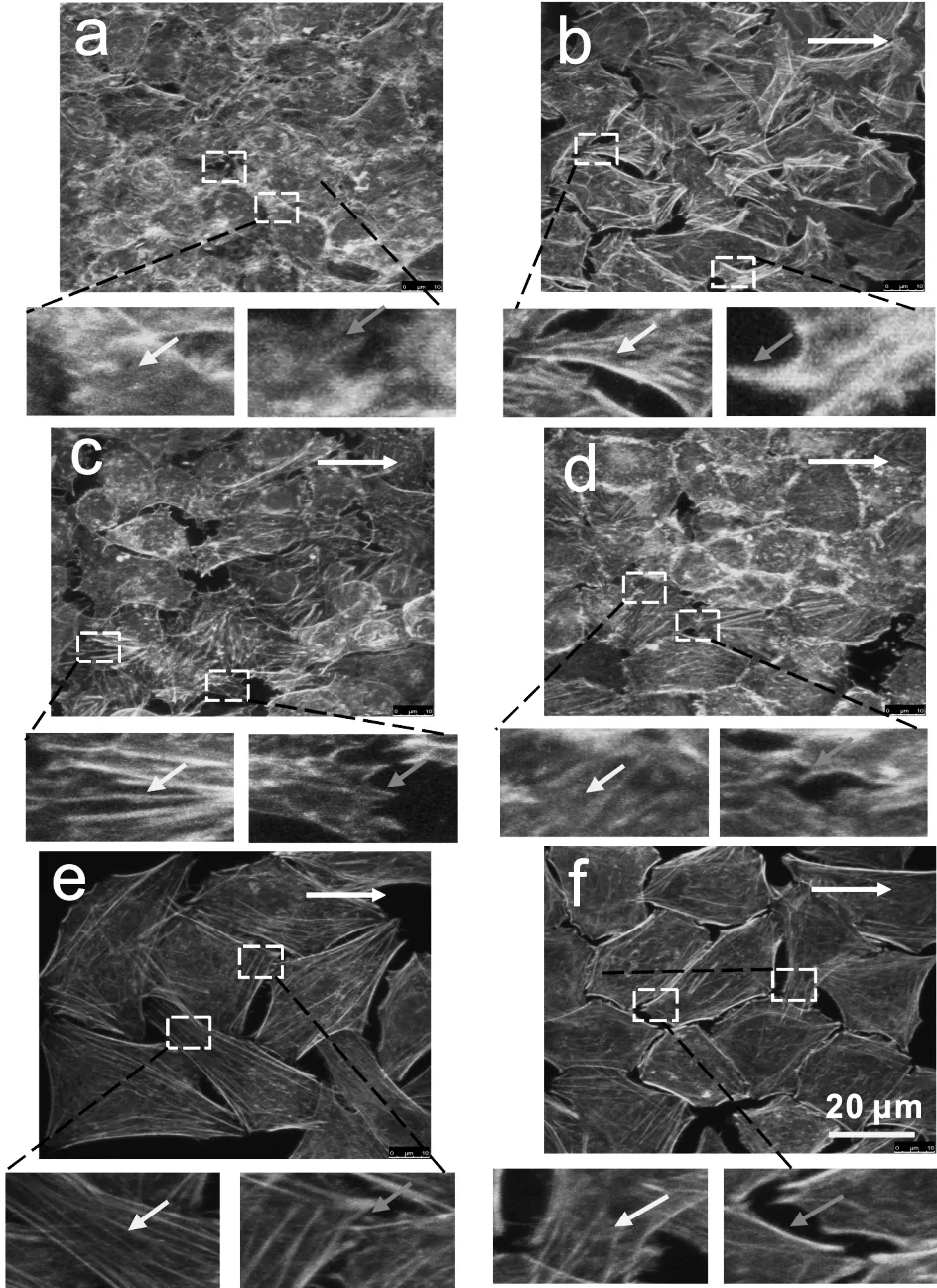
图2 流体切应力对HepG2细胞骨架F-actin的影响注:a:静态对照组;b:2 h组;c:4 h组;d:8 h组;e:8h+4h组;f:8 h+8 h组图中黄色和红色箭头分别表示细胞边缘板状伪足和丝状伪足,白色箭头代表流动方向(绿色:细胞骨架;蓝色:细胞核)。
2.3 流体切应力对HepG2细胞上皮-间充质转化关键蛋白表达的影响
上皮细胞的分子标志物表达下调与间质细胞的分子标志物表达上调是细胞发生EMT最显著的标志。图3描述了HepG2细胞加载流体切应力后,E-Cadherin和N-Cadherin表达的时序性变化规律。
从图3a可见,静态培养组E-Cadherin以及N-Cadherin主要分布在细胞膜周围,随着切应力加载时间的增加,E-Cadherin的表达强度呈降低的趋势,而N-Cadherin的表达强度呈升高趋势;加载流体切应力8 h后,对细胞静态培养即力学松弛4 h以及8 h后观察可见,E-Cadherin的表达强度有所恢复而N-Cadherin表达强度有所降低。
由图3b可以看出,上皮标志物E-Cadherin在切应力作用2 h后表达下调至较低水平,并维持这种低水平至8 h,撤销切应力后其表达水平显著升高。但是,力学松弛8 h后其表达水平仍然显著高于静态培养组(P<0.05)。间充质标志物N-Cadherin在力学刺激2 h内其表达水平无明显变化,随着加力时间的延长其表达逐渐升高,到8 h时表达达到峰值,且与对照比较具有显著性差异(P<0.05)。Vimentin在力学刺激2 h显著上调,随着切应力加载保持高水平表达,撤销切应力后Vimentin的表达变化不明显,这与图2免疫荧光结果基本一致,即切应力使骨架重排后。撤销力学加载4 h和8 h,细胞骨架结构依然保持规整的状态。此外,间充质标志物Twist和Snail的表达规律基本一致,均在2 h内表达升高,8 h达到峰值,撤销切应力后其表达逐渐降低并且低于对照组水平(P<0.05)。Western blot与免疫荧光结果的实验结果基本一致,说明流体切应力能够影响E-Cadherin以及N-Cadherin的表达,诱导肝癌细胞发生EMT,但EMT相关关键蛋白的表达存在时序差异性。
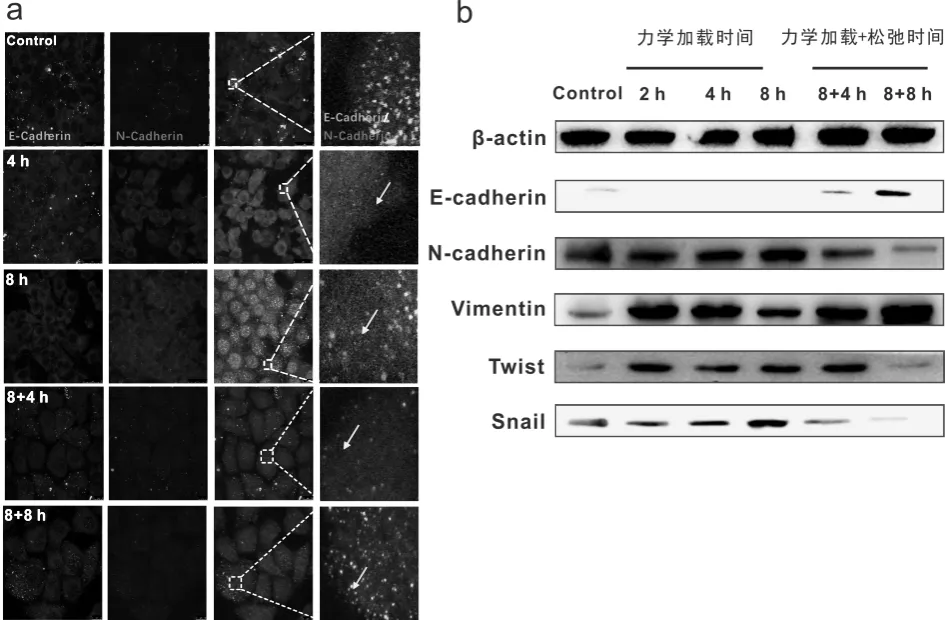
图3 流体切应力对HepG2细胞上皮-间充质转化关键蛋白表达的影响注:a:免疫荧光双染分析切应力作用后,N-cadherin(红色)及E-cadherin(绿色)分布的变化;蓝色为细胞核,黄色箭头所指为局部放大图中观察到的E-cadherin/N-cadherin荧光的分布和表达;b:切应力作用后,EMT标志蛋白表达水平的变化。
2.4 流体切应力对肝癌HepG2细胞间紧密连结的影响
图4为1.4 dyn·(cm2)-1流体切应力作用不同时间对HepG2细胞间紧密连结的影响。由图可知,对照组细胞间连接(黑色箭头)完整,平均宽度约20±1.0 nm。加载切应力2 h后,细胞间的紧密连接出现破坏,细胞间连接不再完整,平均宽度增至28±6.5 nm。加载切应力4 h后,细胞间出现了更为明显的空隙,细胞连接不完整,其平均宽度增加为135±13 nm,与对照组相比有明显的差异(P<0.05)。加载切应力8 h后,细胞间的空隙进一步增大。撤销切应力,细胞静态培养4 h后观察细胞间连接有所恢复,空隙明显小于加力8 h后的空隙宽度,平均宽度为232.5±13.5 nm。撤销切应力,细胞静态培养8 h后,细胞间连接宽度继续减小,其平均宽度为128±15 nm。因此,流体切应力诱导肝癌细胞紧密连接破坏,提高了连接空隙宽度,从而增大了肝癌细胞通透性,有利于细胞迁移。
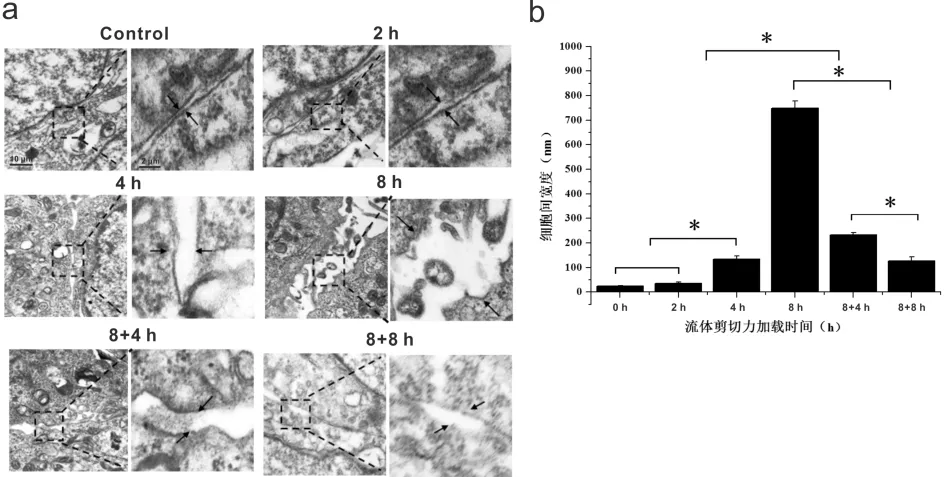
图4 流体切应力对肝癌HepG2细胞紧密连接的影响注:a:流体切应力作用对细胞紧密连接形态的影响(左图5000×,右图20000×);b:流体切应力作用对细胞间紧密连接平均宽度的影响,*P<0.05表示差异有统计学意义。
3 讨论
肿瘤的侵袭与转移是造成癌症患者治疗失败和高死亡率的主要原因。肿瘤的转移是一个多步骤的过程,而EMT是肿瘤细胞脱离原发灶,进行局部浸润或者沿血道和淋巴道转移的先决条件[13]。在EMT发生过程中,肿瘤细胞失去上皮细胞的表型,如粘附分子的失去等,失去了与基底膜或其他细胞的连接,致使细胞去极化,细胞骨架重排[8],从而获得较高的迁移和侵袭能力,同时抗凋亡能力和降解细胞外基质的能力也同步增强[14]。
在当今肿瘤的研究领域,绝大多数研究关注于肿瘤微环境中的生物学因素和化学因素。而在肿瘤的发生发展过程中,肿瘤微环境的力学因素,包括流体切应力,基质硬度等均发生了较大的变化[15],力学因素影响着肿瘤的发生和发展,而这一方面研究较少。我们利用蠕动泵和平板流动腔,在体外培养条件下,给予肝癌细胞HepG2流体切应力的刺激,研究切应力对肝癌细胞EMT和迁移的影响。我们的结果表明,切应力上调肝癌细胞间充质标志物,下调上皮标志物,诱导肝癌细胞EMT;切应力作用下,肝癌细胞胞间紧密连接的距离增加,肝癌细胞通透性增加;同时,切应力促进肝癌细胞迁移。我们的研究结果从细胞和分子层面证明,流体切应力是诱导肝癌细胞EMT和迁移的重要物理学因素,值的一提的是,有研究表明,肝癌组织内的细胞感受到比正常肝组织更大的流体切应力[5],提示我们,在肝癌原发灶转移的过程中,物理学因素,尤其是流体切应力的作用不可忽略。
因此,流体切应力诱导肝癌细胞EMT,提高肝癌细胞通透性,进而促进肝癌细胞迁移。本文初步研究了流体切应力诱导肝癌细胞迁移的分子机制,将有助加深人们于对肿瘤转移的力学生物学机制的认识。
