艾塞那肽微球在食蟹猴体内的免疫原性及药代动力学比较研究*
2019-10-11李洪贞夏艳单佳妮季杰
李洪贞 夏艳 单佳妮 季杰
(1. 北京昭衍新药研究中心股份有限公司,生物制品安全性评价北京市重点实验室,北京 100176;2. 昭衍(苏州)新药研究中心有限公司,江苏 苏州 215421)
糖尿病是由多种病因所致的以慢性高血糖为特征的一类代谢性疾病,多因胰岛素分泌缺陷或胰岛素抵抗所致。随着生活生平的不断提高,肥胖率增加,糖尿病在全球范围内的发病率持续增高[1,2],且发病年龄有降低趋势。其中2型糖尿病占糖尿病患病人数的90%以上,尽管患者体内产生胰岛素的能力并非完全丧失,有的患者体内胰岛素甚至产生过多,但胰岛素的作用效果较差,因此患者体内的胰岛素处于相对缺乏状态。
胰高血糖素样肽-1(Glucagon-like peptide-1, GLP-1)是由肠道分泌的一种肠促胰素[3],具有葡萄糖依赖性促进胰岛素分泌的能力,可通过多种机制有效降低2型糖尿病患者的血糖水平,同时亦可减轻患者体重、改善α和β细胞功能。GLP-1受体激动剂可通过与GLP-1受体结合,产生GLP-1受体激动后效应,与传统口服降糖药物相比,作用更为全面[4]。
艾塞那肽(Byetta,百泌达)是最早上市的GLP-1受体激动剂,于2009年经中国CFDA批准上市。该药适用于二甲双胍基础上加用磺脲类和(或)噻唑烷二酮类药物控制血糖仍不满意的2型糖尿病患者,于每日早餐和晚餐前60 min内皮下注射。由于其半衰期短,需要每日2次注射。2012年1月,美国食品和药品监督管理局批准了艾塞那肽注射液每周一次缓释剂型的上市申请,这是2型糖尿病治疗中首个每周使用一次的治疗药物,给药时间的延长使得患者用药更为方便,大大提高了患者的依从性[5]。
艾塞那肽缓释制剂是将艾塞那肽分子分散到微球当中,通过皮下注射的方式进入体内后,微球粒子通过自发的水解作用,将有效成分缓慢吸收到体内循环当中。这一特点更有利药物浓度长时间维持在有效的血药浓度之上,更好的发挥药理作用[6,7]。本实验拟考察注射用艾塞那肽微球单次皮下注射给予食蟹猴的免疫原性及药代特征,并与已上市药物Bydureon比较,为后续研究提供参考。
1 材料与方法
1.1 实验药品
受试物:注射用艾塞那肽微球,某药厂提供,批号130205,白色至类白色粉末,2mg/支,2-8℃保存,有效期暂定至2014年2月。
市售品:注射用艾塞那肽微球(Bydureon),Amylin生产,批号73177,白色至类白色粉末,2 mg/支,2-8℃保存,有效期至2014年4月。
1.2 主要试剂及试剂盒
艾塞那肽标准品:由某药厂提供,批号121204,白色至类白色粉末,50 mg/支,艾塞那肽含量99.2%,-20℃以下保存,有效期暂定至2014年12月;Exendin-4检测试剂盒(FEK-070-94)购于Phoenix Pharmaceuticals(美国);抑肽酶(11583794001)购于Roche(美国);HRP标记兔抗猴IgG抗体(A2054)购于Sigma(美国);牛白蛋白(69003433)购于国药集团化学试剂有限公司;TMB显色底物(C09-555214)购于BD(美国)。
1.3 主要仪器
高速冷冻离心机(5810R)由Eppendorf生产,多功能酶标仪(Spectra Max M5)由Molecular Device生产,洗板机(ELx405 Select CW)由Biotek生产。
1.4 动物
普通级食蟹猴(购于广西南宁市富泽野生动物养殖有限公司)16只,雌雄各半,体重范围2.89~3.67 kg。动物群养于普通级动物房的不锈钢笼内,每笼每性别不超过4只。每日上午和下午各喂食一次猴饲料,平均每只动物每次喂饲料约100 g左右,并辅喂水果或蔬菜50 g左右;动物自由饮水,饮用符合国家城市生活饮用水卫生标准的自来水。
本实验的动物使用方法经昭衍(苏州)新药研究中心有限公司动物管理与使用委员会(IACUC)批准。IACUC批准编号为:ACU18-304。
1.5 方法
所有动物按性别随机分成受试物组和市售品组,每组雌雄各4只。每瓶受试物/市售品冻干粉加入一瓶注射用艾塞那肽微球专用溶剂混匀,艾塞那肽浓度3.08 mg·mL-1,分别皮下注射给予动物0.14 mL·kg-1,给药剂量0.44 mg·kg-1。
所有动物于给药前、给药后2、4、6、8、10 w,上肢或下肢静脉采集全血约1.0 mL。分离血浆,采用ELISA法检测特异性抗艾塞那肽IgG抗体,检测方法:艾塞那肽标准品用碳酸盐缓冲液稀释至1 μg·mL-1包被至微孔板上,3%的BSA封闭后加入5倍梯度稀释的血浆样本,洗板后加入HRP标记兔抗猴IgG,加入TMB显色底物,加入H2SO4终止后在450 nm处测定吸光度,以药前值为对照,高于药前值的1.5倍为抗体阳性。
各动物于给药前(0 h)、给药后0.5、1、3、6、12 h,1、2、3、5、7、10、14、17、21、24、28、31、35、38、42、45、49、52、56、63、70 d上或下肢静脉采集全血约0.5 mL,放入预加5 μL肝素钠(6250 IU·mL-1)和6 μL抑肽酶(50 TIU·mL-1)的离心管中(取血前,含有肝素钠和抑肽酶的离心管于2~8℃或冰浴保存),混匀分离血浆,离心条件为:1000 g,4℃,10 min,采用商品化的化学发光免疫试剂盒测定血浆中艾塞那肽浓度。
1.6 数据分析
采用WinNonlin(V6.2)软件的非房室模型法(NCA)对代谢动力学参数进行计算,主要包括AUC、Cmax、Tmax等参数。利用Microsoft Office Excel计算均值,标准差,变异系数。
2 结果
2.1 抗艾塞那肽抗体
抗艾塞那肽抗体检测结果显示,给药后2 w,受试物组一只雄性动物产生抗药抗体(滴度1:25),给药后4 w受试物、市售品分别有4只、3只动物检出抗药抗体,至给药后70 d(10 w)两组各有7只动物检出抗药抗体,其中两组动物分别有1只、2只动物抗体滴度超过1:125,其他抗体阳性动物的滴度介于1:5-1:125。表明单次皮下注射给予食蟹猴,受试物与市售品有相似的免疫原性,见表1。
2.2 血浆艾塞那肽浓度
给药后受试物组及市售品组各动物平均血浆药物-时间变化见图1、图2。
结果显示,受试物皮下注射给予食蟹猴后,在给药后的前6 h有一个初始释放,此后药物低浓度释放,药物的主要释放在给药后约10 d开始,并在第28 d左右达峰,持续至约42 d,至给药后70 d,仍有5只动物血浆中可以检测到药物的存在。
市售品皮下注射给予食蟹猴后,在给药后的前6个小时有一个初始释放,此后药物低浓度释放,药物的主要释放在给药后约10 d开始,并在第28 d左右达峰,持续至约45 d,至给药后70 d,仍有7只动物血浆中可以检测到药物的存在。

表1 给药后各动物抗艾塞那肽抗体产生情况
备注:“-”表示抗体测定结果阴性。

图1 给药后受试物组动物血浆药物浓度-时间变化

图2 给药后市售品组动物血浆药物浓度-时间变化
结合各动物抗体的产生情况,除受微球中艾塞那肽的释放外,血浆药物浓度及系统暴露量与抗艾塞那肽抗体的水平相关,较高滴度的抗体延缓药物的清除。给药后4 w供试品组12号动物抗药抗体滴度为1:625,给药后6 w升至1:3125。给药后6w,对照品组15号动物抗体滴度1:625,给药后8 w,13号动物抗体滴度为1:625,以上三只动物血药浓度均受到明显影响,高于同时间点其他动物;其余各组动物抗药抗体滴度均≤1:125,除对照组14号动物外,均对血药浓度影响不明显,所以采用抗药抗体滴度≤1:125为划分标准(不包括14号动物),进行比较分析,结果见图3。
结果显示,受试物及市售品单次皮下注射给予食蟹猴后,两组动物血浆药物浓度相当,且随时间变化趋势一致。

图3 给药后各组动物平均血浆药物浓度-时间变化注:所有动物n=8;受试物组部分动物n=7;市售品组部分动物n=5。
2.3 代谢动力学参数
给药后受试物、市售品组各动物体内代谢动力学参数见表2、表3。
结果表明,受试物、市售品单次皮下注射给予食蟹猴(0.44 mg·kg-1)后各组雌雄动物药代动力学参数无显著差异(P>0.05),受试物与市售品间各药代参数无显著差异(P>0.05),微球药物释放及药代特征均一致。
2 讨论
艾塞那肽是胰高血糖样肽-1(GLP-1)的类似物,具有与GLP-1几乎相同的生物学活性,但稳定性远高于GLP-1。艾塞那肽不仅能够促进胰岛素合成和分泌,还能促进胰岛细胞中胰岛素基因转录以及增加靶组织对胰岛素敏感性,但其促胰岛素分泌作用依赖于高血糖浓度,血糖浓度较低时就不会增加胰岛素分泌,从而避免低血糖发生。本实验选用正常动物进行试验,动物血糖水平较低,不足以使艾塞那肽促进胰岛素的分泌,因此本实验未观察动物血糖水平变化。
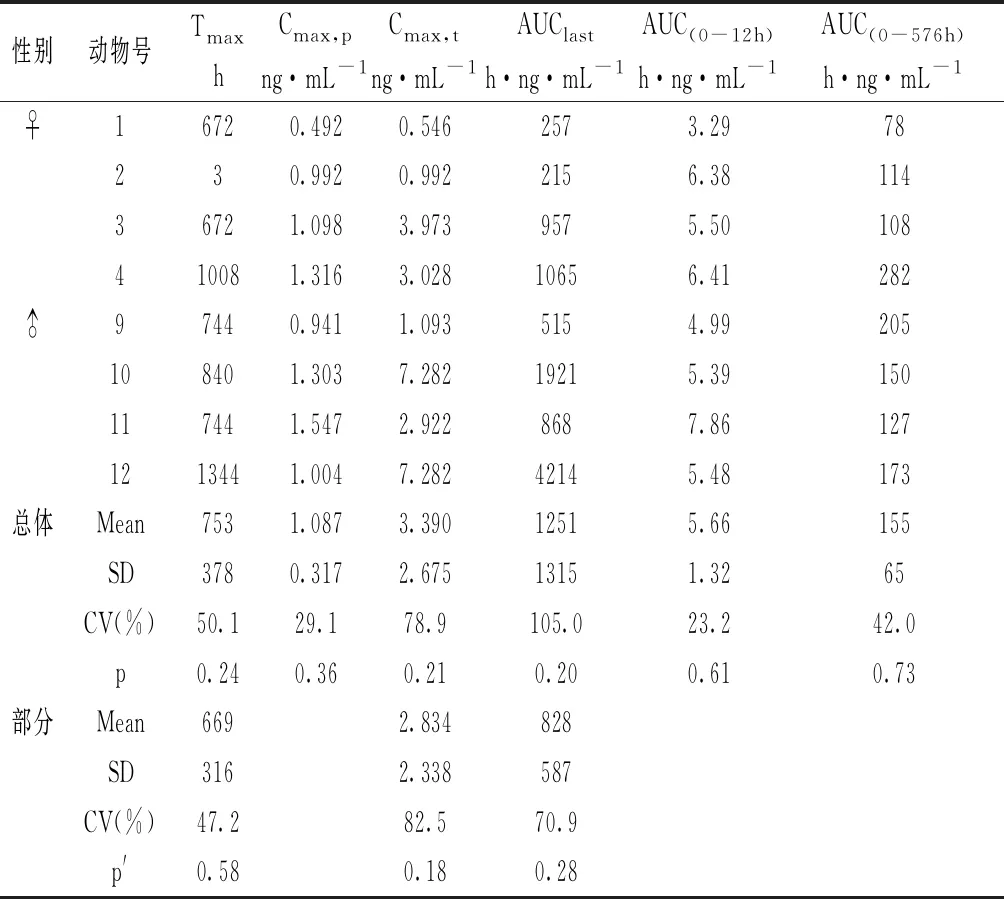
表2 受试物单次皮下注射给予食蟹猴后药代参数计算
注:Cmax,p表示给药后至24 h血浆药物峰浓度,Cmax,t表示至给药后70天血浆药物峰浓度;p表示不同性别间比较,p′表示与市售品组比较(所有动物),student t test;“总体”表示包含该组所有动物,“部分”表示不包含12号动物。

表3 市售品单次皮下注射给予食蟹猴后药代参数计算
注:Cmax,p表示给药后至24 h血浆药物峰浓度,Cmax,t表示至给药后70天血浆药物峰浓度;p表示不同性别间比较,student t test;“总体”表示包含该组所有动物,“部分”表示不包含13、14、15号动物。
对照品的临床前研究资料[8]表明,单次皮下注射给药后两周,食蟹猴产生抗药抗体,抗体不具有中和性,当抗体滴度高于1:125时,艾塞那肽的体内消除减慢,血浆暴露量增加,抗体滴度低于1:125时,除个别动物外,艾塞那肽的暴露量变化不明显。
本实验中,供试品和对照品组动物从给药后2 w开始出现抗药抗体,给药后4w供试品组12号动物抗药抗体滴度为1:625,给药后6w升至1:3125;给药后6w,对照品组15号动物抗体滴度1:625,给药后8w,13号动物抗体滴度为1:625,以上三只动物血药浓度均受到明显影响,其余各组动物抗药抗体滴度均≤1:125,除对照组14号动物外,均对血药浓度影响不明显,本试验采用抗药抗体滴度≤1:125为划分标准(不包括14号动物)对结果进行分析。
试验中,供试品组和市售对照品Bydureon在血药浓度变化趋势、AUC、Cmax及Tmax等方面均无显著差异。但是,本试验中动物暴露量(AUC、Cmax)相关参数与Bydureon在FDA综述资料中公布的同等剂量对应参数有一定差异。由于本品血药浓度受抗体滴度影响明显,Bydureon药代试验使用动物较少,且个体差异大,抗体滴度范围为1:5-1:3125,故而推测不同试验之间的差异可能与本品的免疫原性相关。
另外,Bydureon和Byetta(百泌达)临床研究中均发现抗艾塞那肽抗体的产生对血浆中艾塞那肽暴露量有一定影响,且不同的抗体滴度对艾塞那肽暴露量的影响不同。本试验中供试品和Bydureon对照品给予食蟹猴后也发现了抗药抗体存在,提示临床研究中应关注本产品的免疫原性指标。
