酶促制备EPA/DHA磷脂的研究进展
2019-10-10孙兆敏蔡胜利
孙兆敏,蔡胜利
(威海博宇食品有限公司,山东 威海 264205)
以二十碳五烯酸(C20:5n-3,EPA)和二十二碳六烯酸(C22:6n-3,DHA)为代表的海洋n-3多不饱和脂肪酸已被证实具有多种对人体有益的生理功能。
目前常见的EPA和DHA产品主要是鱼油和微藻油,其化学形式多为甘油酯或乙酯,其中甘油酯是EPA和DHA的天然存在形式之一,但两种脂肪酸的总含量较低,乙酯产品是直接或间接以甘油酯型EPA和DHA为原料经酯交换反应制得的,可进一步通过分子蒸馏、尿素包合等技术手段大幅提高其EPA和DHA的含量,但乙酯型EPA/DHA在人体内的利用效率低,且存在一定的安全隐患。
近年来,磷脂型EPA/DHA(即EPA/DHA-磷脂,EPA/DHA-PL)因其在氧化稳定性[1]、生物利用效率和营养功能等[2]方面的优势越来越受到关注。EPA/DHA-PL天然存在于海洋动物(如磷虾、软体动物、鱼类等)和哺乳动物体内,而国内外以南极磷虾、海鱼卵等为原料提取EPA/DHA-PL的技术已经实现产业化。受限于海洋原料来源稳定性、海洋过敏原以及重金属、农药污染等因素,国内外研究者在深入开发更安全、更高效和更低消耗的提取技术的同时,也将目光投向了EPA/DHA-PL的酶促制备技术。
根据反应类型的不同,EPA/DHA-PL酶促制备方法主要包括酯交换法、酯合成法和水解法,其中酯交换法可进一步细分为酸解法、醇解法和酯-酯交换法。而根据制备策略的不同,又可分为酰基替换法(包括酸解法和酯-酯交换法)、酰基结合法(主要是酯合成法)和酰基脱除法(包括水解法和小分子醇参与的醇解法)。本文中,笔者将根据制备策略的不同,对近年来酶促制备EPA/DHA-PL的研究进展进行综述,以期为相关的研究人员提供借鉴。
1 酰基替换法
1.1 酰基替换法概述
酰基替换法是以大豆磷脂和蛋黄磷脂等几乎不含EPA/DHA的磷脂为主要原料,通过酶促酸解或酯-酯交换反应,将磷脂中的其他脂肪酸替换为EPA/DHA的方法(图1)。酰基替换法可选用的酶制剂种类多,反应底物易于混溶且对酶活力影响较小,是酶促制备EPA/DHA-PL的主要技术手段。早在1986年,Yoshimoto等[3]就开发了通过酸解反应制备EPA磷脂的技术。在国内,张苓花等[4]和王永华等[5]较早地开展了酰基替换法制备EPA/DHA-PL的研究。目前,评价酰基替换法效率的主要指标是EPA/DHA与磷脂的结合率以及最终产物得率,前者通常由反应一段时间内磷脂原料中EPA/DHA增加量来体现,后者主要受副反应(主要是水解反应)和产物提取方法的影响。
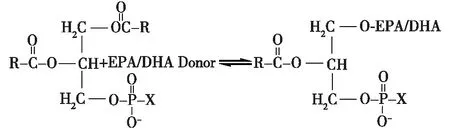
图1 酰基替换法制备EPA/DHA-PLFig.1 Preparation of EPA/DHA-PL by acyl-replacement method
1.2 酶源及特点
以脂肪酶、磷脂酶A1和磷脂酶A2为催化剂制备EPA/DHA-PL的研究均有报道,在绝大部分研究中,酶制剂的筛选通常作为制备EPA/DHA-PL的第一步。Mutua等[6]通过正己烷体系中磷脂酰胆碱与EPA的酸解反应,比较了磷脂酶A2、磷脂酶A1和7种脂肪酶的催化效果,发现未经固定化的毛霉(Mucormiehei)脂肪酶和磷脂酶A2催化的反应中EPA结合率较高。而Marsaoui等[7]则从来源于南极假丝酵母(Candidaantarctica)、荧光假单胞菌(Pseudomonasfluorescens)、洋葱伯克霍尔德菌(Burkholderiacepacia)、毛霉、疏棉状嗜热丝孢菌(Thermomyceslanuginosus)和米黑根毛霉(Rhizomucormiehei)的6种脂肪酶中筛选出固定化米黑根毛霉脂肪酶(Lipozyme RM IM)用于催化正己烷体系中大豆磷脂与EPA/DHA乙酯的反应。
除了来源微生物的不同,同一种微生物产生的不同脂肪酶在催化磷脂酸解反应过程中也可能会获得截然不同的结果,如Chojnacka等[8]选用的7种脂肪酶中,只有来源南极假丝酵母的脂肪酶B(CalB)可将蛋黄磷脂中的EPA和DHA含量提高到10%以上,而南极假丝酵母脂肪酶A(CalA)则几乎无法催化蛋黄磷脂与EPA/DHA的酸解反应。通常认为,CalA是较少见的对甘油三酯sn-2位具有催化偏好性的脂肪酶,而CalB则不具有催化位点的偏好性。通过对磷脂产物的进一步分析,Chojnacka等[8]发现产物中DHA主要结合在磷脂甘油骨架的sn-1位上,这说明CalB在磷脂的酸解反应过程中表现出了sn-1位点的偏好性。类似地,褶皱假丝酵母(Candidarugosa)脂肪酶也通常不具有甘油三酯位点的偏好性,但在大豆磷脂和EPA/DHA乙酯的反应过程中却表现出了sn-2位点的偏好性[9]。另外,柱状假丝酵母(Candidacylindracea,又称褶皱假丝酵母)脂肪酶[9-10]、米黑根毛霉脂肪酶[11-12]和疏棉状嗜热丝孢菌脂肪酶[13]等更易于催化EPA与磷脂的结合,而相对于EPA,Novozym 435则更倾向于催化DHA参与的反应,表现出对DHA的偏好性,且该偏好性不随反应溶剂的不同而改变[8]。
Novozym 435是一种将CalB吸附在大孔丙烯酸树脂上而制成的固定化脂肪酶,潘丽等[14]以其为工具酶催化大豆粉末磷脂的酸解反应,得到EPA和DHA含量为21.56%的磷脂,经进一步优化反应条件,将磷脂中EPA和DHA总量提高到24.32%[15]。
磷脂酶A1和A2分别对磷脂甘油骨架上sn-1、sn-2位的脂肪酸具有专一性,也是酰基替换法制备EPA/DHA-PL的常用酶制剂。Kim等[16]用液体磷脂酶A1—— Lectitase ultra催化磷脂酰胆碱的酸解反应制备EPA/DHA-PL,反应24 h时,EPA/DHA与磷脂的结合率达到28%,其后该研究团队将磷脂酶A1固定化并优化反应条件,使结合率得以进一步提高[17]。另外国内的研究者也先后以固定化磷脂酶A1为催化剂对酰基替换法制备EPA/DHA-PL进行了研究[18-22]。普通磷脂可通过酰基替换法成为EPA/DHA-PL,实现“从无到有”的过程,一些本身富含EPA/DHA的磷脂,如南极磷虾磷脂,也可以通过该方法进一步提高其EPA/DHA的含量,达到“从有到多”的效果。Xi等[22]从南极磷虾中提取的磷脂中EPA和DHA的含量分别为23.2%和14.8%,且EPA和DHA主要位于磷脂的sn-2位上,通过磷脂酶A1的作用将sn-1位上的其他脂肪酸替换为EPA/DHA,可获得EPA和DHA的含量分别为24.7%和59.0%的磷脂产品。
根据磷酸基团连接的取代基团不同,磷脂可分为磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇和磷脂酰丝氨酸等。相对于其他种类的磷脂,磷脂酰胆碱更易于通过酸解反应与EPA/DHA结合[6,10,13,23]。而根据EPA/DHA供体化学形式的不同,酰基替换法分为酸解反应(磷脂与游离型EPA/DHA的反应)和酯-酯交换反应(磷脂与乙酯或甘油三酯型EPA/DHA等的反应),Yamamoto等[9]以褶皱假丝酵母脂肪酶为催化剂,考察了3种不同形式的EPA/DHA供体参与的酯交换反应,结果发现甘油三酯和游离脂肪酸参与的反应具有更高的结合率。但Haraldsson等[12]研究发现,采用游离脂肪酸和乙酯作为的EPA/DHA供体形式最终反应结合率相差不大,但酯-酯交换反应过程中的水解副反应却比酸解反应过程的剧烈,可能的原因是游离型EPA/DHA在一定程度上抑制了水解反应的发生。由于高含量EPA/DHA乙酯的制备工艺相对简单,且氧化稳定性较强,近年来有相当数量的研究通过酯-酯交换反应制备EPA/DHA-PL[7,9,20-21,24]。
1.3 酶促反应的溶剂体系
酰基替换法制备EPA/DHA-PL通常在非水反应体系尤其是无溶剂体系和有机溶剂体系中进行。
低极性的正己烷可较好地溶解磷脂和EPA/DHA供体,且能够维持较高的脂肪酶活力,因此常用于EPA/DHA-PL的制备[6-8,25-26],Chojnacka等[8]比较了不同有机溶剂对酸解反应结果的影响,发现采用正己烷获得的EPA/DHA结合率最高(24%)、正庚烷次之(18%)、甲苯最低(12.3%),而对磷脂酶A2催化的酯-酯交换反应来说,甲苯则是比正己烷或正庚烷更适宜的溶剂[27]。
无溶剂体系不使用易燃易爆且具有一定毒性的溶剂,避免了有机溶剂的“稀释”作用,反应底物和酶的平均浓度高、反应初速度快、产物分离步骤简单,可能是制备EPA/DHA-PL的更好选择。但无论是有机溶剂体系还是无溶剂体系,反应时间通常在24 h以上,为了缩短反应时间,可以向有机溶剂体系施加超声作用[28]或采用超(亚)临界流体反应体系,该流体黏度小、扩散性能好,且能在一定程度上提高酶活力[29],从而可以加快反应速度,缩短反应时间,如Xi等[22]发现,超临界CO2体系中南极磷虾磷脂经过7 h的酸解反应,就能得到较高DHA结合率。而于刚等[30]采用的亚临界R134a反应体系中,大豆磷脂仅经过1 h的酸解反应即可获得EPA和DHA的量分别为12.23%和39.83%的磷脂。
非水反应体系并非严格无水,且适量的水对保持酶活力至关重要。Li等[21]在无溶剂体系通过磷脂酶A1催化的酯-酯交换反应,比较了反应温度、水分添加量、底物质量比对结合率的影响,发现水的添加量是影响结合率的最显著因素,只有水分添加量超过0.5%才具有较高的结合率。但反应体系中含水量过高会加剧磷脂的水解[27],导致最终产物得率降低。Totani等[10]用柱状假丝酵母脂肪酶在正己烷体系催化大豆磷脂和沙丁鱼油(含11.2%EPA和9.8%DHA)的酯交换反应,所得反应产物中EPA和DHA的量分别为14.5%和3.1%;由于反应体系中含有大量的水,EPA/DHA-PL的得率较低,虽然用甘油替代反应体系中的水可将产物得率由17.0%提高到46.8%,但产物中EPA的量也随之降低至11.2%;若采用丙二醇和水的混合物替代反应体系中的水[25],可在保证结合率无明显降低的同时显著提高产物得率。即使不额外向反应体系中加入水,由于底物和酶制剂本身含有一定量的水分[9,21],EPA/DHA-PL的酶促制备过程中水解反应也是难以避免的,有研究者甚至认为水解反应可能是酸解反应过程中必不可少的中间步骤[12,23]。Haraldsson等[12]认为,在1,2-二棕榈酸磷脂酰胆碱和EPA的酸解反应初期,磷脂水解产生大量的sn-2-溶血磷脂(sn-2-LPC),一部分sn-2-LPC可与EPA/DHA反应生成EPA/DHA-PL,也有一部分sn-2-LPC会因分子内酰基迁移作用使得位于sn-2位上的脂肪酸缓慢转移到sn-1位上,从而形成sn-1-溶血磷脂(sn-1-LPC),由于sn-1-LPC的热力学稳定性强于sn-2-LPC,在长时间的反应过程中,sn-1-LPC不断得到积累,并先后生成不含脂肪酸的甘油磷酰胆碱、sn-1-EPA-溶血磷脂、sn-2-EPA-溶血磷脂和含有2个EPA的磷脂等产物。该过程提示:虽然采取一定措施脱除体系中的水分也是提高产物得率的有效方法,但选择合适的脱水时机至关重要——在反应初期脱水,虽然可以提高产物得率,但会抑制磷脂水解,明显降低EPA/DHA与磷脂的结合率[16],如果在反应24 h后脱水,不仅可以获得较高的产物得率,也可明显提高结合率[21]。
1.4 其他影响因素
除了上述因素,一些反应条件如反应温度、底物(EPA/DHA供体和磷脂)的比例和酶量等也会对酰基替换法的反应结果产生明显的影响。
酰基替换法制备EPA/DHA-PL的适宜温度通常为45~60 ℃,在一定的范围内,提高反应温度可增强酶活力并降低反应体系黏度,从而有助于结合率的提高。如Li等[20]将反应温度从40 ℃提高到55 ℃,可将EPA和DHA的结合率从13.4%提高到27.8%。而提高底物中EPA/DHA的比例可增强溶血磷脂的分子内酰基迁移作用并促进溶血磷脂与EPA/DHA的酯化反应,在一定程度上有助于结合率的提高,但同时也会抑制酸解反应过程中磷脂水解的进行,且过高的底物比例不利于产物的分离纯化,所以提高底物比例对酰基替换法(尤其是酸解反应)效率影响的结论并不一致[11-12,23]。
另外,酸解反应中EPA/DHA的结合率高低依赖于酶量的大小[12],充足的酶量可以保证在磷脂水解的同时催化EPA/DHA与溶血磷脂的酯化反应,酶量不足则会使酯化反应受限,从而不利于结合率的提高[11]。
还有一些物质,如含氨基的化合物和二价阳离子可通过提高脂肪酶的活力来提高反应结合率[7,31]。Marsaoui等[24]以固定化米黑根毛霉脂肪酶为催化剂,在正己烷体系中通过酯-酯交换反应制备EPA/DHA-PL,反应24 h和48 h的结合率分别为5.6%和12.1%,但反应体系中加入尿素和Mg2+之后可将结合率分别提高到17.7%和50.0%。
2 酰基结合法
酰基结合法主要是以溶血型磷脂和EPA/DHA为底物,经酯合成反应得到富含EPA/DHA的磷脂,该法最常使用的催化剂为磷脂酶A2(图2)。

图2 酰基结合法制备EPA/DHA-PLFig.2 Preparation of EPA/DHA-PL by acyl-conjunction method
An等[32]最早采用该方法尝试制备富含EPA/DHA的磷脂酰胆碱,首先通过猪胰磷脂酶A2水解磷脂获得溶血磷脂酰胆碱,之后采用相同的酶制剂在微乳反应体系催化溶血磷脂酰胆碱和EPA/DHA的酯合成反应,最终产物得率约为6%。为了提高产品得率,Lilja-Hallberg等[33-34]尝试在有机溶剂体系(将溶血磷脂和EPA/DHA混合后加入少量异辛烷)中进行磷脂的合成,通过提高底物中EPA/DHA的比例、降低反应体系中的水分含量并延长反应时间(80 h和9 d),将产品得率提高到21%以上。之后Härröd等[35]用高压反应器改善底物与固定化酶的接触条件,将反应时间缩短到20 h的同时将产品得率提高到25%。
通常认为磷脂酶A2只有在水分活度不低于0.2时才具有活力[36],适当提高反应体系中的水分虽可提高初始反应速度[35],但也会加剧水解反应,降低产品得率。为了提高磷脂酶A2的催化效率,Hosokawa等[25]向反应体系中加入适量水模拟物——甲酰胺作为酶激活剂,在提高反应速度的同时抑制磷脂的水解,最终将EPA磷脂产品得率提高到60%左右。Awano等[37]借鉴该方法,在溶血磷脂和DHA的反应中加入甲酰胺,进一步地在反应后期脱除甲酰胺和反应产生的水分,可将DHA磷脂的得率提高到87.1%。而Tanaka等[38]于2012年公布了一项制备EPA/DHA-PL的专利,其在以甘油为溶剂的反应体系中加入CaCl2溶液、氨基酸和肽,以激活磷脂酶A2,催化溶血磷脂和DHA的量为51.8%的脂肪酸,在真空条件下反应,获得DHA的量高达34.2%的磷脂。
除了磷脂酶A2,具有酯合成活力的脂肪酶也可作为该方法的催化剂。Lyberg等[36]比较了5种脂肪酶和2种磷脂酶催化溶血磷脂和EPA/DHA合成EPA/DHA-PL的结果,发现少根根霉(Rhizopusarrhizus)脂肪酶和Novozym 435都能催化EPA与溶血磷脂的反应,但仅有Novozym 435可催化DHA与溶血磷脂的反应。由于溶血磷脂底物的sn-1位上不含EPA/DHA,在不考虑酰基迁移和水解反应的前提下,即使sn-2位全部与EPA/DHA结合,所得产物中EPA/DHA的量最高也仅能达到50%左右。Hong等[39]以Novozym 435为催化剂,通过甘油磷酰胆碱(GPC)和共轭亚油酸(为72.2%)反应可获得共轭亚油酸的量最高为71.5%的磷脂产品,这说明以GPC和EPA/DHA为底物制备高纯度EPA/DHA-PL具有一定的可行性,在此基础上,Liu等[40]在无溶剂体系中通过GPC与DHA的酯合成反应得到DHA溶血磷脂产品。
3 酰基脱除法
南极磷虾、海洋鱼卵等材料中富含以磷脂形式存在的EPA和DHA,且EPA和DHA多存在于磷脂甘油骨架的sn-2位上,为了进一步提高其EPA和DHA含量,一方面可以采用酰基替换法,将磷脂sn-1位上的其他脂肪酸替换为EPA和DHA[22],另一方面则可以采用酰基脱除法,即通过酶促水解(或醇解)选择性地除去其甘油骨架上连接的其他脂肪酸,从而得到EPA/DHA被相对富集的溶血磷脂(图3)。

图3 酰基脱除法制备EPA/DHA-PLFig.3 Preparation of EPA/DHA-PL by acyl-removal method
磷脂酶A1能够专一性地水解磷脂sn-1位的脂肪酸,可直接用于酰基脱除法制备EPA/DHA-PL(而磷脂酶A2因为可专一性地水解磷脂sn-2位脂肪酸,通常不在该方法的考虑范围内)。如王琦[41]以Lecitase ultra为催化剂水解鸢乌贼卵磷脂,可将鸢乌贼卵磷脂中DHA的量由40.3%提高到51.1%。
虽然甘油三酯和磷脂在化学结构上具有一定的相似性,但并非能够水解甘油三酯的脂肪酶都能用于磷脂的水解,且脂肪酶水解磷脂能力的大小还与反应体系有关[42]。Hara等[43]发现,在反胶束体系中,来源于毛霉或根霉的脂肪酶具有较高的磷脂水解活力;在有机溶剂体系中,来源于柔毛腐质霉(Humicolalanuginosa)、代氏根霉(Rhizopusdelemar)和褶皱假丝酵母的脂肪酶具有较高的磷脂水解活力[44]。由于天然存在的EPA/DHA多位于磷脂甘油骨架的sn-2位上,脂肪酶的筛选也需进一步考虑其催化位点偏好性,如来源于米黑根毛霉的脂肪酶不仅具有较高的磷脂水解活力,且能专一地水解磷脂sn-1位脂肪酸[45]。Ono等[46]以调节水分活度的固定化米黑根毛霉脂肪酶Lipozyme IM为催化剂,通过在正己烷体系中磷脂的部分水解反应,将鱿鱼皮磷脂的DHA的量由33.3%提高至近60%,将DHA蛋黄磷脂的DHA的量由10.9%提高至35%以上。由于酰基迁移作用,磷脂sn-1位上的酯键被水解断裂后暴露出羟基,sn-2位上的EPA/DHA在一定条件下可迁移到sn-1位上[47],随后被水解成为游离的EPA/DHA,导致产品得率降低。为了提高EPA/DHA-PL的得率,应当选择难于催化EPA/DHA水解的脂肪酶。球等鞭金藻(Isochrysisgalbana)中的DHA主要为磷脂型,且DHA主要位于磷脂的sn-2位,Devos等[48]从天野公司和诺维信公司的12种酶制剂中筛选出对DHA具有“歧视”效应的米根霉(Rhizopusoryzae)和爪哇毛霉(Mucorjavanicus)脂肪酶用于球等鞭金藻DHA磷脂的选择性水解。
除水解反应之外,磷脂的醇解反应(如磷脂与乙醇反应生成溶血磷脂和脂肪酸乙酯)也可用于提高天然海洋磷脂中EPA和DHA的含量[49]。
酰基脱除法在提高天然海洋磷脂中EPA和DHA含量的同时,伴随着富含EPA/DHA的溶血磷脂(EPA/DHA-LPL)的产生,该成分除了具有比普通磷脂更强的乳化性能之外,还被认为是为大脑补充DHA的更佳载体[50-52]。
4 结论与展望
现有的酶促制备EPA/DHA-PL的方法通常影响因素多、制备速度慢且工艺成本较高,但其独特的优势在于可通过磷脂、EPA/DHA供体、酶制剂和制备方法的选择以及反应条件的优化来控制产品的磷脂种类和EPA/DHA的含量或比例。
目前,从海洋生物尤其是南极磷虾中提取的EPA/DHA-PL产品已经实现产业化,并在EPA/DHA产品市场中占有越来越高的份额。EPA/DHA-PL的酶促制备目前仍鲜见成功的商业化案例,但随着EPA/DHA-PL产品需求的不断增加和工艺成本的不断降低,酶促制备的EPA/DHA-PL产品将会有越来越良好的市场前景。
