LC-MS/MS法同时测定大鼠血浆中地榆皂苷Ⅰ和地榆皂苷Ⅱ的血药浓度及其药代动力学
2019-10-10朱志铭鲍晓文张铭雅
唐 俊,张 杰,孙 伟,赵 昂,朱志铭,鲍晓文,张铭雅,马 博
(1.江苏黄河药业股份有限公司,江苏 阜宁 224400;2.南京工业大学 药学院,江苏 南京 211800;3.江苏省食品药品监督检验研究院,江苏 南京 210008)
地榆(SanguisorbaofficinalisL.)为蔷薇科地榆属植物地榆的干燥根,性微寒、味苦,归肝、大肠经,具有凉血止血、解毒敛疮的作用[1]。从地榆中分离得到的地榆皂苷Ⅰ(ZiyuglycosideⅠ)和地榆皂苷Ⅱ(ZiyuglycosideⅡ)为地榆中具有药理活性的主要成分[2]。现代药理学研究表明,地榆中的皂苷类成分具有抗肿瘤和美容护肤的作用[3-4],其中,地榆皂苷Ⅰ既可以防止胶原纤维的降解,又能有效促进I型胶原蛋白的生成,减少皮肤皱纹,有望被开发成为新一代的美容护肤品;地榆皂苷Ⅱ能够抑制血管生成,起到抗肿瘤转移的作用[5]。因此,地榆中皂苷类成分的含量测定对其进一步的药学研究发开具有重要意义。现有研究中主要采用高效液相色谱-紫外检测法(HPLC-UV)[6]、高效液相色谱-蒸发光散射检测器法(HPLC-ELSD)[7]、液相色谱-质谱联用法(LC-MS)[8]、液相色谱-串联质谱法(LC-MS/MS)[9]、液相色谱-四极杆/飞行时间质谱法(LC-Q-TOF/MS)[10]等方法对地榆植物中的活性成分进行了含量的测定。但地榆总皂苷因其较差的水溶性,在动物实验中的给药方式大多为口服给药。因此,鲜有对其在体内的绝对生物利用度的相关研究。
本文中,笔者拟建立快速、灵敏、简便的LC-MS/MS法测定大鼠血浆中地榆皂苷Ⅰ和地榆皂苷Ⅱ的方法并运用于大鼠体内药物代谢动力学研究,以期为地榆皂苷系列化合物的药物开发提供数据支持。
1 材料和方法
1.1 实验材料
地榆皂苷Ⅰ、地榆皂苷Ⅱ、竹节香附素A(经HPLC检测,纯度≥98%),上海源叶生物科技有限公司;甲酸(质谱纯),Sigma公司;甲醇(色谱纯),Merck公司;超纯水,Millipore公司。
SD大鼠12只(动物合格证号:SCXK (苏) 2016—0004),扬州大学比较医学中心,体质量(200±10) g,雌雄各半。饲养环境:室温(22±2)℃,相对湿度(50±10)%,12 h/12 h昼夜循环。
1.2 主要仪器
AB Sciex 4000型三重四级杆串联质谱仪,Sciex公司;UFLC-20A型高效液相色谱仪,Shimadzu公司;BT125D型电子天平,Sartorius公司;SPD2010型真空浓缩装置、5810R型冷冻离心机,Thermo Fisher公司。
1.3 实验方法
1.3.1 高效液相色谱条件
色谱柱为Ultimate XB-C8色谱柱(100 mm×2.1 mm,3 μm,Welch),柱温为40 ℃,流动相为乙腈(含0.05%甲酸)-水(2 mmol/L乙酸铵)(体积比为52∶ 48),采用等度洗脱,流速0.20 mL/min,进样量5 μL,每个样品检测所需时间为6 min。
1.3.2 质谱检测条件
电喷雾离子源(ESI),多级反应监测(MRM),负离子模式,辅助气温度(turbo gas temperature)为450 ℃,辅助气(GS1)为275.79 kPa(40 psi),雾化气(GS2)为379.21 kPa(55 psi),气帘气(CUR)为68.94 kPa(10 psi),离子喷雾电压(IS)为-4 500 V。
在此条件下相关离子如表1所示。
1.3.3 溶液的配制
分别精密称取地榆皂苷Ⅰ,地榆皂苷Ⅱ,竹节香附素A各10.00 mg,加入甲醇定容至10 mL,配制成质量浓度为1 mg/mL的储备液,于-20 ℃下保存;分别取地榆皂苷Ⅰ,地榆皂苷Ⅱ储备液,用甲醇梯度稀释,分别配制成10、20、50、100、200、500、1 000、2 000、5 000、10 000和20 000 ng/mL的工作液;取竹节香附素A储备液,用甲醇稀释至质量浓度为1 μg/mL的内标工作液。分别配制浓度为16、1 600 和16 000 ng/mL的地榆皂苷Ⅰ和地榆皂苷Ⅱ的质控工作液。
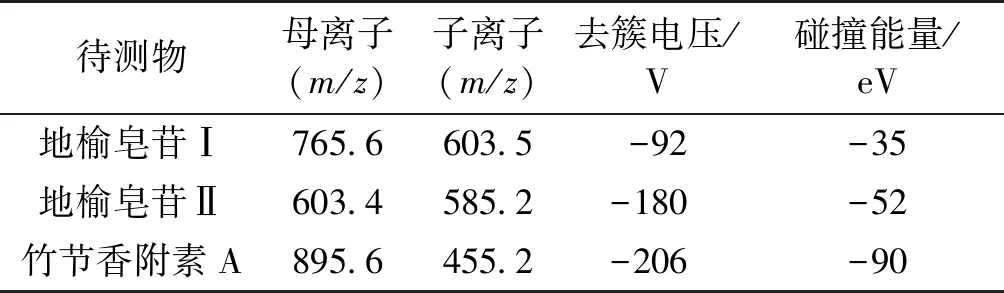
表1 各物质MRM模式检测离子
1.3.4 血浆样品的处理方法
取100 μL 血浆,加入10 μL(1 μg/mL)内标工作液,混匀振荡30 s,随后加入0.4 mL 甲醇溶液,涡旋振荡5 min,于12 000 g、4 ℃下离心10 min,取上清液0.4 mL,用Speed Vac真空浓缩装置挥干,残渣用100 μL 流动相溶解,于20 000g、4 ℃下离心10 min,取上清液5 μL 进样分析。
1.3.5 药代动力学试验
SD大鼠12只实验前禁食12h后随机均分为2组:口服给药组和静脉注射组,每只大鼠给药2 mg/kg地榆皂苷Ⅰ和地榆皂苷Ⅱ的混合物。采血点设计如下,口服给药组:口服给药前及服药后0.083、0.25、0.5、0.75、1、2、4、6、8和12 h 时眼眶后静脉丛采血200 μL,置于肝素钠化的试管中;静脉注射组:静脉注射前及注射后0.033、0.083、0.25、0.5、1、2、4、6、8和12 h时眼眶采血200 μL,置于肝素钠化的试管中。全血样品于3 000g离心10 min获取血浆。血浆样品立即放置-70 ℃冰箱中冻存待测。采用DAS3.0 软件中的非房室模型法计算药动学参数。
2 结果与讨论
2.1 分析方法的专属性
图1显示了6 份不同来源的空白大鼠的血浆,按1.2.4节的方法处理后其中地榆皂苷Ⅰ、地榆皂苷Ⅱ及内标的保留时间分别为1.91、3.08和2.82 min。
由图1可知:血浆中内源性物质不干扰待测物质的测定;待测物及内标的峰型较好。表明该方法具有较高的专属性。
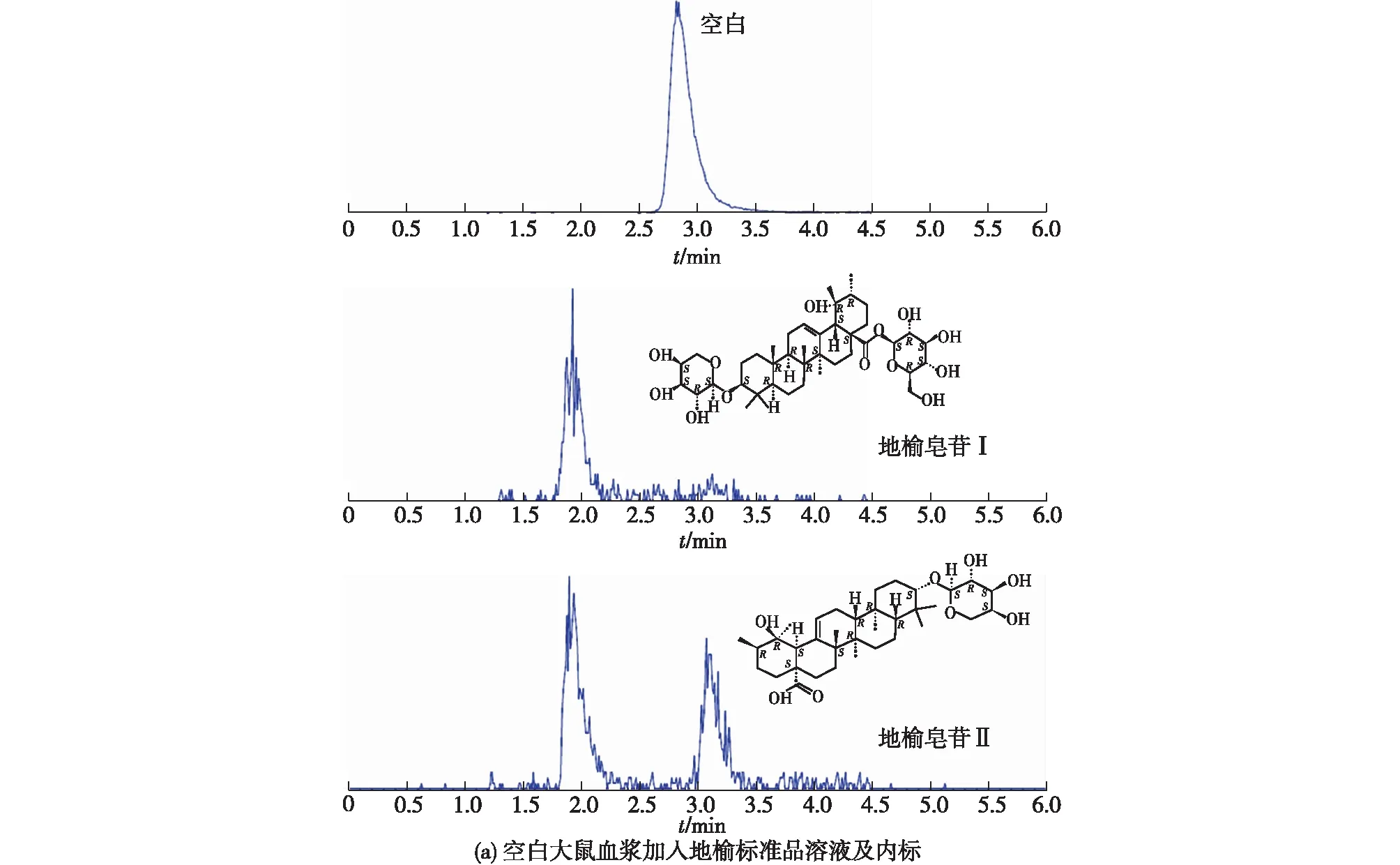
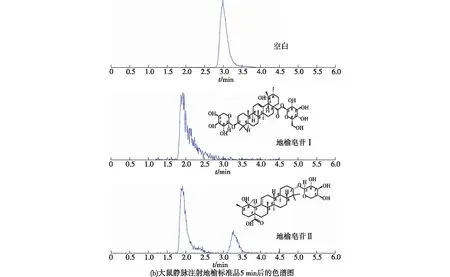
图1 大鼠血浆样品及加入一定浓度地榆标准品溶液(a)和大鼠静脉注射地榆标准品5 min后(b)血浆的色谱图Fig.1 Typical MRM chromatograms of blank plasma sample added with standard solution of ZiyuglycosideⅠand ZiyuglycosideⅡ (a) and rat plasma sample obtained at 5 min after tail vein injection (b)
2.2 线性关系的考察
取空白血浆90 μL,分别加入地榆皂苷Ⅰ、地榆皂苷Ⅱ工作液,配制成含地榆皂苷Ⅰ、地榆皂苷Ⅱ为1~2 000 ng/mL的含药血浆,按1.2.4节的方法处理。以血浆中待测物的浓度为横坐标、待测物的峰面积与内标的峰面积之比为纵坐标,用加权最小二乘法(W=1/ρ2) 进行回归运算,得线性方程分别为:Y=0.009 67X+0.010 8,相关系数R=0.999 1(地榆皂苷Ⅰ);Y=0.002 52X+0.000 151,相关系数R=0.995 2(地榆皂苷Ⅱ)。数据表明地榆皂苷Ⅰ,地榆皂苷Ⅱ在1~2 000 ng/mL范围内与峰面积比值的线性关系良好,定量下限均为1 ng/mL(信噪比S/N>10)。
2.3 精密度与准确度试验
分别配制含地榆皂苷Ⅰ和地榆皂苷Ⅱ的定量下限(LLOQ),低、中、高浓度(1、1.6、160和1 600 ng/mL)4个浓度的血浆样本各6份,按1.2.4节的方法处理,根据当日的标准曲线计算质控样品的测得浓度。将质控样品的分析结果进行方差分析,计算方法的精密度与准确度结果见表2。由表2可知,样品批间和批内分析精密度均小于15%,实验结果符合生物样品的测定要求。
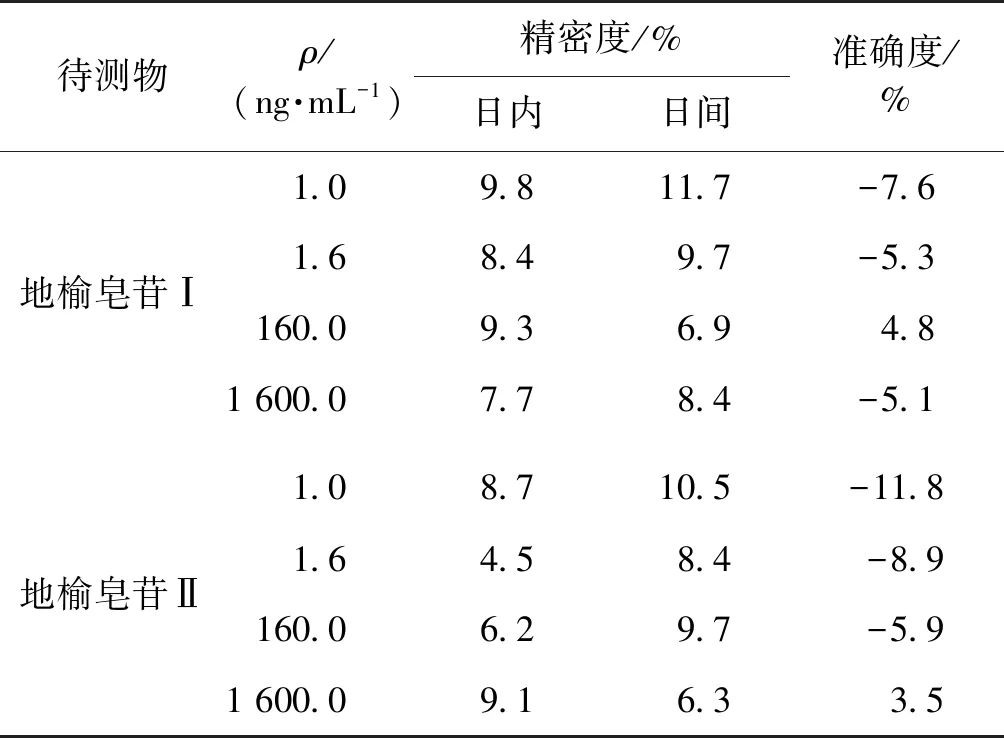
表2 LC-MS/MS 法测定地榆皂苷Ⅰ及Ⅱ的精密度与准确度
2.4 提取回收率与基质效应
按1.2.4节的方法处理低、中、高浓度的质控样品,每个浓度6个样本,以其进样得到的峰面积除以空白血浆经处理后再加入低、中、高浓度的质控溶液及内标溶液后进样得到的峰面积,计算血浆中地榆皂苷Ⅰ、地榆皂苷Ⅱ的提取回收率与基质效应,结果见表3。由表3可知,在实验中未见到明显的基质效应,两种物质的提取回收率良好。
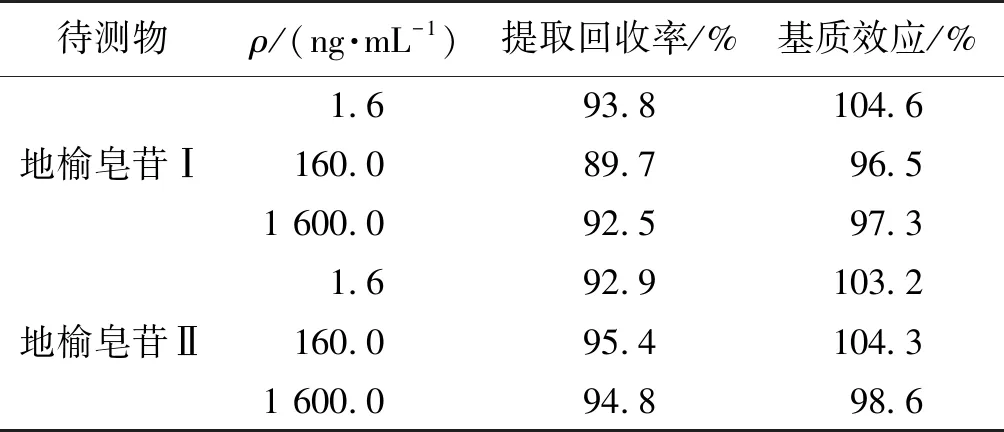
表3 LC-MS/MS 法测定地榆皂苷Ⅰ及Ⅱ的基质效应及提取回收率
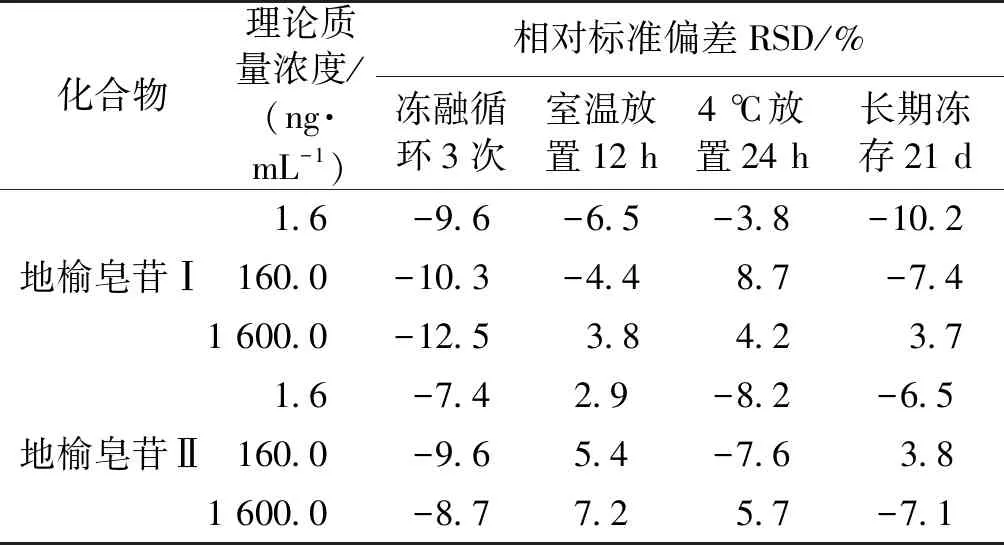
2.5 稳定性的考察
配制含地榆皂苷Ⅰ和地榆皂苷Ⅱ的低、中、高浓度对照品血浆各6份,分别于-70 ℃反复冻融3 次、室温放置12 h、4 ℃自动进样器中放置24 h和-70 ℃冷冻保存1个月。按1.2.4节的方法处理样品,测定血浆中地榆皂苷Ⅰ、地榆皂苷Ⅱ的浓度,分别考察冻融循环、室温、4 ℃自动进样盘和长期冷冻保存条件下的稳定性,结果见表4。由表4可知,地榆皂苷Ⅰ和地榆皂苷Ⅱ在各条件下稳定性良好。
表4各储存条件或处理条件下地榆皂苷Ⅰ及地榆皂苷Ⅱ的稳定性
Table 4Stability of ZiyuglycosideⅠand ZiyuglycosideⅡ under various conditions (n=6)
化合物理论质量浓度/(ng·mL-1)相对标准偏差RSD/%冻融循环3次室温放置12 h4 ℃放置24 h长期冻存21 d地榆皂苷Ⅰ1.6-9.6-6.5-3.8-10.2160.0-10.3-4.48.7-7.41 600.0-12.53.84.23.7地榆皂苷Ⅱ1.6-7.42.9-8.2-6.5160.0-9.65.4-7.63.81 600.0-8.77.25.7-7.1
2.6 药代动力学研究结果
采用建立并经过考证的LC-MS /MS方法检测大鼠血浆中地榆皂苷Ⅰ、地榆皂苷Ⅱ的浓度,绘制血药浓度-时间曲线见图2和图3,采用DAS3.0软件应用非房室模型法计算药动学参数见表5。由图2可知,地榆皂苷Ⅰ、地榆皂苷Ⅱ经静脉注射进入大鼠体循环后,血液中药物浓度即达到最高,并且药物浓度随着时间逐渐降低。由图3可知,大鼠口服地榆皂苷Ⅰ、地榆皂苷Ⅱ后,血液中药物浓度逐渐上升。血药浓度分别在(0.500±0.204)h和(0.438±0.125)h时刻达到最高(69.506±25.857)ng/mL和(55.350±10.313)ng/mL。由表5可知,大鼠口服和静脉注射地榆皂苷Ⅰ、地榆皂苷Ⅱ的绝对生物利用度(Fabs)分别为(9.580±3.886)%、(12.215±3.353)%。两种物质的口服绝对生物利用度较低,可能与其水溶性较差有关。
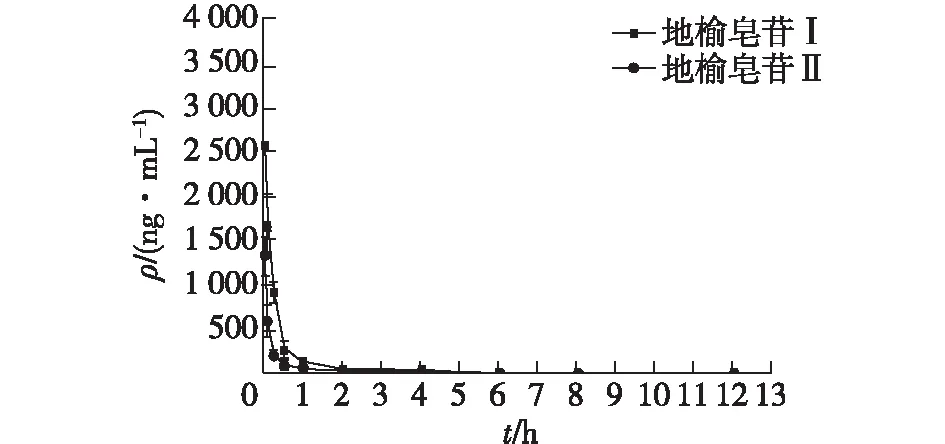
图2 大鼠静脉注射地榆皂苷Ⅰ、地榆皂苷Ⅱ后血药浓度-时间曲线Fig.2 Plasma concentration-time profiles of ZiyuglycosideⅠand ZiyuglycosideⅡ after tail vein injection
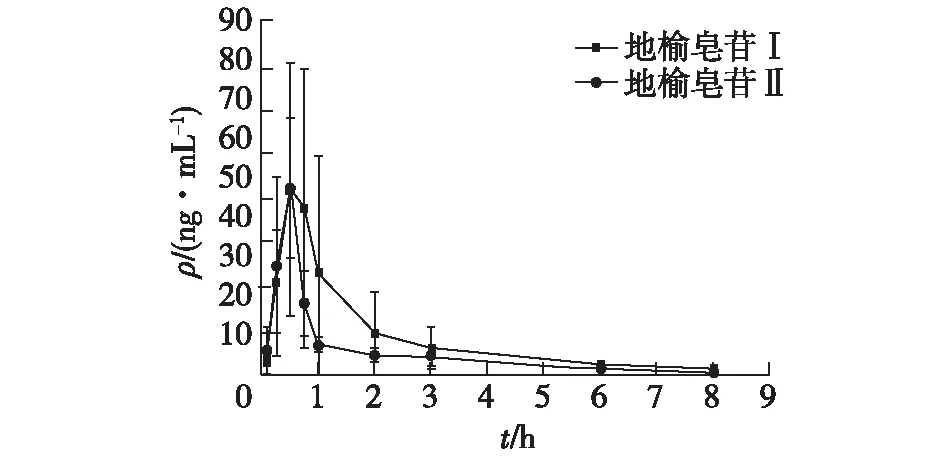
图3 大鼠口服地榆皂苷Ⅰ、地榆皂苷Ⅱ后血药浓度-时间曲线Fig.3 Plasma concentration-time profiles of ZiyuglycosideⅠand ZiyuglycosideⅡ after oral administration
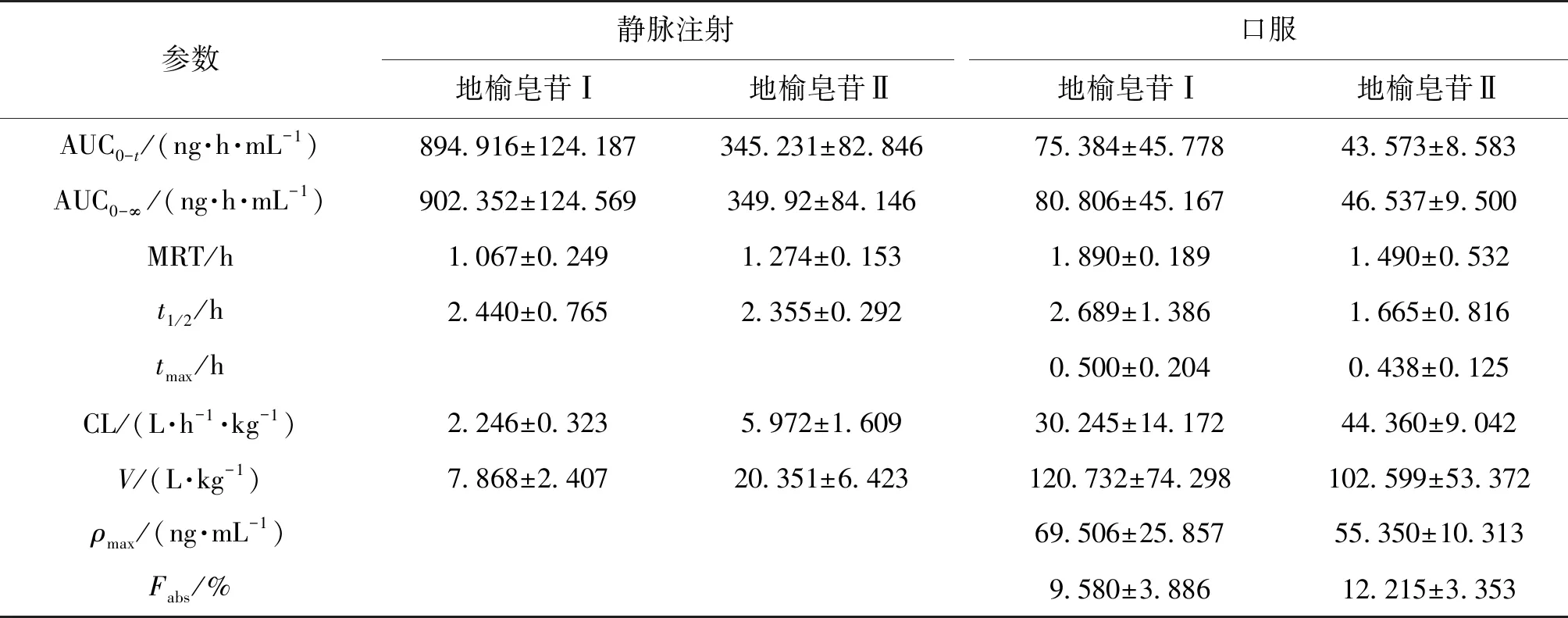
表5 大鼠分别静注注射和口服地榆皂苷Ⅰ和地榆皂苷Ⅱ药代动力学参数
注:AUC 为血药浓度时间曲线下面积;ρmax为血药浓度峰值;tmax是指用药以后,血药浓度达到峰值所需的时间;MRT为平均驻留时间;V为表观分布容积;CL为清除率;t1/2为半衰期;Fabs为绝对生物利用度。
3 结论
本文中,笔者建立了LC/MS-MS方法用于同时测定大鼠血浆中地榆皂苷Ⅰ和地榆皂苷Ⅱ。此法具有专属性好、灵敏度高、线性良好、精密度良好且准确度高的特点。在此方法学研究的基础上,进行了地榆皂苷Ⅰ和地榆皂苷Ⅱ在大鼠体内的药物代谢动力学研究。结果显示,地榆皂苷Ⅰ和地榆皂苷Ⅱ口服吸收较快,但吸收不完全。两种化合物生物利用度均较低,可能是由于化合物的脂溶性较差。实验结果为进一步研究和开发地榆皂苷Ⅰ和地榆皂苷Ⅱ类生物制品提供了理论基础。
