利用果渣产黄腐酸菌剂的筛选
2019-10-10冀颐之赵有玺彭雪菲李思宇
冀颐之,赵有玺,彭雪菲,李思宇,杜 军,2
(1. 北京联合大学 生物化学工程学院 生物质废弃物资源化利用北京市重点实验室,北京 100023;2. 中国生物发酵产业协会,北京 100833)
水果是人类营养物质的重要来源,也是食品工业发展的基础原料之一。我国是世界最大的水果生产国,总面积和总产量均居世界第一。根据国家统计局公布的数据,至2015年,全国水果总产量达到2.74亿 t[1]。但在果业规模化、集约化发展的同时,水果副产物产量也随之加大,数量高达上亿吨[2]。若不加以合理利用,形成农业固体废弃物,不仅会造成资源浪费,还会引起环境污染。因此,对水果副产物进行综合利用,使其变废为宝,消除环境污染,对我国农业产业可持续发展有着重要意义。
黄腐酸(fulvic acid,FA) 是一种溶于水的灰黑色粉末状物质,是腐植酸的一种,根据来源可分为矿源腐植酸和生化黄腐酸[3]。生化黄腐酸(biochemical fulvic acid,BFA)是以有机废弃物为原料,经多种微生物多级发酵转化而成,具有分子量小、功能团含量多和水溶性好等特点[4],易被生物吸收利用,在改良土壤[5]、促进植物生长[6]、饲料添加[7]、环境治理[8-10]等领域具有重要发展潜力。
水果副产物包括落果、残次果和加工后剩余的果皮、果渣、果核、种子、叶、茎、根等下脚料以及加工废水等[2]。近些年来,水果副产品的综合利用引起了众多研究者的关注[11-13]。其中,以果渣等水果副产物为原料,利用生物发酵技术开展了生化黄腐酸的研究,为果渣的资源化利用提供了有效的途径。惠有为等[14]釆用二步固体发酵工艺利用苹果渣固体发酵生产黄腐酸,发酵24 d后,黄腐酸产率为41.2%;赵丹等[15]利用复合菌剂对苹果渣进行混合发酵生产黄腐酸,黄腐酸含量可达24.3%;孙建国等[16]以苹果渣为基质,复合微生物发酵20~25 d,黄腐酸产量可达22%。
我国每年有大量的水果副产物,如苹果[17]、菠萝[18]、香蕉[19]等,其副产物含有丰富的纤维素,利用这些有机废弃物生产附加值较高的黄腐酸,可实现水果副产物的资源化利用,产生巨大的社会效益和经济效益。本研究以苹果渣为原料,进行黄腐酸发酵菌剂的筛选,以期为农业固体废弃物的资源化利用提供技术依据。
1 材料与方法
1.1 材料
1.1.1 菌种分离来源
生物腐植酸样品,某腐植酸生产企业提供。季也蒙酵母(Meyerozymaguilliermondii)(CICC 31056),长枝木霉(Trichodermalongibrachiatum)(CICC 41185),保藏于中国工业微生物菌种保藏管理中心。
1.1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏5.0 g,蛋白胨10.0 g,琼脂20.0 g,蒸馏水1 000 mL,pH 7.2~7.4。
高氏一号培养基:可溶性淀粉20.0 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,KNO30.1 g,NaCl 0.5 g,FeSO40.01 g,琼脂粉20.0 g,蒸馏水1 000 mL,pH 7.2~7.4。使用之前,在融化的培养基中按照每1 000 mL培养基中加入3.3 mL的比例加入3%的K2Cr2O7溶液。
马丁氏培养基:葡萄糖10.0 g,蛋白胨5.0 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,孟加拉红33.4 mg,蒸馏水1 000 mL,pH自然。使用之前,在融化的培养基中按照1 000 mL培养基中加入0.3 mL的比例加入1%的青霉素溶液。
LB培养基:蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,蒸馏水1 000 mL。
YPD培养基:蛋白胨20.0 g,葡萄糖20.0 g,酵母提取物10.0 g,蒸馏水1 000 mL。
PDA培养基:称取200 g马铃薯切成小块,加水煮沸20~30 min,8层纱布过滤,加热,加琼脂20 g,待琼脂溶解完后,加入葡萄糖20 g,溶解,补足蒸馏水至1 000 mL。
果渣固态培养基:苹果果渣干粉20 g,(NH4)2SO40.5 g,麸皮1.5 g,配料时加水混匀,含水分20%,装入500 mL三角瓶中,121 ℃灭菌20 min。
1.2 仪器与设备
LRH-150型生化培养箱,上海一恒科学仪器有限公司;GI54T型高温高压灭菌锅,致维仪器有限公司;SW-CJ-1FD型单人单面净化工作台,苏州净化有限公司;GelDoc2000型凝胶成像系统,美国伯乐公司;ABI9700型PCR扩增仪,美国应用生物系统公司。
1.3 方法
1.3.1 腐植酸样品中微生物的分离纯化
称取10 g生物腐植酸样品,放入盛有100 mL无菌水并带有玻璃珠的锥形瓶中,振摇10 min后,吸取菌液进行梯度稀释,并取适宜稀释度的液体分别涂布于牛肉膏蛋白胨培养基、高氏一号培养基、马丁氏培养基固体平板上,倒置于45 ℃生化箱中培养。挑取平板上生长良好,且形态特征不同的单菌落,进一步纯化后,转接于斜面培养,并置于冰箱4 ℃条件下保存。
1.3.2 黄腐酸生产菌株的筛选
将初筛菌株接入LB培养基中培养24 h,以10%的接种量接入果渣固态培养基中,45 ℃生化培养箱培养20 d。发酵过程每天补充无菌水5 mL,以补充蒸发的水分。
1.3.3 黄腐酸复合菌剂的筛选
复合菌剂1由BFA02和BFA03以体积比1∶ 1构成;复合菌剂2由季也蒙酵母、BFA02和BFA03以体积比1∶ 1∶ 1构成;复合菌剂3由长枝木霉、BFA02和BFA03以体积比1∶ 1∶ 1构成;复合菌剂4由季也蒙酵母、长枝木霉、BFA02和BFA03以体积比1∶ 1∶ 1∶ 1构成。其中,BFA02、BFA03接种至LB培养基中,37 ℃、200 r/min过夜培养;季也蒙酵母接种至YPD培养基中,28 ℃、200 r/min培养24 h;长枝木霉接种至PDA固体斜面,28 ℃生化箱中培养4 d,加入无菌水,刮孢子,经适当稀释配制成密度为107左右的孢子悬液。各复合菌剂按上述比列混合,按10%的接种量接入果渣固态培养基中,45 ℃生化培养箱培养20 d。发酵过程每天补充无菌水5 mL,以补充蒸发的水分。
1.3.4 黄腐酸生产菌株的分类鉴定
1.3.4.1 形态学特征
将纯化后的菌株接种于LB固体平板培养基上,37 ℃培养24 h 后观察其菌落生长情况和形态。挑取单个菌落制成玻片,革兰氏染色[20],置于光学显微镜下,16×100,观察各菌株的显微形态。
1.3.4.2 分子生物学鉴定
采用细菌菌株的通用引物:正向引物27F 5’-A ̄G ̄A ̄G ̄T ̄T ̄G ̄A ̄T ̄C ̄C ̄T ̄G ̄G ̄C ̄T ̄C ̄A ̄G -3’;反向引物1492R:5’-G ̄G ̄T ̄T ̄A ̄C ̄C ̄T ̄T ̄G ̄T ̄T ̄A ̄C ̄G ̄A ̄C ̄T ̄T-3’;进行菌落PCR,扩增16S rDNA。
PCR反应体系: 10×Buffer(含Mg2+)2 μL,dNTP(各2.5 mmol/L)2 μL,F(10 μmol/L)2 μL,R(10 μmol/L)2 μL,rTaq DNA 聚合酶0.5 μL,加双蒸水至20 μL。
PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸90 s,25 个循环;72 ℃修复延伸7 min;最后4 ℃终止反应。
扩增产物用0.8%的琼脂糖凝胶电泳回收,纯化后的产物测序后获得的16S rDNA 序列,登录http://blast.ncbi.nlm.nih.gov/Blast.cgi 网站,用Blast 程序进行序列比对分析,选取与之相似性高的菌16S rDNA 序列,使用 MEGA 5.0 软件比对、分析、构建系统发育树,Bootstrap 1 000 次进行稳定性验证。
1.3.5 纤维素、半纤维素及木质素的测定
参考侯勇[21]的方法,进行纤维素、半纤维素及木质素的测定。降解率计算见式(1)~(3)。
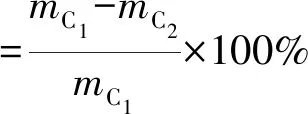
(1)
式中:mC1为发酵前纤维素含量,g;mC2为发酵后剩余纤维素含量,g。
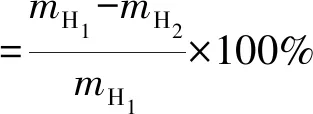
(2)
式中:mH1为发酵前半纤维素含量,g;mH2为发酵后剩余半纤维素含量,g。
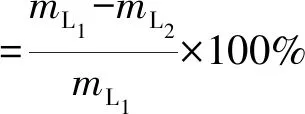
(3)
式中:mL1为发酵前木质素含量,g;mL2为发酵后剩余木质素含量,g。
1.3.6 黄腐酸的测定
采用滴定法进行黄腐酸测定[22]。黄腐酸产量计算见式(4)。
黄腐酸产量=B2-B1
(4)
式中:B1为发酵前体系中黄腐酸含量,g/kg;B2为发酵后体系中黄腐酸含量,g/kg。
2 结果与讨论
2.1 黄腐酸生产菌株的筛选
2.1.1 黄腐酸样品微生物的分离纯化
按照方法1.3.1对生物腐植酸样品进行分离纯化。由于天然腐植酸生产通常是在高温下进行,因此确定筛选温度为45 ℃。通过平板稀释法涂布,45 ℃培养4 d,仅从牛肉膏蛋白胨培养基中筛选出生长良好、形态不同的4株菌株,分别编号为BFA01、BFA02、BFA03、BFA04作为本研究初筛菌株,用于后续实验。
2.1.2 黄腐酸生产菌株的复筛
将初筛获得的4株菌接种于果渣固态培养基中,45 ℃发酵20 d,分别测定其黄腐酸产量和木质纤维素降解率,结果如图1所示。从图1可知,菌株BFA02、BFA03两株菌黄腐酸产量较高,分别为43.67、59.35 g/kg,具有较好的黄腐酸生产性能。
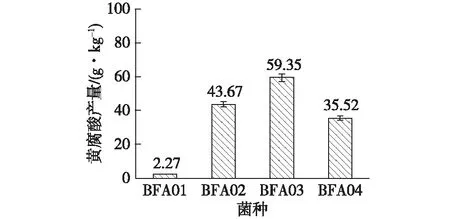
图1 初筛菌株的黄腐酸产量Fig.1 Fulvic acid production of the isolated strains
考察4株菌株的木质纤维素降解能力,结果如图2所示。从图2可以看出菌株BFA02纤维素和木质素降解能力较好,其纤维素和木质素降解率分别为34.42%、29.7%。而BFA03则具有非常好的半纤维素降解能力,其降解率为32.81%。自然界中木质纤维素的分解多依赖于纤维素、半纤维素和木质素分解菌株的协同作用,多菌混合发酵,可提高纤维素的转化效率[23-25],因此选定菌株BFA02、BFA03为黄腐酸生产菌株,进行复配实验。
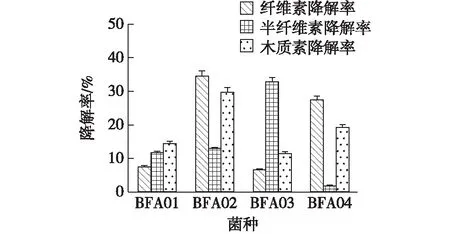
图2 初筛菌株的木质纤维素降解率Fig.2 Degradation rate of cellulose,hemi cellulose and lignin by the isolated strains
2.1.3 菌株BFA02、BFA03的鉴定及进化树构建
2.1.3.1 菌落形态特征观察
在45 ℃培养24 h 后对菌株BFA02、BFA03进行菌落形态及显微特征的观察,结果如图3所示。由图3可见:菌株BFA02菌落形态为扁平,边缘不整齐,扩展,表面粗糙,中间有环状隆起皱褶,乳白色、不透明。显微镜下观察菌株BFA02,其为革兰氏阳性菌,菌体均一,呈短杆状。菌株BFA03菌落呈圆形,边缘锯齿状,菌落轻微隆起,表面黏稠,白色,不透明。显微镜下观察菌株BFA03,其菌体均一,呈杆状,革兰氏阳性菌。
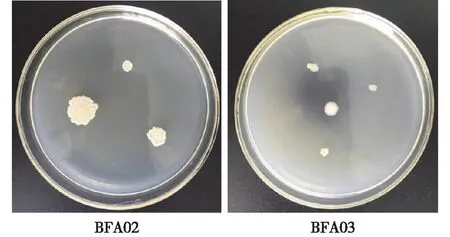
图3 菌株BFA02和BFA03的菌落形态观察Fig.3 Colonial characteristics of strain BFA02 and BFA03
2.1.3.2 分子生物学鉴定
分析了菌株BFA02和BFA03的16S rDNA,结果如图4所示。由图4可知:其片段长度均为1 456 bp,经基因序列比对分析,发现BFA02与BacillusamyloliquefaciensHYM25相似度最高为99%,BFA03与B.licheniformisCGMCC2876相似度最高为99%。基于它们的16S rDNA所构建的系统发育进化树(图5、6),初步确认BFA02为解淀粉芽孢杆菌,BFA03为地衣芽孢杆菌。
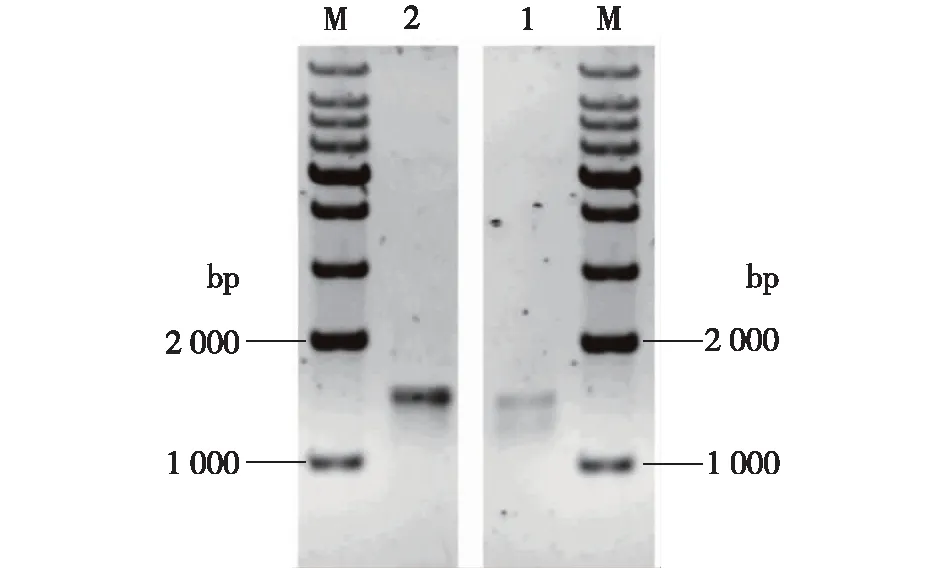
1—菌株BFA02的PCR扩增产物;2—菌株BFA03的PCR扩增产物;M—标准DNA图4 菌株BFA02和BFA03的16S rDNA PCR扩增结果Fig.4 Electrophoresis of PCR amplification products of bacterial 16S rDNA from BFA02 and BFA03
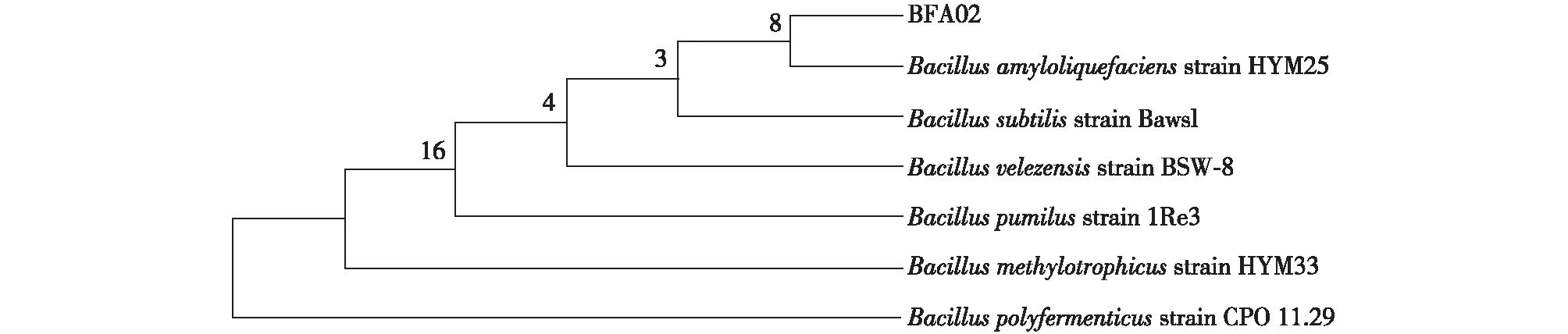
图5 菌株BFA02 16S rDNA 系统发育树Fig.5 Phylogenetic tree of strain BFA02 based on 16S rDNA sequence
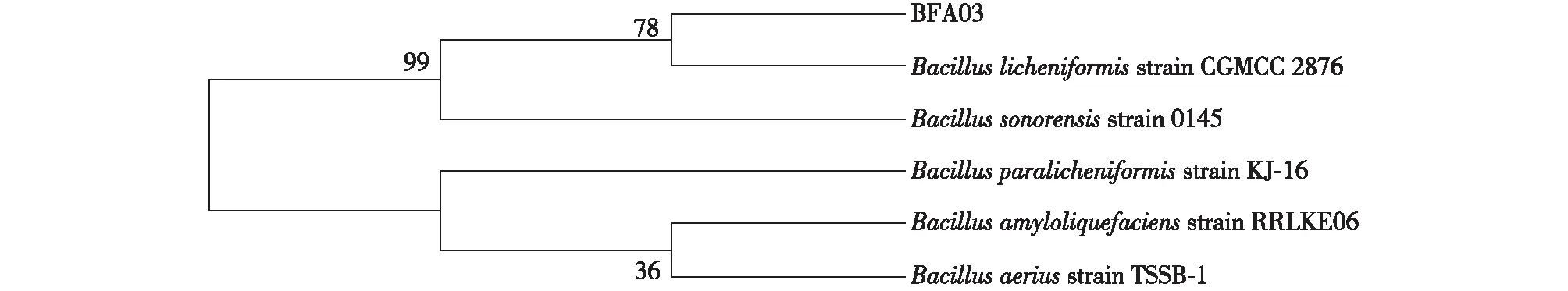
图6 菌株BFA03 16S rDNA 系统发育树Fig.6 Phylogenetic tree of strain BFA03 based on 16S rDNA sequence
2.2 复配菌剂的筛选
研究表明,固体废弃物在堆肥过程中,相比自然发酵,采用人工接菌的方式更有利于脂肪、蛋白质、多糖等成分的生物降解,促进腐植酸和黄腐酸的生成[26-28];如果同时接入木质纤维素降解菌株,如木霉、白腐真菌等,将会更有效地加速堆肥过程[27-29]。因此,考虑将筛选获得的黄腐酸生产菌株BFA02、BFA03与长枝木霉、季也蒙酵母进行复配,以获得最佳的复合菌剂。
按1.3.3节的方法制备4组复合菌剂,分别以10%的接种量接入果渣固态培养基中,进行黄腐酸发酵实验,20 d后测定其生化黄腐酸含量及木质纤维素降解率,实验结果见图7~8。由图7~8可知,复合菌剂发酵优于单菌发酵,其黄腐酸产量均高于单菌发酵产量。其中,由BFA02、BFA03和长枝木霉构成的复合菌剂3实验组黄腐酸产量最高,可达103.19 g/kg。该实验组纤维素、半纤维素、木质素降解率分别为46.25%、39.49%、37.5%,均高于其他单菌或复合菌剂实验组。文献[30]报道,长枝木霉具有很好的木质纤维素降解能力,可利用自身的酶系,高效分解底物,提高底物转化率。因此,加入长枝木霉后,促进了底物转化,提高了黄腐酸产量。实验中还发现,当BFA02、BFA03、季也蒙酵母、长枝木霉4株菌株复配后,其各项性能低于复合菌剂3。分析原因,可能是由于复配菌剂各菌株之间的拮抗作用引起的。有研究报道木霉对其他真菌具有多种拮抗作用,诸如产生抗生物质、营养争夺及产生几丁质酶等[22]。另一原因,也可能是由于BFA02、BFA03、季也蒙酵母及长枝木霉4种菌株各按2.5%的接种量接入,单菌起始菌量较低,延滞期长,最终导致黄腐酸产量较低。
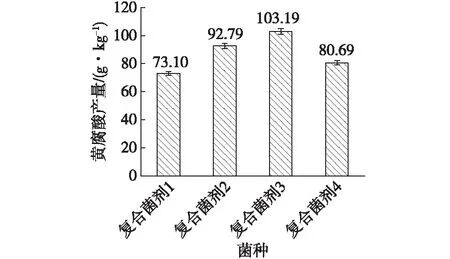
图7 复合菌剂和单菌发酵的黄腐酸产量Fig.7 Fulvic acid production of the mixed cultures and single strain
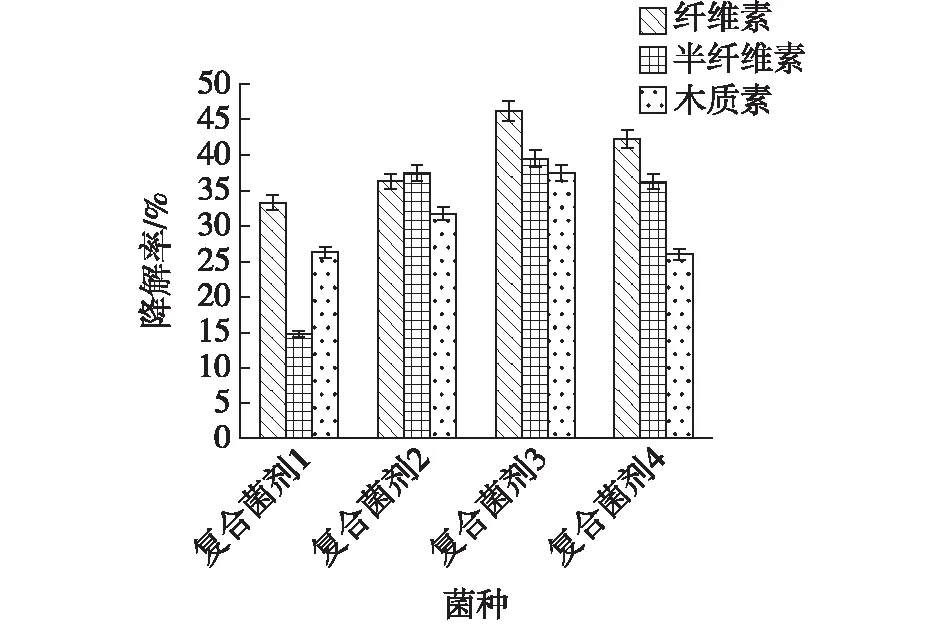
图8 复合菌剂和单菌发酵的木质纤维素降解率Fig.8 Degradation rates of cellulose,hemi-cellulose and lignin by the mixed cultures and single strain
3 结论
从腐植酸样品中经分离筛选获得2株具有较好木质纤维素降解能力的黄腐酸生产菌株BFA02和BFA03,其中BFA02菌株是具有良好纤维素和木质素降解能力,BFA03具有良好的半纤维素降解能力。经16SrDNA分类鉴定,初步确认BFA02为解淀粉芽孢杆菌,BFA03为地衣芽孢杆菌。季也蒙酵母、长枝木霉分别与BFA02和BFA03复配后发酵,实验结果表明,长枝木霉、BFA02和BFA03复配构成的复合菌剂3具有较好的木质纤维素降解能力,黄腐酸产量最高可达103.19 g/kg,较BFA02、BFA03单菌发酵分别提高了136%和74%。长枝木霉具有优良的木质纤维素降解能力,与BFA02和BFA03复配,可高效分解底物,提高黄腐酸产量。
因此,筛选优良的复合菌剂对于提高黄腐酸产量意义重大。在我国每年都有数以亿吨的果渣以及其他农产品加工废弃物,这些废弃物量大而且相对集中,资源化利用固体废弃物发酵制取黄腐酸,不仅可以解决环境污染问题,还可促进农业可持续发展,具有很高的经济效益和社会效益。
