灵芝-黄芪双向发酵菌质多糖的分离纯化及生物活性研究
2019-10-10裴智鹏郑雪艳何冰芳储建林
裴智鹏,郑雪艳,何冰芳,储建林
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.常州市第一人民医院,江苏 常州 213003;3. 南京工业大学 药学院,江苏 南京 211800)
双向发酵是运用现代微生物学技术将某种药食兼用真菌作为发酵菌种,接种于含有一定比例中草药成分的药性基质上进行发酵的技术[1]。药用真菌以添加了中草药的药性基质为培养基,吸收中草药中的活性成分,经过药用真菌丰富的酶系以及代谢的作用,会产生新的代谢产物。真菌多糖是从真菌子实体、菌丝体及其发酵产生的代谢产物中提取得到,大多为具有不同的化学结构与特性的杂多糖。研究表明许多药用真菌来源的水提活性多糖具有免疫增强、抑制肿瘤细胞增殖、降血脂以及抗氧化等广泛的生物活性[2]。因此,一般采用离子交换色谱、葡聚糖凝胶色谱等多种方法组合使用进行分离多糖。
灵芝是中国传统的药用真菌之一,已被证明具有保护肝脏、抗肿瘤和免疫调节等作用[2-4],灵芝的水提多糖组分是其中重要的生物活性物质之一。在对灵芝-黄芪双向发酵菌质水提多糖分离的过程中,笔者发现灵芝-黄芪双向发酵体系对灵芝菌发酵分泌多糖的含量有明显的提升作用。因此,笔者对添加黄芪后多糖含量显著增加的灵芝多糖组分PG-1和相对应的未添加黄芪的灵芝多糖组分PG-2进行结构鉴定以及免疫活性、抗肿瘤活性等生物活性研究,以期为传统中药的开发利用提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌株与细胞系
灵芝-黄芪双向发酵菌质是由本实验室成员自制。
巨噬细胞系RAW 264.7来自中国科学院上海生物化学与细胞生物学研究所,人肺腺癌A549细胞和人肝癌细胞系Hep-G2来自美国典型培养物保藏中心(ATCC)。
1.1.2 主要试剂
苯酚、H2SO4、乙醇、NaOH、刚果红均为国产分析纯;标准糖为中国药品生物制品检定。
1.2 发酵菌质多糖的提取、分离和纯化方法
1.2.1 多糖的含量测定
多糖的含量测定采用苯酚-硫酸法[5]。
1.2.2 多糖的提取
发酵菌质水提多糖的提取条件为液料比30∶ 1,提取时间3 h,提取温度91 ℃。提取后过滤,多糖粗提液使用大孔树脂脱色,Sevage法脱蛋白[6],透析除去无机盐和小分子后,浓缩,终体积分数75%乙醇沉淀,无水乙醇洗涤,烘干。
1.2.3 多糖的分离纯化
分别将处理好的添加质量分数12%黄芪未发酵的全性基质的水提多糖、未添加黄芪发酵的菌质多糖和添加12%黄芪发酵的菌质多糖使用DEAE-Sepharose FF进行离子交换层析,蒸馏水洗脱至洗脱液无糖,再利用NaCl溶液进行梯度洗脱得到添加12%黄芪发酵的菌质多糖组分PG-1和未添加黄芪发酵的菌质多糖组分PG-2。
使用Sephadex G-100葡聚糖凝胶柱对PG-1和PG-2组分进行分离,使用去离子水洗脱,进行纯度鉴定。
多糖得率计算见式(1)。

(1)
1.3 分子量及初级结构鉴定方法
1.3.1 分子量测定方法
Waters-1525型高效液相色谱仪,TOSOH公司的TSK-gei G-5000型排阻色谱柱,示差检测器,柱温为30 ℃,去离子水为流动相,流速为0.5 mL/min,进样量为20 μL。
1.3.2 单糖组成分析
高效凝胶渗透色谱法:色谱柱为Bio-Rad Aminex HPX-87H(300 mm×7.8 mm),示差折光检测器,检测器温度为35 ℃,柱温为55 ℃,以5 mmol的稀H2SO4为流动相,流速为0.6 mL/min,进样量为20 μL。
1.3.3 紫外吸收光谱分析
将PG-1和PG-2配制成溶液,置于紫外-可见光分光光度计中,在190 ~400 nm范围内进行全波段扫描。
1.3.4 红外吸收光谱分析
取PG-1和PG-2干燥样品1 mg,置于Thermo ScientificTMNicoletTMiSTM5 FT-IR 光谱仪中,在4 000~400 cm-1范围内进行红外扫描。
1.3.5 糖苷键分析
分别称取PG-1、PG-2样品5 mg,溶解于5 mL NaOH溶液(0.2 mol/L)中,置于恒温水浴锅,45 ℃反应3 h。将反应后的溶液置于紫外-可见光分光光度计中,在190~400 nm范围内进行全波段扫描[7]。
同时称取PG-1、PG-2样品5 mg,溶解于5 mL去离子水中,置于恒温水浴锅中,45 ℃反应3 h。将反应后的溶液置于紫外-可见光分光光度计中,在190~400 nm范围内进行全波段扫描。
1.3.6 三螺旋结构分析
配制40 μmol/L的刚果红溶液,分别称取PG-1、PG-2样品5 mg,溶解于4 mL溶液中。在溶液中滴加1 mol/L NaOH溶液,使溶液的NaOH浓度从0梯度提升至0.5 mol/L,将各碱性梯度的溶液置于紫外-可见光分光光度计中,进行全波段扫描,测定各NaOH浓度下的最大吸收值[8]。
1.4 多糖生物活性
1.4.1 多糖对巨噬细胞的增殖作用
采用四甲基偶氮唑盐微量酶反应比色法(MTT法)考察多糖对RAW264.7增殖的影响。将RAW264.7细胞在96孔板中以5×104个/mL的密度培养在37 ℃、含5%CO2的培养箱中24 h。弃培养基,用培养基配制不同质量浓度的多糖溶液(0、6.25、12.5、25、50和100 μg/mL),100 μL/孔加入细胞,在37 ℃培养箱孵育24 h。每组设6个平行组,同时设置空白调零孔。24 h后,在每孔细胞中加入20 μL现配MTT(5 mg/mL)溶液,继续培养4 h以形成紫色晶体。4 h后将培养基吸出,每孔加入150 μL二甲基亚砜溶解晶体,静置20 min后,用酶标仪在595 nm处测量吸光度。
细胞增殖率按照公式(2)计算[9]。
细胞增殖率=(样品组平行实验的吸光值-正常对照组平行实验的吸光值)/正常对照组平行实验的吸光值×100%
(2)
1.4.2 多糖对巨噬细胞吞噬作用的影响
通过巨噬细胞对中性红的吞噬量估计巨噬细胞RAW264.7细胞的吞噬能力。每孔100 μL RAW264.7巨噬细胞(5×104个/mL)加入96孔板,在37 ℃、含5%CO2的培养箱中培养48 h。用培养基配制不同浓度多糖(0、6.25、12.5、25、50和100 μg/mL)和LPS(1 μg/mL)溶液,吸出培养基,每孔100 μL,加入多糖溶液和LPS对照,再加入生理盐水配制的0.075%中性红100 μL/孔,在37 ℃、含5%CO2的培养箱中培养1 h。每组设6个平行组,同时设置空白调零孔。弃去培养基,用PBS(pH 7.2~7.4)洗涤巨噬细胞2次。然后加入细胞裂解液100 μL/孔,在常温下轻微振荡10 min。使用酶标仪测量570 nm处的吸光度[10]。
按照式(2)计算巨噬细胞吞噬中性红的增长率。
增长率=(样品组平行实验的吸光值-正常对照组平行实验的吸光值)/正常对照组平行实验的吸光值×100%
(3)
1.4.3 多糖对巨噬细胞的保护作用
采用MTT法考察多糖对RAW264.7的保护作用。将RAW 264.7细胞在96孔板中以5×104个/mL的菌密度在37 ℃、含5%CO2的培养箱中培养24 h。然后将100 μL/孔多柔比星(DOX)(5×10-3μmol/mL)加入含有不同浓度多糖和LPS的细胞中,37 ℃孵育24 h,每组设6个平行组,同时设置空白调零孔。24 h后,在细胞中加入20 μL MTT(5 mg/mL)培养4 h以形成紫色晶体。吸去培养基,每孔加入150 μL二甲基亚砜溶解晶体,静置20 min后用酶标仪在595 nm处测量吸光度[9]。
1.4.4 多糖对人肺腺癌细胞A549和人肝癌细胞Hep-G2肿瘤细胞增殖的抑制作用
采用MTT法考察多糖对人肺腺癌细胞A549和人肝癌细胞Hep-G2肿瘤细胞增殖的抑制作用。用DMEM培养基将HepG-2和A549细胞稀释至5×104个/mL,按100 μL/孔将细胞加入96孔板,在37 ℃、含5%CO2的培养箱中培养24 h,24 h之后吸去培养基,加入不同浓度的多糖,分别培养24、48和72 h。每组设6个平行组,同时设置空白调零孔。24、48和72 h后在细胞中加入20 μL MTT(5 mg/mL)温育4 h以形成紫色晶体。吸去培养基,每孔加入150 μL二甲基亚砜溶解晶体,静置20 min后用酶标仪在595 nm处测量吸光度[9,11]。
按照式(4)计算多糖对肿瘤细胞增殖的抑制率。
抑制率=(对照组平行实验的吸光值-样品组平行实验的吸光值)/对照组平行实验的吸光值×100%
(4)
2 结果与讨论
2.1 灵芝-黄芪双向发酵菌质多糖的提取、分离和纯化
2.1.1 多糖的DEAE离子交换柱层析分离结果
收集全性基质水提多糖、未添加黄芪发酵的菌质水提多糖和添加12%黄芪发酵的菌质水提多糖各级分洗脱液,经过旋蒸浓缩,透析除盐后冷冻干燥,各级分得率如表1所示。
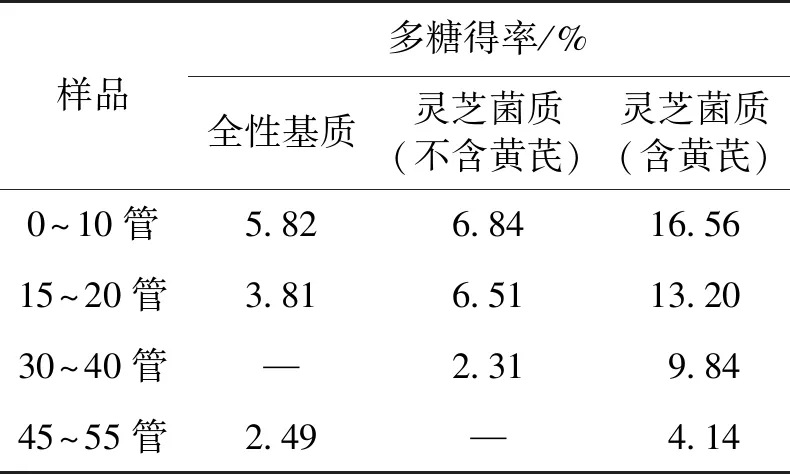
表1 样品各洗脱级分多糖得率
图1~3为3种菌质水提多糖梯度洗脱曲线。由图1~3结果比较,发现0.50 mol/L NaCl浓度洗脱组分峰(45~50管)仅添加黄芪后才出现,因此推测为黄芪本身含有的多糖组分;图2中的0.35 mol/L(32~35管)NaCl浓度洗脱组分峰PG-2,图3中的0.35~0.40 mol/L(31~41管)NaCl浓度洗脱组分峰PG-1为灵芝菌发酵后才出现,因此推测PG-1和PG-2为灵芝菌发酵产生的多糖;根据各级分得率可知,添加12%黄芪发酵的菌质比未添加黄芪发酵的菌质在各多糖组分含量上均有增加,说明添加黄芪对于灵芝菌发酵分泌多糖有促进作用。尤其是推测为灵芝菌发酵产生的多糖组分,添加12%黄芪发酵的菌质多糖中的PG-1组分相较于未添加黄芪发酵的菌质多糖中的PG-2组分增加了325%的产量。选择多糖PG-1和PG-2,进一步使用Sephadex G-100葡聚糖凝胶柱色谱进行纯化。
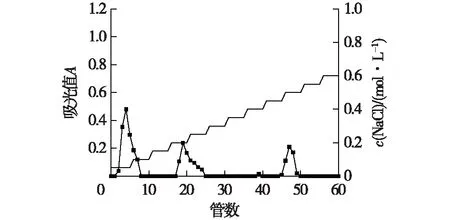
图1 全性基质水提多糖梯度洗脱曲线Fig.1 Elution curves of polysaccharide of fermentation medium
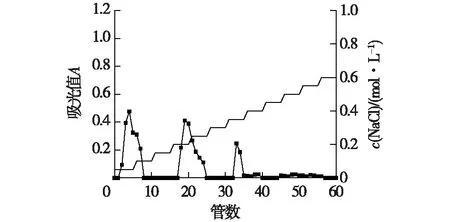
图2 未添加黄芪发酵的菌质多糖梯度洗脱曲线Fig.2 Elution curves of polysaccharide without Astragalus
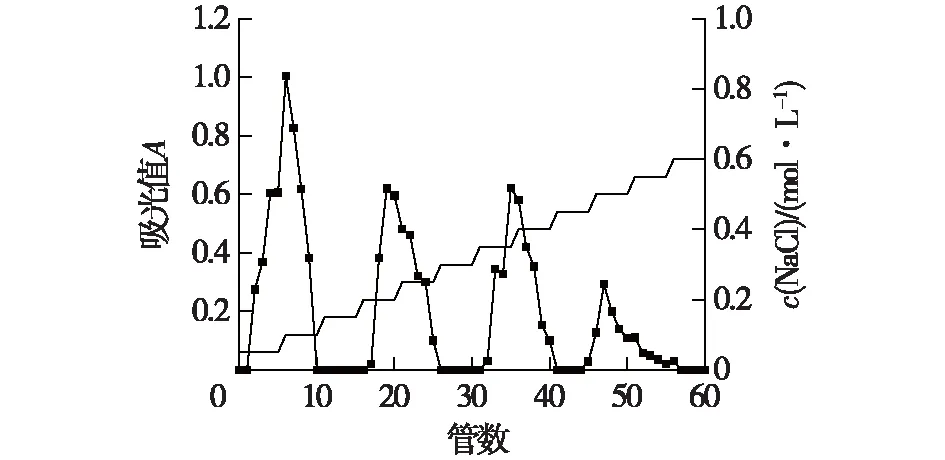
图3 添加12%黄芪发酵的菌质多糖梯度洗脱曲线Fig.3 Elution curves of polysaccharide with 12% Astragalus
2.1.2 多糖的葡聚糖凝胶柱层析分离结果
将PG-1组分和PG-2组分透析脱盐、冷冻干燥后,通过进样器加到Sephadex G-100葡聚糖凝胶柱色谱进行纯化,使用去离子水作洗脱液,洗脱曲线为单一的对称的洗脱峰,证明PG-1和PG-2为分子量相对均一的多糖。
2.2 分子量测定及初级结构鉴定
2.2.1 分子量测定
根据样品洗脱峰的保留时间和标准曲线方程:y=7.090 3x2-148.64x+786.74,可以得到PG-1组分的分子量约为9.2×104,PG-2组分的分子量约为8.9×104。
2.2.2 单糖组成分析
图4为葡萄糖醛酸、岩藻糖、葡萄糖、木糖和阿拉伯糖5种单糖混合标准品的HPLC图。图5为多糖PG-1和PG-2水解后的HPLC图。由图4~5可知,PG-1组分和PG-2组分的单糖组成成分都由葡萄糖醛酸、葡萄糖、木糖和阿拉伯糖4种组成。
各单糖组成比例如表2所示。
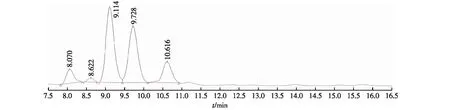
图4 葡萄糖醛酸、岩藻糖、葡萄糖、木糖和阿拉伯糖5种单糖混合标准品HPLC图Fig.4 HPLC of glucuronic acid,fucose,glucose,xylose and arabinose
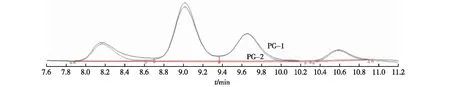
图5 多糖PG-1和PG-2水解的HPLC图Fig.5 HPLC of PG-1 and PG-2

表2 PG-1和PG-2水解单糖组分所占比例
2.2.3 紫外吸收光谱
PG-1和PG-2的紫外吸收光谱如图6、图7所示。由图6和7可知,在260或280 nm波长附近无明显吸收峰,因此推断纯化后的PG-1和PG-2基本不含蛋白质或核酸。
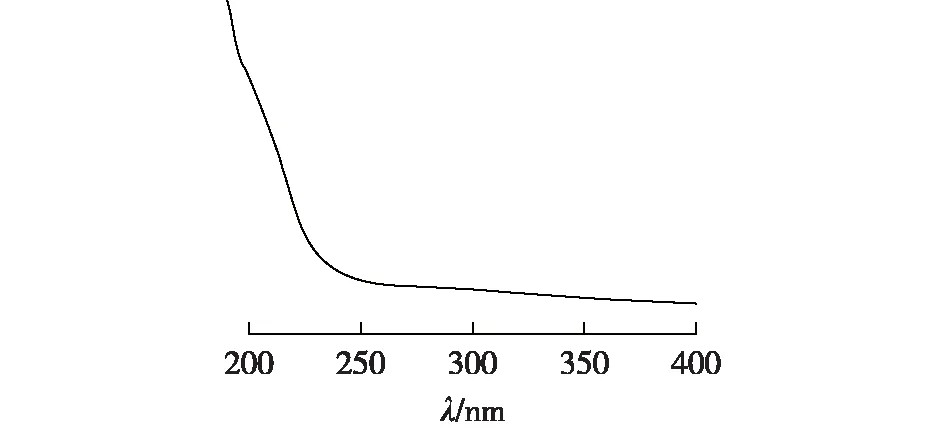
图6 多糖PG-1水溶液的紫外-可见光谱图Fig.6 UV-vis spectrum of PG-1
2.2.4 红外吸收光谱

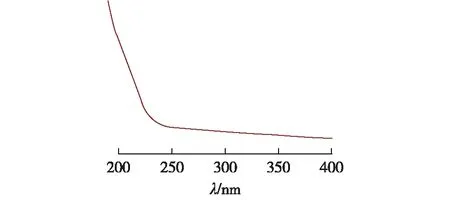
图7 多糖PG-2水溶液的紫外-可见光谱图Fig.7 UV-Vis spectrum of PG-2
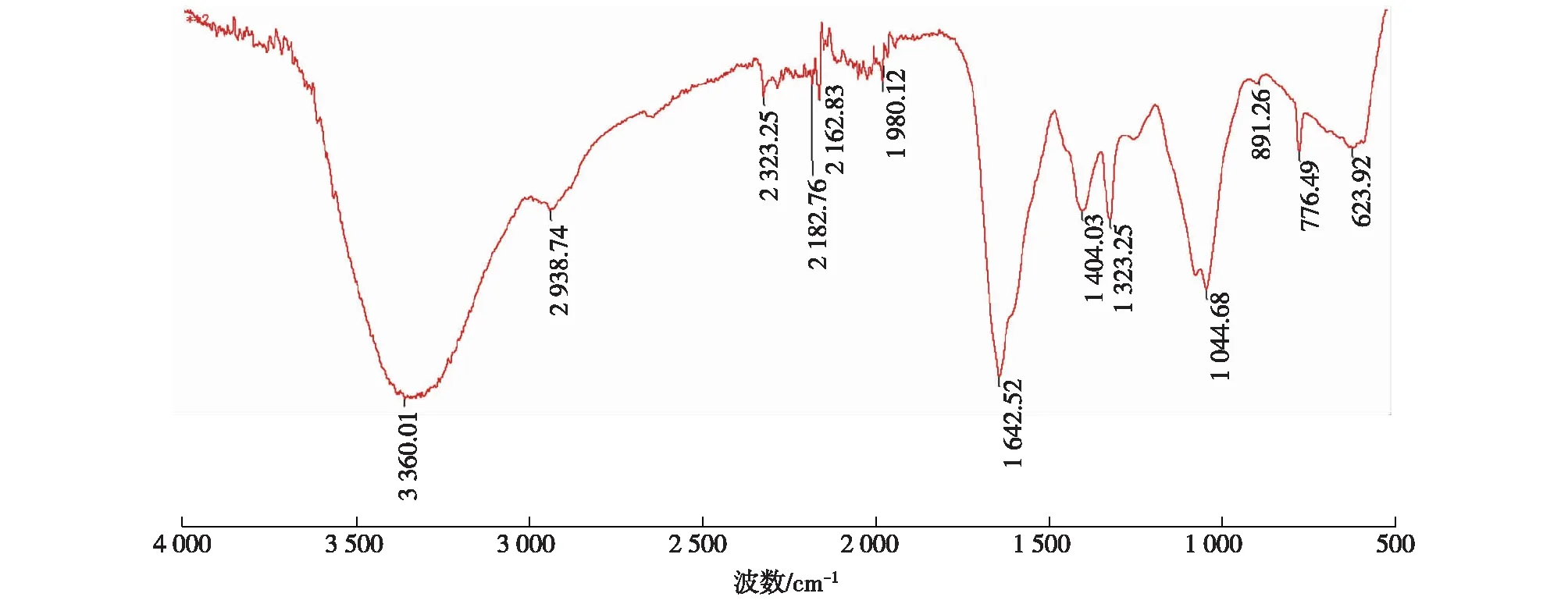
图8 多糖PG-1的红外光谱图Fig.8 Infrared spectrum of PG-1
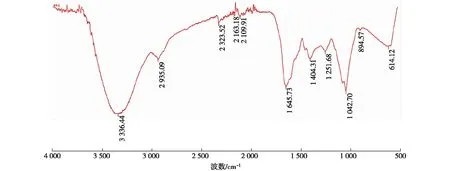
图9 多糖PG-2的红外光谱图Fig.9 Infrared spectrum of PG-2
2.2.5 糖苷键分析
根据1.3.5节的分析方法,经过0.2 mol/L NaOH处理后的PG-1、PG-2与其水溶液紫外吸收光谱相比,在240 nm处均有吸收增强,说明PG-1和PG-2糖链间都含有—O—糖苷键[8]。
2.2.6 三螺旋结构分析
根据1.3.6节的分析方法,对PG-1和PG-2进行糖苷键分析,结果如图10所示。由图10可知:在一定NaOH浓度范围内,PG-1和PG-2与刚果红形成络合物的最大吸收波长缓慢减小,而当NaOH浓度增加至一定浓度,高浓度的NaOH破坏分子间的作用力,三螺旋结构间的氢键等作用力被破坏,造成最高吸收波长的急剧下降。因此推断PG-1和PG-2均具有三螺旋构象的三级结构。PG-2组分在0.25 mol/L NaOH浓度处三螺旋结构解体,而PG-1组分则在0.3 mol/L NaOH浓度处三螺旋结构才解体,因此,添加黄芪发酵的菌质多糖中的PG-1组分的三螺旋结构比未添加黄芪发酵的菌质多糖中的PG-2组分更加稳定。
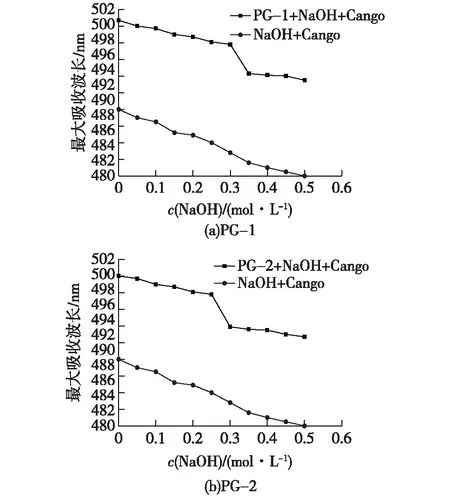
图10 NaOH对PG-1、PG-2与刚果红形成络合物的最大吸收波长的影响Fig.10 Effects of NaOH on the maximum absorption wavelength of PG-1, PG-2 and Congo red complexes
2.3 多糖生物活性
2.3.1 多糖对巨噬细胞的增殖作用
采用MTT法考察PG-1和PG-2对RAW 264.7巨噬细胞的细胞增殖能力的影响,结果如图11所示。
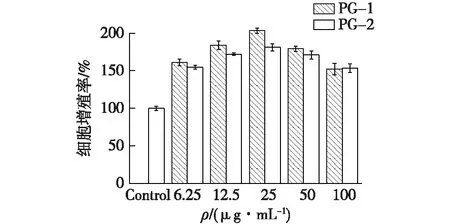
图11 多糖PG-1和PG-2对巨噬细胞增殖作用的影响Fig.11 Effects of PG-1 and PG-2 on proliferation of RAW264.7
由图11可知:以未添加样品的对照组细胞的活力为对照,PG-1和PG -2的加入在6.25~100 μg/mL范围内无细胞毒性,并可表现为促RAW 264.7细胞增殖的作用。在6.25~25 μg/mL范围内,RAW264.7细胞的增长趋势呈剂量依赖性。质量浓度为25 μg/mL时,PG-1和PG-2的增殖率均最高,相对于Control组,PG-1对RAW264.7细胞增殖率提升了103%,PG-2对RAW264.7细胞增殖率提升了81%。随着剂量的增加,增殖比逐渐下降。推测该趋势与渗透压有关。低浓度的多糖可以提供巨噬细胞营养物质,促进其增殖,但随着浓度的提升,增加的渗透压会减缓巨噬细胞的增殖效果。总体而言,添加黄芪发酵的菌质多糖中的PG-1组分作用在巨噬细胞RAW 264.7中表现出比未添加黄芪发酵的菌质多糖中的PG-2组分更强的增殖能力。
2.3.2 多糖对巨噬细胞吞噬作用的影响
PG-1组分和PG-2组分对巨噬细胞吞噬中性红能力的影响结果见图12。从图12可以看出,阳性对照LPS显示了巨噬细胞吞噬中性红能力的增强作用,相对于Control组,其吞噬中性红的量增加了193%。笔者同时观察到PG- 1和PG-2对巨噬细胞吞噬功能的影响存在剂量依赖性的增长趋势,在PG-1和PG-2质量浓度为100 μg/mL时,PG- 1和PG-2对巨噬细胞吞噬功能的影响与阳性对照LPS相近,相对于Control组,其吞噬中性红的量分别增加了173%和156%。结果表明,PG-1组分和PG-2组分可增强巨噬细胞吞噬病原体或肿瘤细胞等外来物质的功能,而添加黄芪发酵的菌质多糖中的PG-1组分在促进RAW264.7细胞巨噬细胞吞噬功能上显示出比未添加黄芪发酵的菌质多糖中的PG-2组分更强的增强效果。
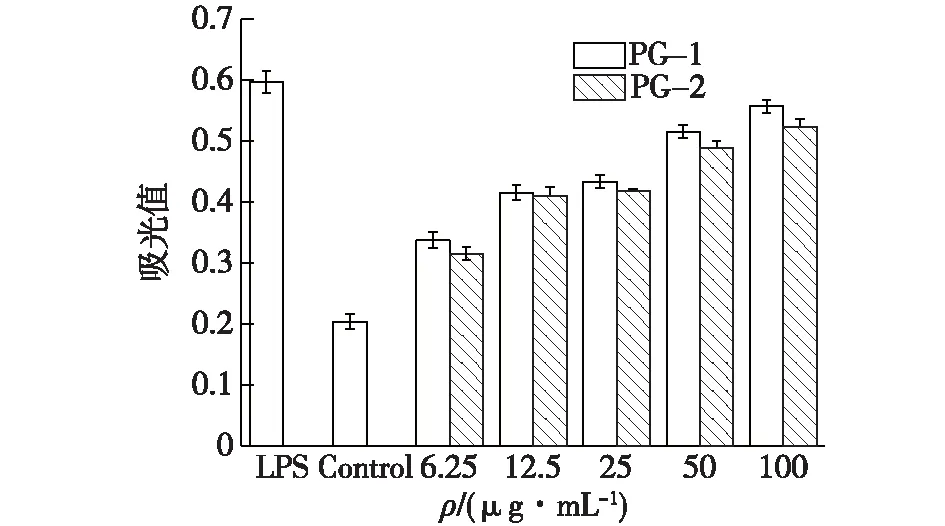
图12 多糖PG-1和PG-2对巨噬细胞吞噬中性红作用效果比较Fig.12 Effects of PG-1 and PG-2 polysaccharides on macrophage phagocytic neutral red
2.3.3 多糖对巨噬细胞的保护作用
多糖对巨噬细胞的保护作用结果如图13所示,不同浓度的多糖作用在被DOX处理过的细胞时,均对巨噬细胞有保护作用。从图13可以看出:PG-1和PG-2在25 μg/mL时对巨噬细胞的保护作用显着增强,在50 μg/mL时达到最大活性,此时PG-1组分作用的巨噬细胞存活率为92.0%,相较于DOX组,存活率增长了56%;PG-2组分作用的巨噬细胞存活率为89.6%,相较于DOX组,存活率增长了53.6%。已报道抗肿瘤化疗药物DOX具有促氧化剂活性的副作用,会降低巨噬细胞的存活率[12],笔者推测纯化后的多糖能够通过降低巨噬细胞活性氧水平,减弱DOX对RAW264.7巨噬细胞的促氧化剂活性,从而提升巨噬细胞的存活率。
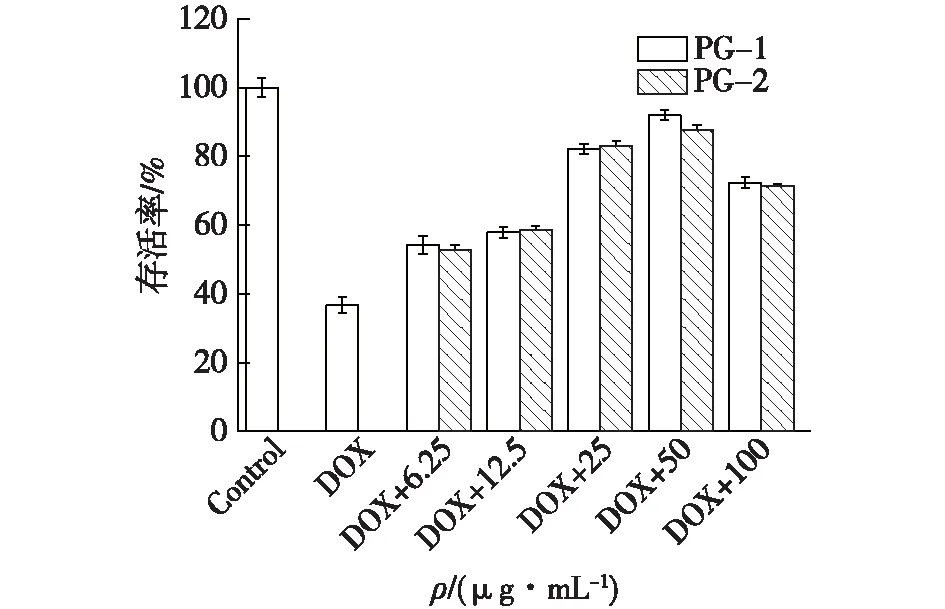
图13 多糖PG-1和PG-2对巨噬细胞保护作用效果比较Fig.13 Comparison of protective effects of polysaccharides PG-1 and PG-2 on macrophage
2.3.4 多糖对人肺腺癌细胞A549和人肝癌细胞Hep-G2肿瘤细胞增殖的抑制作用
多糖对人肺腺癌细胞A549和人肝癌细胞Hep-G2肿瘤细胞增殖的抑制作用结果测定如图14~15所示。由图14~15可知,PG-1和PG-2对人肺腺癌A549细胞和人肝癌细胞系Hep-G2有类似的抑制作用。在6.25~50 μg/mL范围内,抑制作用呈剂量依赖性,随着培养时间的延长,抑制作用减弱。这与Li等[9]用羊肚杆菌发酵大豆残渣分离的多糖对HEP-G2细胞增殖的抑制效果相似。
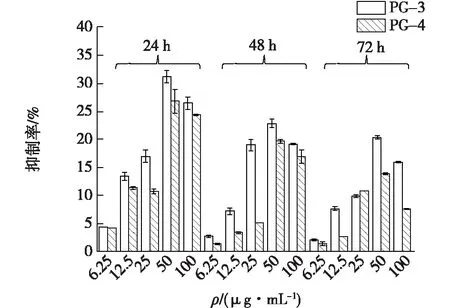
图14 PG-1和PG-2在不同时间和剂量下对A549细胞的抑制作用Fig.14 Inhibitory effect of PG-1 and PG-2 on A549 cells at different times and doses
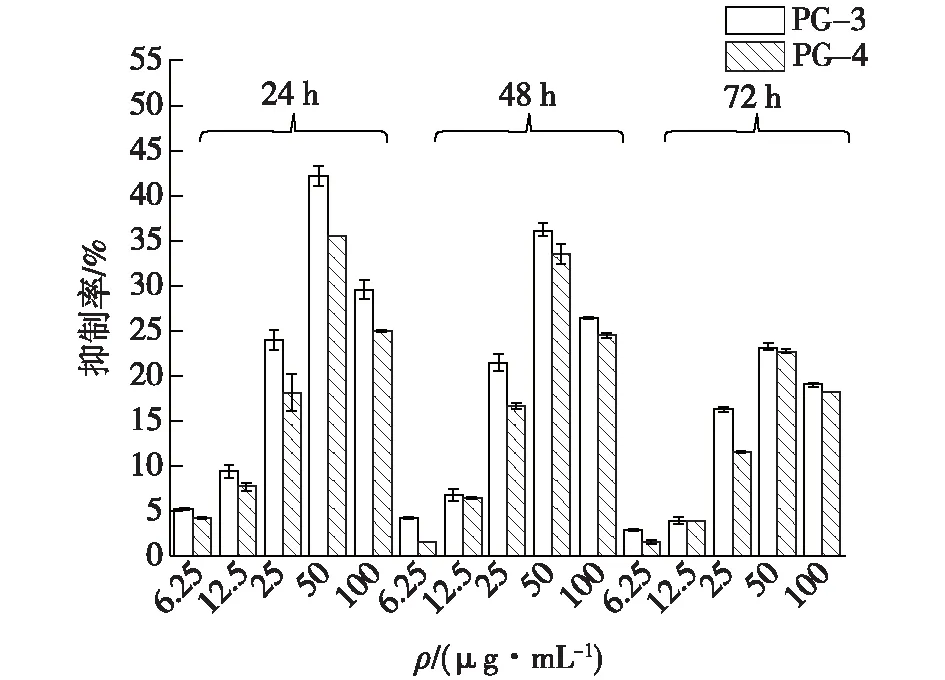
图15 PG-1和PG-2在不同时间和剂量下对HepG-2细胞的抑制作用Fig.15 Inhibitory effect of PG-1 and PG-2 on HepG-2 cells at different times and doses
在培养24 h实验组,质量浓度为50 μg/mL的PG-1和PG-2对A549的抑制率分别为31%和26%。相同条件下,PG-1和PG-2对于Hep-G2抑制率分别为42%和35%,因此,PG-1和PG-2对这两株肿瘤细胞的增殖都表现出了明显的抑制效果;而48 h和72 h后,PG-1和PG-2对A549的抑制率分别下降到23%、19%和20%、13%;PG-1和PG-2对Hep-G2的抑制率分别下降到36%、33%和23%、22%,这种多糖不同浓度,不同治疗持续时间作用于肿瘤细胞而产生不同抑制效果的现象与Zhang等[13]液体发酵的灵芝多糖的抗肿瘤效果类似。
从整个实验结果看来,PG-1对A549和Hep-G2细胞增殖的抑制作用较PG-2更强。
3 结论
灵芝黄芪双向发酵菌质灵芝多糖组分PG-1和未添加黄芪的灵芝菌发酵菌质灵芝多糖组分PG-2都由葡萄糖醛酸、葡萄糖、木糖和阿拉伯糖4种组成,单糖组分摩尔比分别为12∶ 58∶ 21∶ 9和16∶ 41∶ 32∶ 11,分子量分别为9.2×104和8.9×104,由β-糖苷键连接,存在有O-糖苷键,含有三螺旋分子链链型的分子量相对均一的多糖。多糖PG-1和PG-2的单糖组分比例和分子量存在差异,说明灵芝黄芪双向发酵体系对灵芝菌质多糖的结构产生了一定的影响。添加12%黄芪发酵的菌质多糖中的PG-1组分相较于未添加黄芪发酵的菌质多糖中的PG-2组分在多糖得率上增加325%,说明添加黄芪可以促进灵芝菌多糖的分泌。
体外细胞实验结果显示PG-1和PG-2对巨噬细胞增殖作用、巨噬细胞对中性红的吞噬作用、巨噬细胞的保护作用和对肿瘤细胞增殖的抑制作用都具有明显的促进作用。在细胞实验中,添加黄芪的双向发酵菌质多糖组分PG-1显示出比未添加黄芪的灵芝多糖组分PG-2更强的免疫增强活性和对肿瘤细胞增殖的抑制作用,说明添加黄芪可以增强菌质多糖的免疫活性和抗肿瘤活性。
灵芝中的活性物质除了灵芝多糖外,还包括灵芝三萜、灵芝酸等其他化合物,黄芪中也含有黄芪皂苷等活性物质,这些物质在双向发酵体系中,都可能被灵芝菌丰富的酶系统和代谢网络所作用,改变其原有的组成成分,扩大本身的药效,如抗氧化能力、免疫调节能力等。笔者对灵芝黄芪双向发酵产物仅限于对其中菌质多糖的研究,在今后的实验中将会着重研究双向发酵体系对三萜类、皂苷类等活性物质的影响。
