基于A型塞尼卡病毒结构蛋白VP1间接ELISA检测方法的建立及初步应用
2019-10-10赵月龙闫若潜王淑娟马震原班付国赵雪丽谢彩华杨朋霞
赵月龙,闫若潜,王淑娟,马震原,班付国,赵雪丽,谢彩华,杨朋霞
(1.河南科技大学动物科技学院,河南洛阳471003;2.河南省动物疫病预防控制中心,河南郑州450008;3.河南农业大学牧医工程学院,河南郑州450002)
猪塞尼卡病毒病是由A 型塞尼卡病毒(Senecavirus A,SVA)引起的一种猪水泡病。SVA 最早被称作塞内卡谷病毒A (Seneca Valley virus SVV),2015 年国际病毒分类委员会(ICTV)将其列入小RNA 病毒科塞内卡病毒属,SVA 与同科的心肌炎病毒属成员同源性最接近[1-2]。SVA 引起仔猪腹泻,经产母猪和公猪鼻、上颚、口腔、唇部和蹄冠周围出现小泡和溃疡,偶发腹泻症状,1 日龄~3日龄的新生仔猪死亡率可达30 %~70 %[1-3],给养猪业造成严重的经济损失。迄今为止,美国、巴西、哥伦比亚、泰国等国家均报道发生过该病[3-6]。2015 年Wu 等报道在我国广东省首次检测出该病毒,并命名为CH-01-2015[7]。2016 年至今,我国湖北、河南、福建和黑龙江等省陆续发生SVA 疫情[8-11]。由于SVA 是国内新出现的病毒,且目前国内外对SVA 的认识及研究较少,一旦大规模暴发必定会给养殖业带来严重的经济损失。我国农业农村部制定的《2018 年兽医工作要点》 中明确提出要做好塞内卡病毒病等新传入疫病的防治工作,并且专门下发了《农业农村部办公厅关于加强塞内卡谷病毒防治的通知》。
由于SVA 感染猪以后引起的临床症状与口蹄疫、猪水泡病和水泡性口炎等难以区分,仅凭借临床症状和病理剖检难以诊断猪塞卡病毒病。目前国内外尚无检测该病的商品化试剂盒。病毒分离鉴定是最常用的病原学检测方法,但该方法操作繁杂,检测周期长;PCR 及荧光定量PCR 检测方法成本较高,仪器设备价格高昂,难以在基层推广应用;ELISA 方法具有操作简便、敏感性高、适于大规模样品检测的优点,是实验室常用的检测方法。目前国内外均无SVA 的商品化疫苗使用,因此检测血清抗体可以用于评价猪体的感染状况;当前国内尚无商品化检测该病毒的ELISA 方法和试剂可用[12]。
SVA 结构蛋白VP1 和VP3 是主要的抗原表位区域,VP1 蛋白的抗原性强、相对保守[13],可以刺激机体产生中和抗体,可以作为检测SVA 抗体的指示抗原,为塞尼卡病毒病的诊断提供了方法[14]。因此,本研究重组表达了有活性的可溶性SVA-VP1(rVP1)蛋白并以其作为包被抗原建立了间接ELISA方法,为临床上SVA 抗体检测提供一种血清学检测方法。
1 材料与方法
1.1 主要实验材料 SVA、BHK21 细胞、灭活SVA 免疫小鼠血清由河南省动物疫病预防控制中心实验室保存并提供;FMDV (O/A/Asia I)阳性血清为中国农业科学院兰州兽医研究所生产的液相阻断ELISA 检测试剂盒中的阳性对照血清,PEDV、PCV2 阳性血清分别为加拿大Bio-Vet 公司、武汉科前生物股份有限公司生产的间接ELISA 试剂盒中阳性对照血清,PRRSV、PRV 阳性血清为美国爱德士(IDEXX)公司ELISA 试剂盒中的阳性对照血清,以上阳性血清共来自于5 个不同批次的试剂盒。50 份SVA 阴性猪血清采自临床健康猪,经PCR 和中和试验检测结果均为阴性;33 份SVA 灭活疫苗免疫的猪血清(SVA 阳性血清)由河南省动物疫病预防控制中心实验室提供;205 份临床猪血清来自河南省不同地区7 个规模化养猪场,由河南省动物疫病预防控制中心实验室提供。
JM109、BL21 (DE3+)、DNA 凝胶纯化试剂盒、质粒快速提取试剂盒、随机反转录试剂盒、BCA Protein Assay Kit 均购自宝生物工程(大连)有限公司;T4 连接酶、限制性内切酶、TaqDNA 聚合酶购自NEB 公司;IPTG 购自Sigma 公司;磁珠法全自动核酸提取试剂盒购自西安天隆科技有限公司;表达载体pET-32a(+)购自优宝生物;His 标签蛋白纯化试剂盒(可溶性蛋白)购自世纪康维生物科技有限公司;3,3',5,5'- 四甲基联苯胺(TMB)、western blot 试剂盒购自北京索莱宝科技有限公司;兔抗猪IgG-HRP 购自武汉三鹰生物科技有限公司;山羊抗鼠IgG-HRP购自Abcam 公司;分子量为25 ku 的蛋白质超滤离心管为密理博(Millipore)产品。
1.2 引物设计与合成 参照GenBank 中登录的SVA VP1 基因序列(KT321458.1),利用Primer Premier6.0 软件设计引物(5'-TACGGATCCGATTACACC CTCCGTCTCC-3'/5'-TACGAGCTCAGGGTTGGTCTC GATGTCG-3'),引物5' 端分别插入了保护性碱基和BamHⅠ、SaCⅠ两个酶切位点(下划线),引物由英潍捷基(上海)贸易有限公司合成。
1.3 VP1 基因的扩增及重组表达载体的构建 参照磁珠法全自动核酸提取试剂盒说明书提取SVA 病毒总RNA,反转录为cDNA,以cDNA 为模板扩增VP1 基因片段,PCR 产物经电泳后纯化回收。将纯化产物采用BamHⅠ和SacⅠ酶切后克隆于pET-32a(+)表达载体,经双酶切和测序鉴定后的重组阳性质粒命名为pET32a-VP1。
1.4 rVP1 蛋白的表达、纯化及活性鉴定 将pET32a-VP1 转入BL21 (DE3+)大肠杆菌中,选取阳性菌落在LB (Amp+)中培养至OD600nm0.6~0.8 时,加入终浓度为0.8 mmol/L 的IPTG 诱导6 h。离心收集菌体,超声裂解后离心分别取上清和沉淀进行SDS-PAGE 电泳。采用His 标签蛋白纯化试剂盒(可溶性蛋白)纯化上清中的rVP1 蛋白,之后通过分子量25 ku 蛋白质超滤离心管对rVP1 蛋白超滤浓缩,采用BCA 试剂盒测定浓缩后的重组蛋白浓度。以灭活的SVA 免疫小鼠血清(1∶200 稀释)为一抗,山羊抗鼠IgG-HRP 为二抗,进行western blot 鉴定,以确定rVP1 蛋白与SVA 血清的反应原性,设空载体转化菌为阴性对照。
1.5 ELISA 最佳工作条件的优化 采用矩阵法,分别对纯化的rVP1 蛋白的包被浓度(0.5 μg/mL、1 μg/mL、2 μg/mL、4 μg/mL)、封闭时间(37 ℃,2 h 和4 ℃过夜)、样品稀释倍数(1∶25、1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600)、包被液为碳酸盐缓冲液,4 ℃过夜、兔抗猪IgG-HRP(1∶5 000、1∶10 000)稀释,反应时间(37 ℃,0.5 h、1 h)、TMB 显色时间(8 min、10 min、15 min)等进行优化,以确定ELISA 的最佳反应条件。
1.6 临界值的确定 采用确定的最佳工作条件检测50 份SVA 阴性猪血清,每个样品做3 个重复,计算OD450nm值的标准方差。计算公式为:阴阳性临界值=阴性OD450nm平均值+3 倍标准差。
1.7 特异性试验 利用优化后的ELISA 方法对FMDV (O/A/Asia I)、PEDV、PCV2、PRRSV、PRV各5 份阳性血清及SVA 阳性血清进行检测,分析其特异性。
1.8 敏感性试验 随机选取3 份SVA 阳性血清按照1∶50、1∶100、1∶200、 1∶400、1∶800、1∶1 600 稀释后,采用纯化后的ELISA 方法检测,每个样品3次重复,计算OD450nm值,根据实验结果判断该方法的敏感性。
1.9 重复性试验 采用同一批次包被的ELISA 反应板对10 份猪血清样品(SVA 阳性、阴性血清各5份)进行检测,每份样品重复检测3 次;同时采用3个不同批次的ELISA 反应板重复以上试验,根据以上检测结果计算批内和批间变异系数。
1.10 符合率试验 利用血清中和(VN)试验与本研究建立的ELISA 方法同时对43 份猪血清(33 份来自免疫猪血清,10 份来自健康猪血清)进行检测。计算本研究与VN 试验的符合率[15]。
1.11 临床样品检测 利用建立的ELISA 方法检测205 份临床猪血清样品,每个样品重复3 次,取OD450nm值平均值作为每个样品检测结果。
1.12 统计学处理 实验数据采用SPSS 20 软件分析,实验数据差异性分析采用t检验或者ANOVA分析,采用方差分析各组间的差异性比较。
2 结 果
2.1 VP1 基因的扩增及重组表达载体的构建 PCR扩增产物经电泳检测,在约900 bp 处出现目的条带,与预期VP1 基因大小相符。pET32a-VP1 经双酶切鉴定,在约900 bp 处有一条目的条带(图1)。经测序比对分析,与GenBank 中SVA VP1 同源性99%以上。表明重组质粒构建正确。
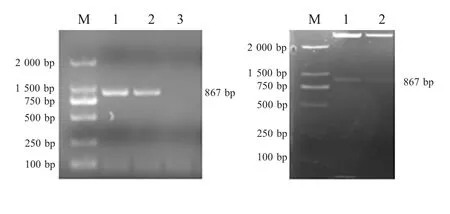
图1 VP1 基因的扩增及pET32a-VP1 的酶切鉴定Fig.1 PCR amplification of SVA VP1 gene and restrictive enzyme digestion of recombinant pET32a-VP1 plasmid
2.2 rVP1 蛋白的表达、纯化及活性鉴定 pET32a-VP1/BL21 经诱导表达后利用SDS-PAGE 进行检测,结果显示,rVP1 以包涵体和可溶性表达两种形式存在(图2)。对可溶性蛋白经纯化浓缩后SDS-PAGE检测显示在51.0 ku (包括表达载体约18 ku 的标签蛋白)处有一条纯化蛋白条带,纯度在96 %以上(图3A),BCA 法测定蛋白浓度为1.2 mg/mL。Western blot 检测结果显示51.0 ku 处有特异性条带(图3B),表明该rVP1 蛋白具有好的反应原性。
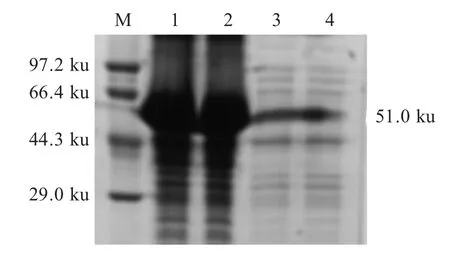
图2 rVP1 蛋白表达的SDS-PAGE 检测结果Fig.2 SDS-PAGE analysis of recombinant VP1 protein
2.3 ELISA 最佳工作条件的优化 间接ELISA 最佳工作条件见表1,包被液为碳酸盐缓冲液4 ℃过夜。
2.4 临界值的确定 利用SPSS.20 对50 份SVA 阴性猪血清OD450nm进行正态分布分析,数据介于0.098~0.269,计算OD450nm的平均值为0.196,标准差为0.029,经计算阴阳性样品的临界值为0.283。
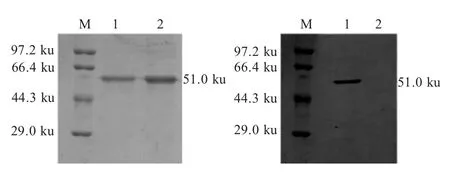
图3 纯化的rVP1 蛋白的SDS-PAGE(A)及western blot(B)分析Fig.3 Analysis of the purified recombinant VP1 protein by SDS-PAGE (A)and western blot (B)
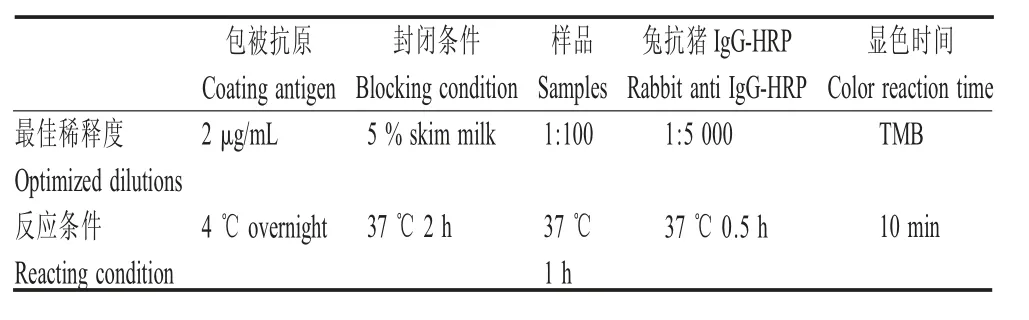
表1 间接ELISA 最佳工作条件优化结果Table 1 Results of optimal working conditions for indirect ELISA
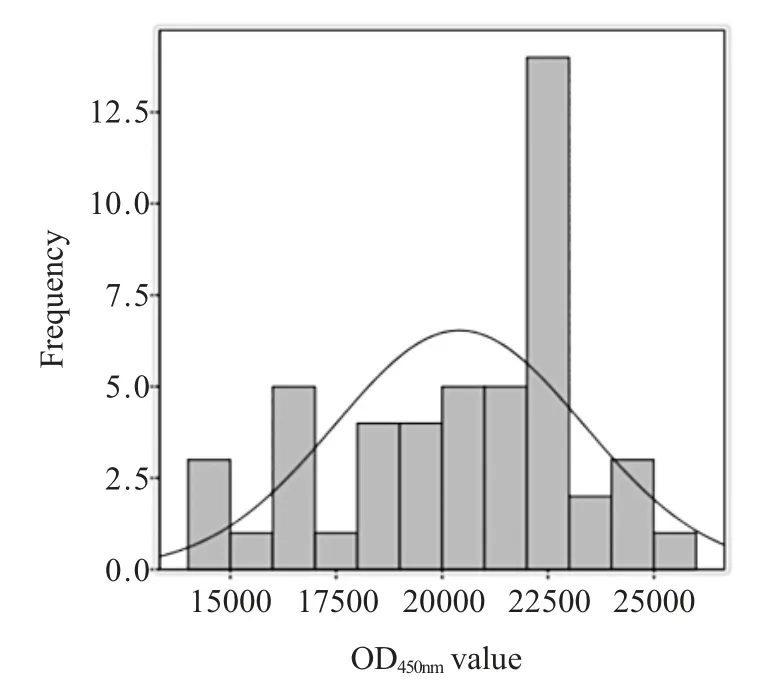
图4 阴性样本正态分布OD450nm 分析Fig.4 Analysis of negative samples
2.5 特异性试验结果 采用建立的ELISA 方法对FMDV (O/A/AsiaI)、PEDV、PCV2、PRRSV、PRV各5 份阳性血清检测结果均为阴性,而对SVA 阳性血清检测结果为阳性,且阴阳性对照均成立(表2),表明该方法具有较强的特异性。
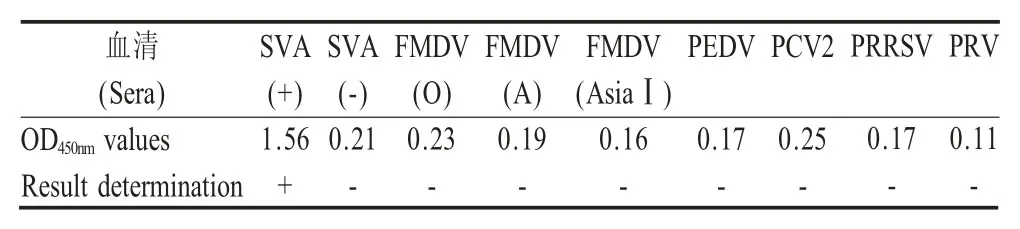
表2 间接ELISA 方法的特异性试验结果Table 2 Results of specificity test of indirect ELISA
2.6 敏感性试验结果 利用建立的ELISA 方法检测不同稀释倍数的SVA 阳性血清,结果显示,经800 倍稀释后,检测结果仍然大于试验确立的临界值,而经1 600 倍稀释后,样品的OD450nm低于临界值,因此,确定该方法的敏感性为1∶800 (图5)。表明该检测方法的敏感性较高。

图5 敏感性试验结果Fig.5 Sensitivity analysis of the indirect ELISA
2.7 重复性试验结果 分别选取5 份SVA 阳性血清和5 份SVA 阴性血清进行批内和批间重复性试验,结果显示批内变异系数为1.56 %~3.24 %,批间变异系数为4.78 %~7.76 %,均小于10 % (表3)。表明该检测方法重复性较好。
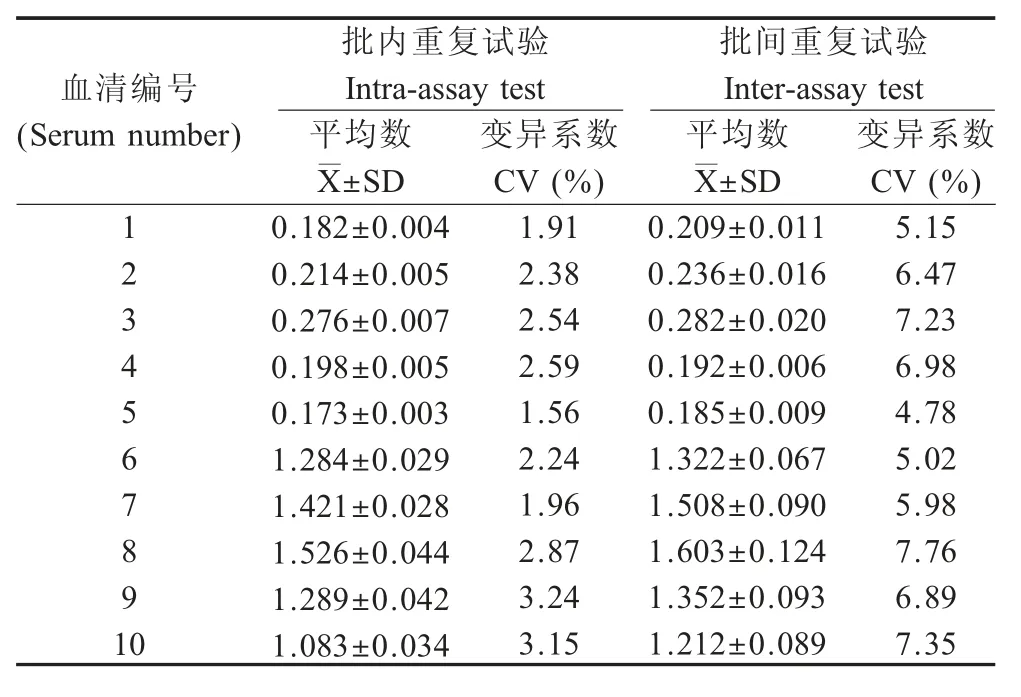
表3 间接ELISA 方法的重复性试验结果Table 3 Results of reproducibility test of the indirect ELISA
2.8 符合率试验结果 采用血清VN 试验从43 份猪血清样品中检测出阳性血清样品33 份,阴性血清样品10 份;采用建立的ELISA 方法检测出阳性血清样品30 份,阴性血清样品13 份。两种方法检测结果一致的样品数是40 份,本研究建立的ELISA方法与VN 试验符合率为93.02 % (表4),表明该方法与VN 试验符合率较高。
2.9 临床样品检测情况 对205 份临床猪血清进行检测,每份血清做3 个重复,共检出阳性血清样品11 份,阳性率为5.37 %,表明河南地区存在SVA感染的风险。
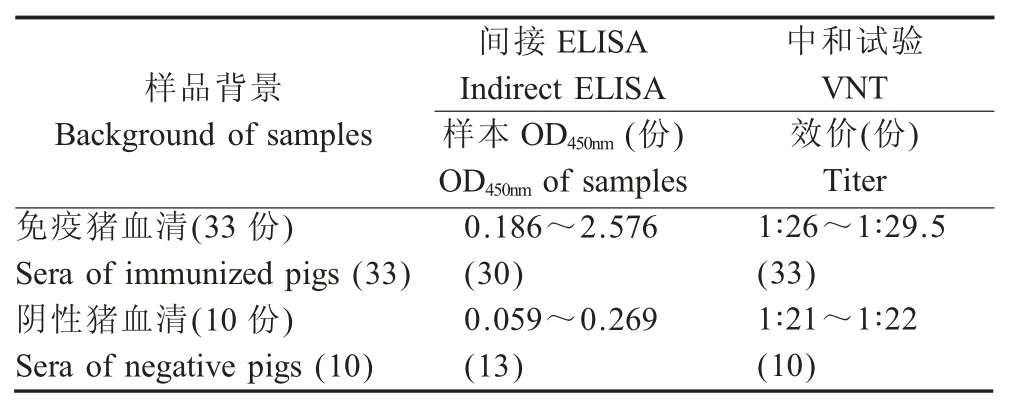
表4 间接ELISA 与中和试验结果的比较及符合率分析Table 4 Comparison between the indirect ELISA and VN test result
3 讨 论
SVA 自2015 年传入我国以来,在我国呈蔓延势态,因其引起的疫病临床症状与口蹄疫相似,给我国养猪行业带来了潜在危害。目前国内外主要病原学方法有基于5'UTR、3D、VP1 等保守区域的普通RT-PCR 和荧光定量RT-PCR;樊晓旭等人利用重组酶聚合酶扩增技术(RPA)建立了实时荧光检测方法[16];Cheryl 等建立了基于SVA VP2 蛋白的间接ELISA 方法[17]。但国内尚无成熟ELISA 检测方法的报道。因此,研发简便、特异、快速的ELISA 检测方法成为目前迫切需要解决的问题。
pET-32a(+)载体可以表达可溶性和包涵体两种形式的重组蛋白,包涵体需要冗杂的蛋白质变性、复性途径,且变性、复性过程容易导致蛋白失活[18],可溶性表达可以有效避免上述包涵体表达的劣势。本研究以SVA cDNA 为模板,克隆并可溶性表达了SVA 的VP1 蛋白,纯化后的rVP1 纯度大于96 %,其浓度可达1.2 mg/mL,经western blot 分析,可溶性表达的rVP1 蛋白经纯化后与灭活的SVA 免疫小鼠血清具有较好的反应原性。本研究得到的纯化rVP1 蛋白浓度和纯度高、活性好,为进一步开展其它基于SVA rVP1 蛋白的研究奠定了基础。
间接ELISA 检测方法对包被抗原的纯度、浓度及抗体稀释倍数等均有较高的要求,抗原的纯度直接影响反应的特异性,抗原的浓度及抗体稀释倍数直接影响反应的敏感性。本研究建立的ELISA 方法与FMDV (O/A/Asia I)、 PEDV、 PCV2、 PRRSV、PRV 阳性血清均无交叉反应、血清经1∶800 稀释后OD450nm仍大于临界值、批内和批间变异度小,表明建立的ELISA 方法特异性强、敏感性高、稳定性和重复性好。
VN 试验是检测SVA 的金标准。本研究通过对43 份血清进行比较检测,本研究建立的ELISA 方法共检测出阳性血清30 份,而VN 试验检测出阳性血清样品33 份,可能原因是间接ELISA 只针对于VP1 位点,而VN 试验针对的是所有中和抗体。该ELISA 方法与VN 试验的符合率为93.02 %,符合率较高,可以用作SVA 抗体的检测。
由于国内外并无SVA 疫苗防控的报道[16],抗体检测阳性的猪可以作为野毒感染评价的标准。本研究采用建立的ELISA 方法从205 份临床猪血清样品检出11 份阳性,阳性率为5.37 %;流行病学调查显示该11 份阳性血清分别来自于2 个猪场的发病猪,采用本实验室建立的SVA 荧光定量PCR 方法对11 头发病猪水泡液检测结果均为阳性[19];表明本研究建立的SVA ELISA 检测方法可为临床该病的监测诊断提供重要手段。考虑到建立的间接ELISA 方法与VN 试验仍有敏感性的差异,本实验室目前正在同时表达VP2、VP3、VP4 3 种结构蛋白,以期能够通过增加包被抗原的种类来提高该方法的敏感性。
本研究正确表达了具有生物学活性的可溶性SVA rVP1 蛋白,并建立了基于rVP1 蛋白的SVA 抗体间接ELISA 检测方法。经临床初步应用表明,本研究建立的ELISA 方法能够为塞尼卡病毒病的临床监测诊断提供快速、特异、便捷的手段。
