猪流行性腹泻病毒特异性SIgA抗体间接ELISA检测方法的建立及应用
2019-10-10丛广义刘建波时洪艳张鑫陈建飞冯力
丛广义,刘建波,时洪艳,张鑫,陈建飞,冯力*
(1.黑龙江八一农垦大学动物科技学院,黑龙江大庆163319;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室猪消化道团队,黑龙江哈尔滨150069)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)是导致幼龄仔猪腹泻、呕吐,进而脱水死亡的一种肠致病性病毒。1971 年首次在英国报道[1],随后该病毒传播到整个欧洲和一些亚洲国家[2]。最近PEDV 在中国养猪场中广泛流行,仔猪死亡率在80 %~100 % ,大部分在出生后7 d 内死亡,有的在出生几小时后就死亡[3]。PEDV 主要经粪口途径传播,皮肤和黏膜是机体的第一道防线,而黏膜免疫系统中的抗体对防止PEDV 感染至关重要。分泌型IgA (SIgA)抗体为黏膜免疫系统中重要的作用分子,可以识别病原体和共生菌[4-6]。SIgA 对仔猪肠道的保护作用包括很多方面:中和细胞内排出的病毒颗粒,凝集细菌和病毒,以及防止病原体粘附到细胞表面,干扰细菌运动等[7]。由于PEDV 主要感染仔猪,仔猪获得母源抗体的途径主要来源于初乳和乳汁,母猪从接种疫苗后第13 d~14 d 分泌的乳汁中的PEDV SIgA 抗体达到最高值[8]。在高浓度的内源性SIgA 抗体保护下,仔猪在断奶期间患该病的可能性较小[6]。由于PEDV 主要感染仔猪,仔猪获得母源抗体的途径主要来源于初乳和乳汁,而SIgA和IgG 为乳汁中抗体的重要组分。肠道内存在多种消化酶,可以破坏完整的IgG 结构,使其结合抗原的功能受到影响,而SIgA 其有分泌成分(SC)片段和J 链(joining chain,J)的保护,可以使其避免被消化酶水解,表明在保护仔猪免受PEDV 的感染过程中,SIgA 抗体发挥的作用要明显高于IgG 的作用[9-10]。
因此,检测初乳或直肠拭子中的SIgA 抗体比检测血清中的IgG 更能体现疫苗免疫后的母猪及吃过初乳仔猪的免疫水平,但目前PEDV SIgA 抗体检测方法的缺失,影响了及时掌握猪群接种疫苗后的抗体评价及病毒感染情况的跟踪,鉴于此,本研究拟建立检测PEDV SIgA 抗体的间接ELISA 方法,为检测猪群中PEDV SIgA 水平及黏膜免疫评价提供有效的检测手段。
1 材料与方法
1.1 主要实验材料 分泌抗SIgA SC 抗体的杂交瘤细胞株2F9、PEDV LNCT2 株、Vero E6 细胞系,均由中国农业科学院哈尔滨兽医研究所猪消化道传染病创新团队保存;RPMI 1640 培养液购自Gibco 公司;BALB/c 小鼠由本所实验动物中心代为购买;HRP 购自Sigma 公司;2,2- 连氮基双-3- 乙基- 苯丙噻唑啉磺胺(ABTS)购自BBI 公司;Alexa Fluor 488 标记的山羊抗小鼠IgG 购自中杉金桥公司;Hi-Trap Protein G HP 购自GE Healthcare 公司;待检测直肠拭子样品均来自本创新团队感染实验中PEDV攻毒猪和阴性对照猪;待检测初乳样品采自于中国农业科学院哈尔滨兽医研究所实验动物基地;TGEV 阳性初乳和PoRV 阳性初乳均采自本创新团队动物实验中的母猪;待检测的165 份直肠拭子样本及90 份(每个省各30 份)初乳样本及其对应的直肠拭子样本采集自贵州、辽宁、黑龙江省的部分猪场。
1.2 小鼠腹水的制备、纯化、标记及效价测定 将冻存的2F9 杂交瘤细胞株复苏培养后制备小鼠腹水,离心除去沉淀后收集上清液,-70 ℃保存,备用[10]。按照HiTrap Protein G HP 抗体纯化说明书纯化收集的腹水并经浓度测定后,按文献[11]的碘酸钠法采用HRP 标记纯化的2F9,以纯化的猪SIgA蛋白[10]包被ELISA 板,采用本实验室建立的直接ELISA 方法检测HRP 标记抗体的抗体效价。
1.3 PEDV 培养、纯化及电镜观察 收集PEDV LNCT2 株病毒液,经3 000 r/min 离心5 min 去除细胞碎片后10×104r/min 离心2 h,收集沉淀。利用蔗糖密度梯度(20 %、30 %、40 %和60 %)离心纯化沉淀,收集40%~60%蔗糖层的样品,经10×104r/min离心2 h 进行脱糖处理,收集沉淀即为纯化的病毒粒子,负染后经电镜鉴定。
1.4 待检样品的SIgA 抗体的间接免疫荧光(IFA)检测 将新鲜采集的直肠拭子样品浸泡在PBS 溶液中,摇晃数次后收集上清用于检测;将新鲜采集的初乳8 000 r/min 离心5 min,去掉下层干物质及上层油脂,取中间层液体用于检测。待Vero E6 细胞长满单层后,接种PEDV LNCT2,待细胞刚出现CPE 时利用4 %多聚甲醛固定细胞,加入待检直肠拭子浸出液或初乳处理样品(1∶30),37 ℃反应1 h,以纯化的MAb 2F9 (1 ∶10 000)为一抗,Alexa Fluor488 标记的山羊抗小鼠IgG (1∶500)为二抗,经IFA检测待检样品中PEDV SIgA 抗体。
1.5 间接ELISA 反应条件的优化 采用方阵法,优化下列各反应条件:病毒粒子包被量(2 倍倍比稀释:742 ng/ 孔~0.725 ng/ 孔)、封闭液(5 % BSA、5 %脱脂乳、5 %牛血清)、封闭时间(1 h、2 h)、待检样品稀释度(1∶20、1∶40、1∶80、1∶160、1∶320)、孵育时间(30 min、l h、1.5 h、2 h 和4 h)、HRP 标记的鼠抗猪SIgA SC MAb (HRP-SIgA SC)的稀释度(1:2 000、1∶3 000、1∶4 000、1∶6 000、1∶8 000、1∶16 000)、反应时间(15 min、30 min、45 min、60 min、90 min)和底物(ABTS)反应时间(5 min、10 min、15 min、20 min、25 min),初步建立检测PEDV SIgA 的ELISA 方法。
1.6 阴性和阳性临界值的判定 经1.4 IFA 检测的30 份PEDV SIgA 阴性直肠拭子处理样品和27 份SIgA 阴性初乳处理样品,利用本研究建立的ELISA方法检测,确定阴性和阳性临界值。根据OD405nm值分别计算出阴性直肠拭子样品和初乳样品的平均值()和标准方差(SD),根据+3SD 值确定样品的阴、阳性临界值。
1.7 特异性试验 利用本研究建立的ELISA 方法检测经1.4 步骤处理的TGEV、PoRV 阳性初乳样品,以PEDV SIgA 阳性初乳处理样品作为阳性对照,PEDV 阴性初乳样品作为阴性对照,每个样品重复3 次,测定其OD405nm值,进行特异性试验。
1.8 敏感性试验 选取经1.4 IFA 测定的1 份PEDV SIgA 抗体阳性的初乳样品,经2 倍倍比稀释(1∶10~1∶12 800)后利用本研究建立的ELISA 方法进行检测,以评估该方法的敏感性。
1.9 重复性试验 使用同一批次制备的ELISA 板,选取5 份初乳和直肠拭子处理样品在3 个不同的时间点检测,试验重复3 次,评价该方法的批内重复性;使用3 个批次包被的ELISA 板,选取相同的5份初乳和直肠拭子处理样品进行检测,试验重复3次,评价该方法的批间重复性。
1.10 临床样品的检测 采集贵州、辽宁、黑龙江省部分猪场猪直肠拭子165 份和母猪初乳样品90 份(每个省份各30 份)及其对应的直肠拭子,经1.4 步骤处理后,利用本研究建立的间接ELISA 方法和1.4 的IFA 同时检测各样品中的PEDV SIgA 抗体,比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 HRP- SIgA SC 的效价测定 HRP-SIgA SC 经纯化后测定其浓度为3 mg/mL,纯化效果较好。通过直接ELISA 方法对纯化的HRP-SIgA SC 进行效价测定,在1∶3 000 稀释时OD405nm接近1 (图1),根据文献[11]将OD405nm值为1 左右对应的抗体效价为标记抗体的效价,所以HRP-SIgA SC 效价为1∶3 000。

图1 HRP-SIgA SC 效价测定结果Fig.1 Results of HRP-SIgA SC titer determination
2.2 PEDV 的培养、纯化及电镜观察结果 经蔗糖梯度离心方法纯化的病毒粒子经负染法后观察,可见病毒纯化效果较好,杂质少,该病毒为有囊膜病毒,纤突蛋白完整且明显,呈冠状分布于病毒囊膜外层,病毒粒子直径为95 nm~130 nm (图2)。表明获得了完整的PEDV 病毒粒子。
2.3 待检样品的SIgA 抗体IFA 检测结果 将待检的样品经IFA 检测,结果显示共检测到30 份PEDV阴性猪直肠拭子和27 份PEDV 阴性的初乳样品,以及30 份PEDV 阳性猪直肠拭子和30 份PEDV 阳性的初乳样品(图3)。可以用于后续临界值的确定和敏感性试验。
2.4 ELISA 方法最佳反应条件的优化结果 经方阵滴定法确定该间接ELISA 方法的最优反应条件见表1。

图2 电镜观察PEDV 粒子(负染法)Fig.2 Electron microscopic observation of PEDV virus particles(negative staining method)

图3 直肠拭子和初乳样品中PEDV SIgA 的IFA 检测结果Fig.3 Detection of PEDV SIgA in rectal swabs and colostrum samples by IFA

表1 间接ELISA 最佳工作浓度的确定Table 1 Determination of the optimal working concentration of the indirect ELISA
2.5 间接ELISA 方法临界值的确定 分别对30 份PEDV 阴性直肠拭子和27 份阴性初乳样品经建立的ELISA 方法检测。结果显示各样品的OD405nm值成正态分布(图4)。经计算,直肠拭子X+3SD 值=0.261,因此将OD405nm值>0.261 判为阳性,OD405nm值≤0.261 判为阴性;初乳X+3SD 值=0.305 因此将OD405nm值>0.305 判为阳性,OD405nm值≤0.305 判为阴性。
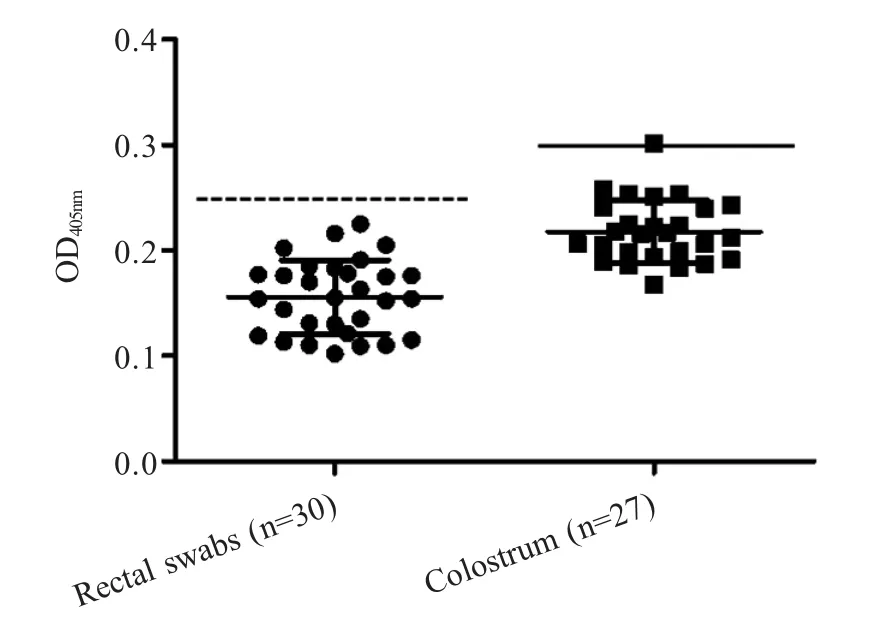
图4 间接ELISA 方法临界值的确定Fig.4 Determination of the indirect ELISA threshold
2.6 特异性试验结果 采用建立的间接ELISA 方法进行特异性试验,每个样品做3 个重复,检测其OD405nm值,并计算平均数,结果显示除PEDV 阳性初乳样品OD405nm>0.305 为阳性结果外,TGEV 及PoRV 阳性初乳样品均为阴性结果(表2)。表明该间接ELISA 方法与TGEV 和PoRV 的阳性初乳样品无交叉反应,具有较强的特异性。

表2 间接ELISA 特异性试验结果Table 2 Specificity test results of the indirect ELISA
2.7 敏感性试验结果 取1 份经IFA 检测后的阳性初乳处理样品2 倍倍比稀释后,利用本研究建立的ELISA 方法检测,评估该方法的敏感性。结果显示,ELISA 检测OD405nm值与IFA 测定的效价呈正相关,随着阳性初乳稀释倍数增加,其OD405nm值平缓递减。当阳性初乳的SIgA 抗体效价为1∶6 400 时,该ELISA 检测的OD405nm值仍然大于0.305,而稀释到1∶12 800 时,其OD405nm值小于0.305 (图5),判为阴性,所以该ELISA 的敏感性为1∶6 400。表明该方法的敏感性较高。
2.8 重复性试验结果 使用同一批次制备的ELISA板,检测随机抽取的5 份初乳、直肠拭子处理样品,结果显示批内变异系数小于10 % (表3);使用不同批次制备的ELISA 板检测上述5 份初乳、直肠拭子处理样品,结果显示批间变异系数小于10 %(表4)。表明该检测方法重复性较好。

图5 敏感性试验结果Fig.5 Sensitivity test of the ELISA
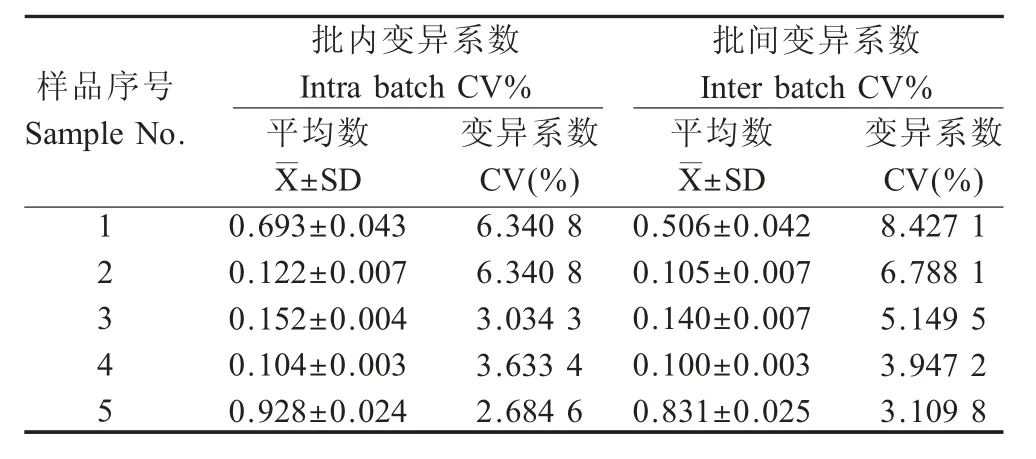
表3 初乳样品的重复性试验结果(n=5)Table 3 Colostrum reproducibility test results of the indirect ELISA (n=5)

表4 直肠拭子样品的重复性试验结果(n=5)Table 4 Rectal swab repeatability test results of the indirect ELISA (n=5)
2.9 间接ELISA 方法的初步应用 对不同省份采集的165 份猪直肠拭子样品分别经本研究建立的ELISA 方法和IFA 同时检测。结果显示,165 份样品中PEDV SIgA 抗体阳性率达49.7 %,IFA 检测的阳性率为50.9 %,二者符合率为97.6 % (表5);对每个省份30 份,共计90 份采集的母猪初乳样品及其对应的直肠拭子分别经IFA 和ELISA 方法检测,结果显示二者检测结果完全一致,PEDV SIgA 抗体阳性样品90 份,无阴性样品。阳性率均为100 %(表6)。表明该间接ELISA 方法检测结果较准确,可以用于临床检测。
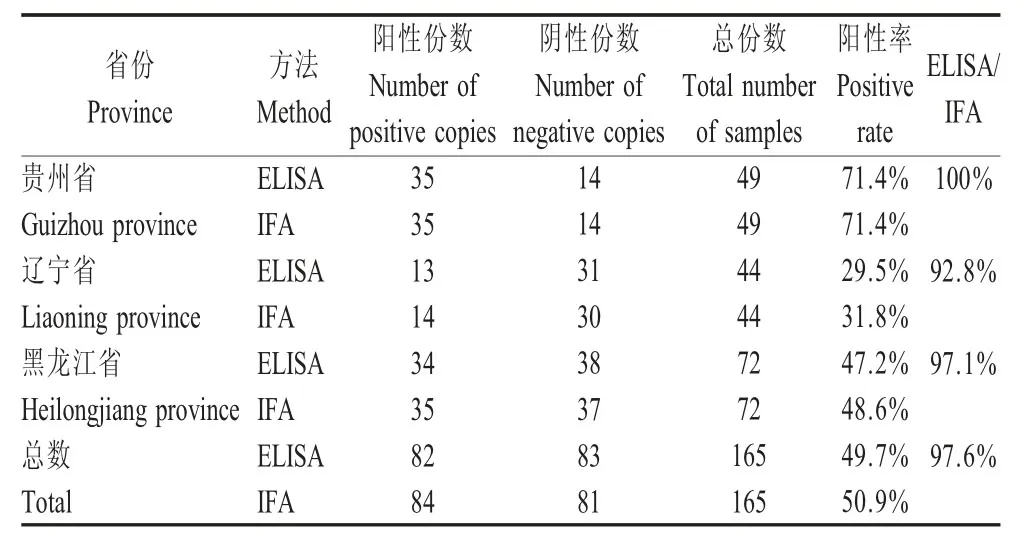
表5 间接ELISA 和IFA 检测临床猪直肠拭子中的SIgA 抗体结果比较Table 5 Comparison of SIgA results in clinical pig rectal swabs by indirect ELISA and IFA

表6 间接ELISA 和IFA 检测母猪初乳及其对应直肠拭子中SIgA 抗体的结果比较Table 6 Comparison of SIgA results in clinical sow colostrum and corresponding rectal swabs by indirect ELISA and IFA
3 讨 论
PEDV 感染的靶器官是仔猪小肠绒毛膜上皮细胞[9],其在感染小肠上皮细胞时需穿过黏膜层,因此黏膜免疫系统在防控PEDV 感染的过程中至关重要。在黏膜免疫系统中病原特异性SIgA 抗体能够有效中和病毒、阻断病原体与机体接触,促进病原体排出体外。因此,机体内PEDV 特异性SIgA 抗体水平是评价机体能否有效阻断PEDV 感染的重要指标。为了检测猪针对PEDV 产生的黏膜免疫,有必要建立一种检测PEDV SIgA 的方法。本研究建立了能够评价PEDV 感染及其免疫状态的SIgA 检测方法满足了该需要。
经主动免疫或自然感染PEDV 后,猪的免疫系统会产生针对PEDV 不同结构蛋白及不同表位的SIgA,这些SIgA 分子均可以与PEDV 结合。而本实验以全病毒粒子作为间接ELISA 的包被抗原,可以结合病毒不同抗原或抗原表位产生的SIgA。PEDV有两种基因亚型:G1 和G2 亚型[3]。两种基因亚型病毒株的差异主要存在于S 基因[12],本研究中所用的PEDV LNCT2 株(G2 亚型)S 基因与CV777 株S基因(G1 亚型)的同源性为93.2 %;PEDV 其它结构蛋白如M、E 等变异率较低。因此,以PEDV LNCT 株病毒粒子为包被抗原建立的间接ELISA 方法完全可以检测出CV777 病毒株诱导猪体产生的SIgA 抗体。
此外,因IFA 具有敏感性和特异性强等优点,所以本研究将初乳及直肠拭子待检测样品经IFA 检测,其检测结果与本研究建立的ELISA 检测结果相似。由于目前无PEDV 特异性SIgA 抗体商品化检测试剂盒,因此,本研究将建立的ELISA 方法与IFA进行比较,结果可信度较高。同时,本研究应用的抗SC 片段的MAb 能够与SIgA 分子中的SC 片段特异性结合,与IgA 分子无反应,能够有效排除IgA分子对SIgA 抗体检测结果的影响,特异性较强。相较于血清抗体ELISA 检测方法对样品的采集过程,该方法采集的样品为猪肛拭子和初乳,采集方便且动物应激反应低,无需使用注射器采血,避免了由于消毒不彻底造成继发感染,目前市售的PEDV 抗体ELISA 检测试剂盒多是检测血清抗体,如间接ELISA 试剂盒、竞争或阻断ELISA 试剂盒[8],这些方法均不能对局部黏膜免疫进行评价。相较于检测血清抗体,检测SIgA 抗体能够更加直观的反映动物机体对PEDV 免疫的应答情况,所以本研究建立的PEDV SIgA 抗体间接ELISA 检测方法比血清学检测方法更方便科学地评价猪群的感染状况和免疫状况。
本实验检测样品为初乳或肛拭子,在样品运输过程中需维持4 ℃低温以保证样品新鲜。采用该方法对来自3 个省部分猪场的初乳或肛拭子样品进行了检测,结果显示3 个省份平均PEDV SIgA 抗体阳性率达49.7 %,这与Chen 的血清抗体检测结果相似[7],其中以贵州省采集的样品阳性率最高达71.4%,初步表明这3 个省份部分猪场的部分猪体内产生了PEDV SIgA,但仍需要加强疫苗的免疫覆盖率。
综上所述,检测PEDV SIgA 抗体水平比检测血清中IgG 及IgA 水平能够更加科学的评价仔猪感染PEDV 的状态或仔猪的母源抗体水平。检测母猪初乳和直肠拭子中的SIgA 可以为制定PEDV 免疫程序提供参考依据。本实验建立的PEDV 特异性SIgA抗体ELISA 方法为检测猪体的主动免疫和被动免疫状态提供了有效的技术手段。
