M蛋白携带TC标签的重组新城疫病毒的构建及生物学特性鉴定
2019-10-10孙军峰韩宗玺刘胜旺
范 振,孙军峰,赵 冉,韩宗玺,刘胜旺
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/ 禽呼吸道病创新团队,黑龙江哈尔滨150069)
新城疫病毒(Newcastle disease virus,NDV)的M蛋白位于病毒的囊膜内层,是一种非糖基化的膜蛋白。M 蛋白一部分镶嵌在囊膜内,另一部分与病毒的核衣壳相互作用,构成囊膜的支架[1]。M 蛋白主要参与病毒的组装以及出芽[2]。其能够与宿主细胞膜、病毒囊膜糖蛋白的胞质区以及核衣壳相互作用参与病毒粒子的组装[3]。M 蛋白的突变导致F 蛋白不能包装进入病毒粒子中,从而不能形成有感染性的病毒[4]。早期研究认为NDV 感染后在细胞质中复制,但后续研究显示,在NDV 感染细胞早期,M蛋白能够在细胞核和核仁中聚集,并且在整个感染过程中持续存在于核仁中[5];而在感染的后期,M蛋白进入到细胞质中,在细胞膜内侧与病毒核糖核蛋白复合体(RNP)、糖蛋白以及细胞膜相互作用完成病毒粒子的装配和出芽[6]。上述研究表明,NDV的M 蛋白是一种细胞质-核穿梭蛋白。最近研究显示,M 蛋白R42A 突变后,导致其不能进入到细胞核中,而且病毒的复制和致病性也被减弱。此外,宿主细胞核仁磷蛋白B23 能够与NDV M 蛋白相互作用从而使M 蛋白定位于细胞核中;对B23 进行沉默后,能够减少NDV 引起的细胞病变并抑制NDV 的复制,表明宿主因素在NDV 的复制过程中发挥着重要的作用[7]。
然而,到目前为止,NDV M 蛋白在细胞质- 核中穿梭的动态变化及对病毒复制的生物学意义仍然知之甚少。尤其是NDV 感染以及M 蛋白细胞质-核穿梭如何调控宿主细胞的生物学过程来促进NDV自身的复制尚未有报道。本研究利用反向遗传技术拯救获得了携带TC 标签的M 基因的重组NDV La Sota 病毒,通过双砷染料对带有TC 标签的M 蛋白进行染色,实现了M 蛋白在NDV 感染细胞过程中细胞质及细胞核中的动态运输的可视化监测。本研究为进一步探究M 蛋白在NDV 感染中的作用及其分子机制提供新工具。
1 材料与方法
1.1 主要实验材料 BSR T7/5 和DF-1 细胞由本实验室保存并培养,培养基为含10 %胎牛血清的DMEM;稳定表达T7 RNA 聚合酶的重组痘病毒vTF-3 和NDV La Sota 疫苗株由本实验室保存;9 日龄SPF 鸡胚和1 %鸡红细胞由本研究所实验动物中心提供。
含NDV La Sota 株全长cDNA 的质粒pNDFLsp及编码NDV NP、P 和L 蛋白的辅助质粒pCI-NP-K、pCI-P-K 和pCI-L-K 由本实验室构建并保存。
1.2 主要试剂 质粒提取试剂盒、胶回收试剂盒购自Omega 公司;限制性内切酶、T4 DNA 连接酶购自NEB 公司;RNA 提取试剂盒、DNA Marker、pMD18-T 载体、E.coliDH5α 感受态细胞、Prime-ScriptTMOne Step RT-PCR Kit、One Step SYBR Prime-Script RT-PCR Kit 购自TaKaRa 公司;KOD-Plus-Neo高保真聚合酶购自TOYOBO 公司;胎牛血清、DMEM 培养基购自Sigma 公司;Lipofectamine 2000转染试剂购自Invitrogen 公司;FlAsH-EDT2 染料试剂盒购自Invitrogen 公司。
1.3 引物设计与合成 pNDFLsp 载体中M 基因编码区位于5 235 nt~6 329 nt,其两侧可用的酶切位点为PmeⅠ(5 166 nt~5 173 nt)和NotⅠ(6 897 nt~6 904 nt)。参照pNDFLsp 载体序列,利用Primer 软件设计2 对特异性引物(表1),引物由北京华大基因公司合成。
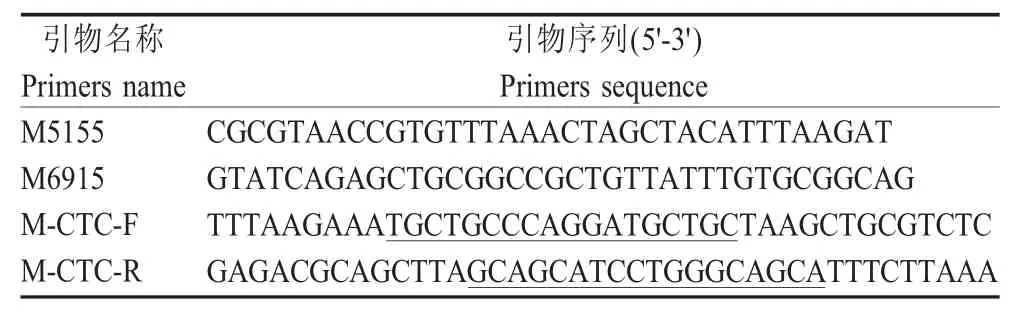
表1 扩增携带TC 标签的M 基因所用的引物Table 1 Primers used for construction of M gene containing TC tag
1.4 携带TC 标签的重组质粒的构建与鉴定 以pNDFLsp 为模板,采用引物M5155/M6915,PCR 扩增包含PmeⅠ和NotⅠ酶切位点的片段,对应pNDFLsp 中5 155 nt~6 915nt 片段。扩增获得目的片段,简称为A 片段,经电泳检测并回收。以片段A为模板,使用引物M5155/M-CTC-R 进行PCR 扩增获得B 片段;以片段A 为模板,采用引物M-CTC-F/M6915 PCR 扩增获得C 片段。将B、C 片段分别回收,再以这两个片段为模板通过融合PCR 获得末端带有TC 标签的M-CTC 片段。将M-CTC 片段与pMD18-T 载体连接,转化感受态细胞,挑取单个克隆采用引物M5155/M6915 经菌液PCR 鉴定,阳性质粒由北京华大公司测序鉴定,测序正确的质粒命名为pMD18T-M-CTC。pMD18T-M-CTC 经PmeⅠ和NotⅠ双酶切,回收酶切后片段与经同样双酶切的pNDFLsp 载体连接,转化感受态细胞。挑取单克隆提取质粒后用PmeⅠ和NotⅠ酶切鉴定并测序,获得M 基因C 末端带有TC 标签的NDV La Sota 的全长cDNA,命名为pNDFL-M-CTC。
1.5 重组标记病毒La Sota-M-CTC 的拯救与鉴定用稳定表达T7 RNA 聚合酶的重组痘病毒vTF-3 接种六孔板中的BSR T7/5 细胞,1 h 后参照Lipofectamine 2000 转染试剂说明,将质粒pNDFL-M-CTC及辅助质粒pCI-NP-K、pCI-P-K 和pCI-L-K 以4∶2∶1∶1的比例转染BSR T7/5 细胞。转染后6 h 换成含10 %胎牛血清的DMEM,并补充阿拉伯糖苷(0.2 μg/mL)以及TPCK 胰酶(5 μg/mL)。培养72 h 后收集细胞及上清混合后接种9 日龄的鸡胚尿囊腔,72 h 时收集尿囊液采用红细胞凝集试验(HA)[8]检测其HA 效价。收获HA 效价高于4 log2 的尿囊液,提取其RNA,采用引物M5155/M6915 进行RT-PCR 扩增并测序。获得的病毒命名为LaSota-M-CTC,分装后-70℃冻存。
1.6 La Sota-M-CTC 的纯化 采用有限稀释法纯化拯救病毒。用PBS 将La Sota-M-CTC 10 倍倍比稀释,将其中10-7~10-9共3 个稀释度的尿囊液分别接种5 枚鸡胚,弃掉24 h 内死亡的鸡胚,37 ℃孵化72 h 后检测鸡胚尿囊液的HA 效价,将10-9稀释的尿囊液接种鸡胚获得的尿囊液HA 价最高的命名为F1 代,继续将F1 代病毒以10-7~10-9稀释度的尿囊液分别接种5 枚鸡胚,重复上述步骤获得的HA 价最高的尿囊液命名为F2 代。再以同样方法连续稀释纯化病毒,收获F3 代病毒尿囊液,过滤后分装,-70 ℃冻存。
1.7 La Sota-M-CTC 鸡胚半数感染量(EID50)的测定 将拯救获得的La Sota-M-CTC,以及亲本病毒La Sota 尿囊液10 倍倍比稀释,将10-7~10-9各稀释度的尿囊液分别接种5 枚鸡胚,37 ℃继续孵化72 h,通过测定感染鸡胚尿囊液的HA 活性来判断其是否感染,利用Reed-Muench 法计算La Sota-M-CTC 和亲本病毒La Sota 的EID50。
1.8 La Sota-M-CTC 的毒力测定 将1.6 纯化后的La Sota-M-CTC 以及亲本病毒La Sota 尿囊液用无血清的DMEM 10 倍倍比系列稀释,选取4 个稀释度(10-6~10-9),每个稀释度的病毒接种5 枚9 日龄SPF 鸡胚,0.1 mL/ 胚,置37 ℃培养。每天照胚两次,弃去24 h 内死亡鸡胚,连续观察7 d,记录各鸡胚的死亡时间,并分别收集各胚尿囊液测定其HA 值,计算鸡胚平均致死时间(Mean death time,MDT)。
1.9 La Sota-M-CTC 的遗传稳定性检测 将1.6纯化后的La Sota-M-CTC 通过尿囊腔途径接种9 日龄SPF 鸡胚,72 h 时收获尿囊液继续以相同方法传代,共连续传15 代。取P1、P5、P10 和P15 代尿囊液提取RNA,采用引物M5155/M6915 进行RT-PCR扩增,回收扩增产物测序鉴定,检测TC 标签是否稳定存在。
1.10 La Sota-M-CTC 的生长动力学曲线的测定将La Sota-M-CTC 以及亲本病毒La Sota 按100 EID50/0.1 mL 剂量接种SPF 鸡胚,分别在接种后24 h、48 h、72 h、96 h 取样,每个时间点随机抽取3 枚鸡胚,测定病毒的EID50,并绘制病毒的生长动力学曲线。
1.11 M 蛋白的激光共聚焦检测 将La Sota-MCTC 以MOI 1 感染DF-1 细胞,37 ℃孵育1 h 后用PBS 洗涤3 次后加入10 %胎牛血清的DMEM 和TPCK 处理过的胰酶(1 μg/mL)继续培养,1 h 后弃掉培养基,PBS 洗涤3 次后用2.5 μmol/mL FlAsHEDT2 双砷染料(绿色)室温避光染色30 min。洗涤2次后,用4',6-diamidino-2-phenylindole (DAPI)对细胞核染色,室温避光20 min 后,置激光共聚焦显微镜下观察M 蛋白的表达盒分布。
2 结 果
2.1 携带TC 标签的重组质粒pNDFL-M-CTC 的构建与鉴定 以pNDFLsp 为模板,使用引物M5155/M6915 经PCR 扩增包含PmeⅠ和NotⅠ酶切位点的片段,结果显示,获得约1 700 bp 的条带,与预期大小一致,以该片段为模板,使用引物M5155/M-CTC-R 扩增片段A,获得约1 100 bp 的一条目的条带(图1)。以引物M-CTC-F/M6915 扩增片段B,获得约600 bp 的一条目的条带(图1)。将上述A 和B 片段分别回收,再以这两个片段为模板通过融合PCR 的方法扩增获得约为1 700 bp 的目的条带,与预期一致(图1),表明获得M 基因C 端带有TC 标签的片段,命名为M-CTC。

图1 C 端带有TC 标签的M 基因片段的构建Fig.1 Construction of M gene fragment containing TC tag in the C-terminal of its coding region
将M-CTC 片段克隆至pMD18-T 载体,转化感受态细胞后采用菌液PCR 检测,结果显示,获得约1 700 bp 的目的条带,经测序正确的质粒命名为pMD18T-M-CTC。将该质粒经PmeⅠ和NotⅠ双酶切,克隆至pDNFLsp 载体中,构建的重组质粒经PmeⅠ和NotⅠ双酶切得到了分别约为15 000 bp 的pNDFLsp 载体条带和约为1 700 bp 的M-CTC 目的条带,与预期相符(图2),测序结果显示TC 标签序列正确,表明正确构建了重组质粒pNDFL-M-CTC。

图2 重组质粒pNDFL-M-CTC 的双酶切鉴定Fig.2 Identification of recombinant plasmid named pNDFL-M-CTC
2.2 La Sota-M-CTC 的拯救及鉴定 将重组质粒pNDFL-M-CTC 与辅助质粒pCI-NP-K、pCI-P-K 和pCI-L-K 共转染BSR T7/5 细胞,收获细胞及上清接种SPF 鸡胚,72 h 提取收获尿囊液中病毒的RNA,经RT-PCR 扩增并测序。结果显示,扩增获得的目的条带经测序结果显示M 基因编码区C 末端存在引入的TC 标签(图3),表明拯救获得的标记病毒La Sota-M-CTC 中含有引入的TC 标签。将拯救获得的病毒纯化后,通过HA 试验测定La Sota-M-CTC的HA 效价为29,接种鸡胚测定La Sota-M-CTC 的EID50为109.08/0.1 mL。亲本病毒La Sota 的血凝效价为29,EID50为109.29/0.1 mL。

图3 La Sota-M-CTC 标签序列测定Fig.3 Sequencing the tag of La Sota-M-CTC
2.3 La Sota-M-CTC 的毒力及遗传稳定性测定结果 通过接种鸡胚测定La Sota-M-CTC 致死鸡胚的MDT,结果显示La Sota-M-CTC 的MDT 为102 h,亲本病毒La Sota 株为100 h,NDV 毒力指标判定中MDT>90 h 的病毒属于低毒力,本研究结果表明重组病毒和亲本病毒均属于低毒力病毒,且TC 标签的插入不影响重组病毒的毒力。为测定TC 标签在病毒中的稳定性,将La Sota-M-CTC 连续传15 代后,经RT-PCR 扩增并测序,结果显示,P1、P5、P10 和P15 代中均检测到约1 700 bp 的目的条带(图4A)。并且测序结果显示TC 标签在传15 代后的La Sota-M-CTC 基因组仍然中存在(图4B)。表明TC 标签能够稳定存在于La Sota-M-CTC 病毒基因组中。

图4 TC 标签在La Sota-M-CTC 中的遗传稳定性的PCR 检测结果(A)和测序结果(B)Fig.4 Results of the genetic stability of TC tag in La Sota-M-CTC detected by PCR (A)and sequencing (B)
2.4 La Sota-M-CTC 的生长动力学测定结果 将拯救病毒La Sota-M-CTC 和亲本病毒La Sota 接种9日龄SPF 鸡胚,在不同时间收获病毒,测定病毒EID50并绘制其生长动力学曲线。结果显示,La Sota-M-CTC 与La Sota 在SPF 鸡胚中的生长动力学水平相似,二者的EID50均在72 h 左右达到峰值,拯救病毒与亲本病毒的生长特性无明显差异(图5)。表明TC 标签对病毒的复制增殖无影响。
2.5 La Sota-M-CTC 感染细胞后M 蛋白的动态分布检测结果 将La Sota-M-CTC 接种DF-1 细胞后,通过双砷染料FlAsH 对活细胞染色。激光共聚焦结果显示,在接种La Sota-M-CTC 1 h~2 h 时,M 蛋白(绿色荧光标示)主要分布于细胞质中(图6A),而在接种后4 h M 蛋白进入细胞核中,并持续存在至病毒感染后的12 h (图6B)。表明M 蛋白中的TC标签能够被双砷染料染色,通过对染色的TC 标签的追踪可以对NDV 感染后M 蛋白在活细胞中的定位分布进行监测;M 蛋白在NDV 感染后的早期阶段即可进入细胞核中并且能够持续存在于细胞核中。

图6 激光共聚焦观察M 蛋白在细胞内的的动态分布Fig.6 The dynamic distribution of M protein monitored by via confocal microscopy
3 讨 论
M 蛋白是NDV 病毒粒子中位于囊膜内层的非糖基化蛋白,副粘病毒中的M 蛋白主要通过与其它病毒蛋白的相互作用参与病毒粒子的组装过程[6,9]。由于文献报道M 蛋白末端的氨基酸残基组成可能会影响病毒的组装效率[6],本研究在构建重组病毒时分别将TC 标签插入M 基因编码区起始密码子的前方,以及终止密码子的前方。将构建的含有TC 标签的全长pNDFL-M-CTC 质粒转染细胞后能够分别拯救获得M 蛋白N 末端和C 末端携带TC 标签的重组病毒,但是N 末端携带TC 标签的重组病毒滴度要低于C 末端携带标签的重组病毒(本研究发现),表明N 末端TC 标签的存在可能影响了病毒的组装或释放过程,因此本研究选择构建了C 末端携带标签的病毒以进行进一步的试验。对传15 代后的病毒经测序显示,TC 标签能够稳定存在于重组病毒中,具有良好的遗传稳定性。该病毒在SPF 鸡胚中的生长动力学曲线与亲本病毒相似,表明M 蛋白携带TC 标签不影响病毒的生长特性和复制,且该重组病毒可以作为一种标记病毒用来监测M 蛋白在细胞中的运输。
病毒在感染后需要依赖宿主细胞的生物学过程来完成自身的复制。近年来越来越多的研究表明,在细胞质中复制的RNA 病毒能够编码病毒蛋白并定位至细胞核中从而干扰宿主细胞的功能以促进病毒自身的复制[10-14]。副粘病毒中的呼吸道合胞体病毒(RSV)的M 蛋白能够在感染的早期定位于细胞核中抑制细胞的转录,推测M 蛋白可能在RSV 诱导的细胞周期停滞中起关键作用[15]。进一步的研究证实RSV 对细胞周期的干扰作用确实是由M 蛋白定位至细胞核中所介导实现的[11]。前期研究报道NDV的M 蛋白能够定位于细胞核中,但是M 蛋白在细胞质和细胞核中的动态分布以及M 蛋白的核定位对宿主细胞生物学功能的影响尚不清楚,本研究通过反向遗传技术拯救获得了M 蛋白携带TC 标签的重组病毒,通过激光共聚焦显微镜实时监测M 蛋白的定位分布,显示M 蛋白在感染后的4 h 即可进入细胞核并存在至感染后的12 h。M 蛋白的细胞核定位是否能够调控细胞周期、是否能够抑制宿主细胞基因的转录和翻译,从而促进病毒基因组的复制、转录以及病毒组装释放,还有待于进一步深入的研究。
