基于血清4型禽腺病毒Fiber-2间接ELISA方法的建立
2019-10-10孙海伟李允章王桂军陈鸿军
梅 楠,孙海伟,李允章,汪 凯,王桂军,陈鸿军*
(1.安徽农业大学动物科技学院,安徽合肥230036;2.中国农业科学院上海兽医研究所,上海200241)
I 群禽腺病毒(Fowl Adenovirus,FAdV-I)隶属于腺病毒科禽腺病毒属,普遍存在于鸡群中,感染率高,发病率低,呈隐性感染,常作为继发病原感染家禽,尤其当家禽免疫力低下或存在禽免疫抑制病时会使病情恶化。鸡的I 群FAdV 分为A~E 5 个亚群,共有12 个血清型(血清型1~7,8a,8b,9~11),其中血清4 型禽腺病毒(Serotype 4 fowl adenovirus,FAdV-4)属于C 亚群,是我国目前主要的流行株,以心包积液- 肝炎综合征(Hydropericardium hepatitis syndrome,HHS)为主要特征,给我国家禽养殖业带来了严重的经济损失[1-3]。
FAdV-I 病毒粒子的结构蛋白中包括240 个六邻体(Hexon)、12 个五邻体(Penton base)、12 个纤突蛋白(Fiber)等构成了病毒的核衣壳主体部分[4],Fiber是病毒粒子表面重要的纤突蛋白,有主要的抗原决定簇和次要的亚属抗原决定簇。纤突蛋白可识别细胞膜上的特异性受体,病毒粒子通过纤突蛋白与细胞膜受体结合并侵入细胞。FAdV-4 病毒粒子具有2种不同大小的Fiber 蛋白:长纤突蛋白(Fiber-1)和短纤突蛋白(Fiber-2)。值得注意的是,Fiber-2 在介导病毒感染的宿主细胞中发挥重要作用,其具有较好的抗原性,无毒株和强毒株的氨基酸序列差异较大,可诱导产生具有中和抗体[5-7]。
开展FAdV-4 特异性的血清学调查对于掌握该疫情流行情况,监测疫苗免疫后抗体水平消长等有着重要的指导意义。目前有关FAdV-4 感染的血清学诊断方法包括:琼脂扩散试验(AGP)和中和试验(SN)等。然而,AGP、SN 这两种方法耗费时间较长、而且敏感性较低,容易受个体差异性的影响,样品很难定量批量检测[8]。商品化的抗体试剂盒是检测FADV-I 的群特异性抗体,但特异性不够强。通过对FADV-4 特异性抗原和抗体的制备,建立灵敏度高、特异性强、稳定性好的ELISA 检测方法,是监测该病的主要血清学检测方法。本研究以2016年临床分离的FAdV-4 强毒株Fiber-2 蛋白作为包被抗原,通过一系列实验条件的摸索和优化,建立了一种特异性检测FAdV-4 抗体的间接ELISA 检测方法,以期为该病血清学监测和感染状态筛查提供了简便而高效的生物学工具。
1 材料与方法
1.1 主要实验材料 FAdV-4 AQ 株(KY436520)由本实验室分离保存;pET-32a(+)、FAdV-4 阳性血清(13 份FAdV-4 灭活菌免疫鸡血清,15 份FAdV-4 感染鸡血清)、FAdV-8b 阳性血清和SPF 鸡阴性血清均由本实验室保存;DH5α 和BL21 (DE3)感受态细胞购自美国Invitrogen 公司;SacⅠ和Hind Ⅲ购自英国NEB 公司;DNA T4 连接酶购自美国Thermo Scientific 公司;病毒基因组提取试剂盒购自天根生化科技(北京)有限公司;凝胶回收试剂盒购自德国Qiagen 公司;质粒提取试剂盒购自美国Axygen 公司;BCA 蛋白浓度测定试剂盒购自碧云天生物技术有限公司;鸡血清1 型FAdV (FAdV-1)阳性血清、血清9 型FAdV (FAdV-9)阳性血清、血清10 型FAdV(FAdV-10)阳性血清、血清11 型FAdV(FAdV-11)阳性血清均由叶建强教授惠赠;新城疫(ND)、鸡传染性支气管炎(IB)、鸡传染性法氏囊(IBD)、Ⅲ群禽腺病毒—鸡产蛋下降综合征(EDS76)、马立克氏病(MD)、禽白血病(AL)以及H5N1 和H9N2 亚型禽流感的阳性血清均购自中国兽医药品监察所;羊抗鸡IgG-HRP 购自Proteintech 公司;TMB 底物显色液购自上海浩然生物技术有限公司;脱脂奶粉购自OXOID 公司。
1.2 FAdV-4 AQ 株基因组提取 按常规方法制备原代鸡胚肾细胞(CEK),接种FAdV-4 AQ 株病毒(0.1 TCID50/ 孔),待出现细胞病变后收集细胞上清,分装保存于-80 ℃,测量其效价。取出其中200 μL病毒样品,经病毒基因组DNA 提取试剂盒提取基因组DNA,置-20 ℃长期保存备用。
1.3fiber-2基因的克隆与表达
1.3.1 fiber-2 基因的扩增基于FAdV-4 AQ 株(KY436520)的fiber-2基因5'端111 bp 的高亲水区域影响该蛋白在pET-32a(+)载体中的表达效率,本实验从fiber-25' 端112 bp 处开始设计一对特异性引物。fiber-2-F:CATGAGCTCATGCTTGACCTGGTTT ATCCTTTCG (SacⅠ)/fiber-2-R:CATAAGCTT TTA CGGGAGGGAGGCC (Hind Ⅲ)。并分别在上下游引物的5' 端和3' 插入SacⅠ和Hind Ⅲ酶切位点。以FAdV-4 AQ 株基因组DNA 为模板,PCR 扩增fiber-2基因的112 bp~1 440 bp 片段。PCR 产物经琼脂糖核酸凝胶电泳检测并回收纯化。
1.3.2 pET32a-fiber-2 重组质粒的构建将PCR 扩增产物与pET-32a(+)空载体分别经SacⅠ/Hind Ⅲ双酶切,酶切产物经琼脂糖核酸凝胶电泳胶回收,将载体和目的片段按1∶3 摩尔比混合后连接,取部分连接产物转化DH5α 感受态细胞,挑单菌落培养,并用质粒提取试剂盒提取质粒pET32a-fiber-2,PCR鉴定后由苏州金唯智公司测序。
1.3.3 Fiber-2 蛋白表达及纯化将1.3.2 中测序正确的pET32a-fiber-2和pET-32a 空载体分别转化BL21(DE3)感受态细胞,挑单菌落培养,于37 ℃恒温震荡培养至OD600nm值达0.4~0.6 时,加入终浓度1 mmol/L IPTG 诱导,6 h 后3 000 r/min 离心收集菌体,经超声波破碎裂解后收集沉淀和裂解上清,经SDS-PAGE 电泳检测重组蛋白的表达情况。产物经镍柱纯化后采用BCA 蛋白浓度测定试剂盒确定浓度。
1.4 Fiber-2 间接ELISA 方法的建立 采用方阵法对包被抗原Fiber-2 蛋白包被量(0.01 μg、0.02 μg、0.05 μg、0.1 μg、0.2 μg、0.4 μg、0.8 μg 和1.6 μg)、包被条件(37 ℃包被1 h 后,4 ℃放置12 h;37 ℃包被2 h 后,4 ℃放置12 h;4 ℃放置12 h)、封闭液(5 %脱脂奶或1 %牛血清白蛋白)、封闭时间(30 min、60 min 或120 min)、血清孵育时间(30 min、60 min、90 min、120 min)、羊抗鸡IgG-HRP 二抗稀释倍数(1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000和1∶32 000)、二抗孵育时间(30 min、60 min、90 min、120 min)等进行优化,建立检测FAdV-4 抗体的间接ELISA 方法。
1.5 阴性、阳性临界值的确定 根据已确定的上述ELISA 最佳条件,对60 份SPF 鸡血清进行检测,测定其OD450nm,计算60 份样品OD450nm平均值(X)和标准差(SD),计算临界值=X+3SD。
1.6 特异性试验 利用建立的间接ELISA 方法检测ND、 IB、 IBD、 EDS76、 MD、 AL、 FAdV-1、FAdV-7、FAdV-9、FAdV-11、FAdV-8b、H5N1 和H9N2 亚型流感等阳性血清,以FAdV-4 阳性和阴性血清为对照,验证该方法特异性。
1.7 敏感性试验 将FAdV-4 阳性血清和阴性血清分别从1∶100 倍比稀释至1∶51 200,采用本实验建立的间接ELISA 方法进行检测,评价该方法敏感性。
1.8 重复性试验 取4 份阳性血清和1 份阴性血清,利用同一批次制备的抗原包被板检测每个样品重复3 个孔,在不同时间段进行批内重复性检测;同时,取该4 份阳性血清和1 份阴性血清,每个样品重复3 个孔,以不同批次制备的抗原包被板同一时间段进行批间重复性检测,评估该方法的重复性。
1.9 临床样品检测 利用本实验建立的间接ELISA检测方法对免疫FAdV-4 灭活苗的13 份鸡血清和实验室保存的15 份FAdV-4 感染的鸡的阳性血清以及12 份SPF 鸡阴性血清进行检测;同时利用琼脂扩散(AGP)实验(琼扩抗原为AQ 株病毒感染的鸡肝脏混悬液)对上述样品进行检测。将二者检测结果进行对比分析,并确定两种方法的符合率。
2 结 果
2.1 pET32 a-fiber-2重组质粒的构建与鉴定FAdV-4 AQ 株经CEK 细胞增殖培养,48 h 产生明显CPE,提取病毒DNA,以其为模板,PCR 扩增fiber-2基因112 bp~1 440 bp 片段。结果显示得到1 314 bp 的目的条带(图1),与pET-32a(+)载体连接构建重组质粒pET32a-fiber-2,PCR 鉴定结果显示:扩增得到约1 300 bp 的目的条带。经测序结果显示,克隆入pET-32a(+)载体中的fiber-2基因片段与FAdV-AQ 株(KY436520)fiber-2基因的同源性为100%。表明重组质粒pET32a-fiber-2构建正确。
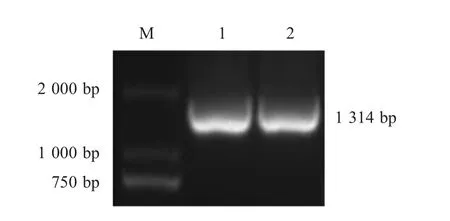
图1 fiber-2 截短基因的PCR 扩增结果Fig.1 PCR amplification of truncated fiber-2 gene
2.2 Fiber-2 的表达与纯化 重组菌pET32a-fiber-2/BK21 经IPTG 诱导后,超声波破碎后离心,取菌体上清和细菌沉淀,经SDS-PAGE 检测,结果显示重组菌中Fbier-2 获得高水平表达,重组蛋白的分子量大小约为70 ku(图2),经纯化后,浓度为0.7 mg/mL。
2.3 Fiber-2 间接ELISA 方法的建立 经反应优化,确定Fiber-2 蛋白最佳包被量为0.1 μg/ 孔,最佳包被条件为37 ℃包被2 h,4 ℃静置12 h;最佳封闭液为:5 %脱脂乳,封闭时间为2 h;血清最佳稀释度为1∶200;血清最佳孵育时间为30 min;羊抗鸡IgG-HRP 二抗最佳稀释度为1∶2 000,最佳孵育时间为30 min。

图2 重组菌pET32a-fiber-2/BL21 SDS-PAGE 分析Fig.2 SDS-PAGE analysis
2.4 间接ELISA 阴阳性临界值的确定 采用优化的ELISA 实验条件检测60 份SPF 鸡阴性血清(图3),测定的OD450nm平均值为0.0842,标准差为0.0182,按照临界值公式计算该方法临界值为:0.139。即当样品的OD450nm值大于等于0.139 可视为阳性,小于0.139 为阴性,介于之间的为可疑。
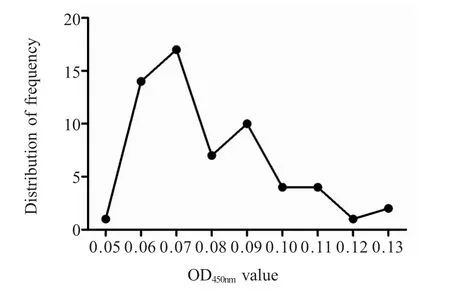
图3 阴性血清OD450nm 的正态分布图Fig.3 Normal distribution of negative serum based on OD450nm level
2.5 特异性试验 采用建立的间接ELISA 方法检测ND、IB、IBD、EDS76、MD、AL 以及H5N1 和H9N2 亚型流感阳性血清,同时设立FAdV-4 阳性血清和阴性对照。结果显示:以Fiber-2 作为包被抗原的间接ELISA 方法,与上述血清均无交叉反应,仅与FAdV-4 阳性血清反应(图4)。表明建立的间接ELISA 方法有较强的特异性。
2.6 敏感性试验 将FAdV-4 阳性血清从1∶100 倍比稀释至1∶51 200,按照本实验确定的最佳反应条件进行ELISA 检测。结果显示,当FAdV-4 阳性血清稀释至1∶12 800 时,检测结果仍为阳性(图5)。表明建立的ELISA 检测方法具有较高的敏感性。
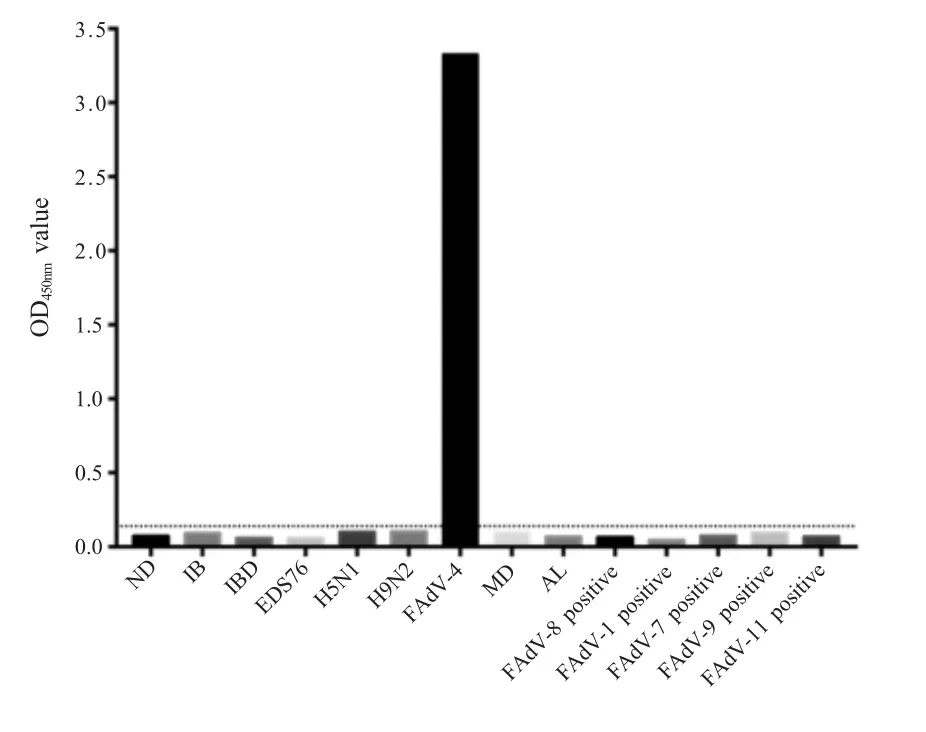
图4 ELISA 特异性试验结果Fig.4 Detection of specificity of ELISA
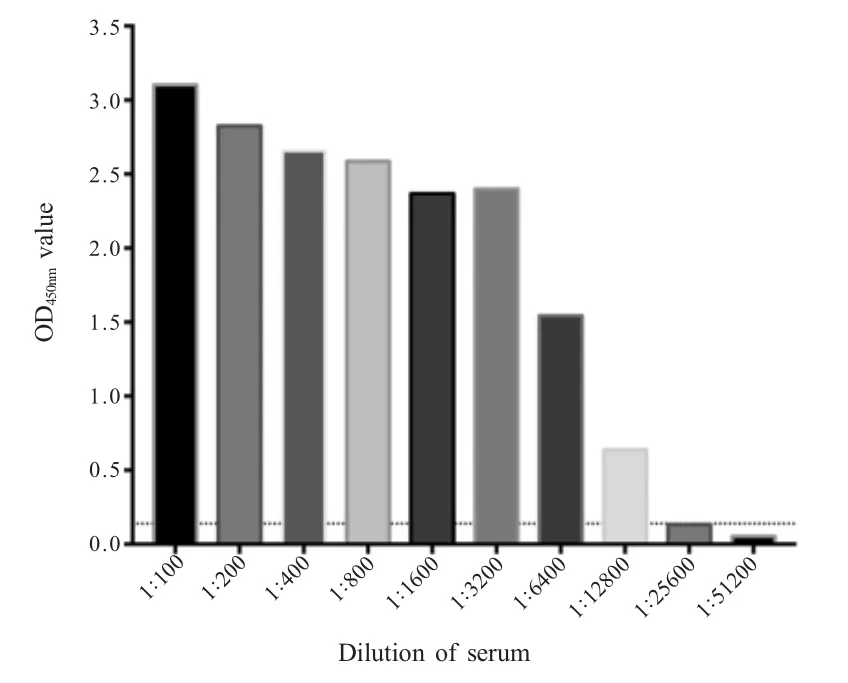
图5 敏感性试验结果Fig.5 Sensitivity detection
2.7 重复性试验 采用建立的ELISA 方法对4 份阳性血清和1 份阴性血清进行批内重复试验和批间重复试验,结果显示:批内重复试验的变异系数在2.98 %~6.70 %,而批间重复试验的变异系数在0.66 %~5.09 %,变异系数均小于10 % (表1)。表明该间接ELISA 检测方法具有较好的重复性。
2.8 临床血清样品检测结果 采用本实验建立的ELISA 检测方法和AGP 抗体检测方法,分别对临床血清样品进行检测。结果显示:13 份FAdV-4 灭活苗的免疫血清和15 份鸡血清均为阳性,12 份阴性血清均为阴性,AGP 实验同样显示:13 份免疫FAdV-4 灭活苗的鸡血清和15 份鸡血清均为阳性。AGP 效价均在1∶8~1∶32,而12 份阴性血清结果则呈现双阴性。结果显示,ELISA 检测结果与AGP 试验结果100 %相符,表明基于Fiber-2 的间接ELISA检测方法可以用于FAdV 临床血清学监测。
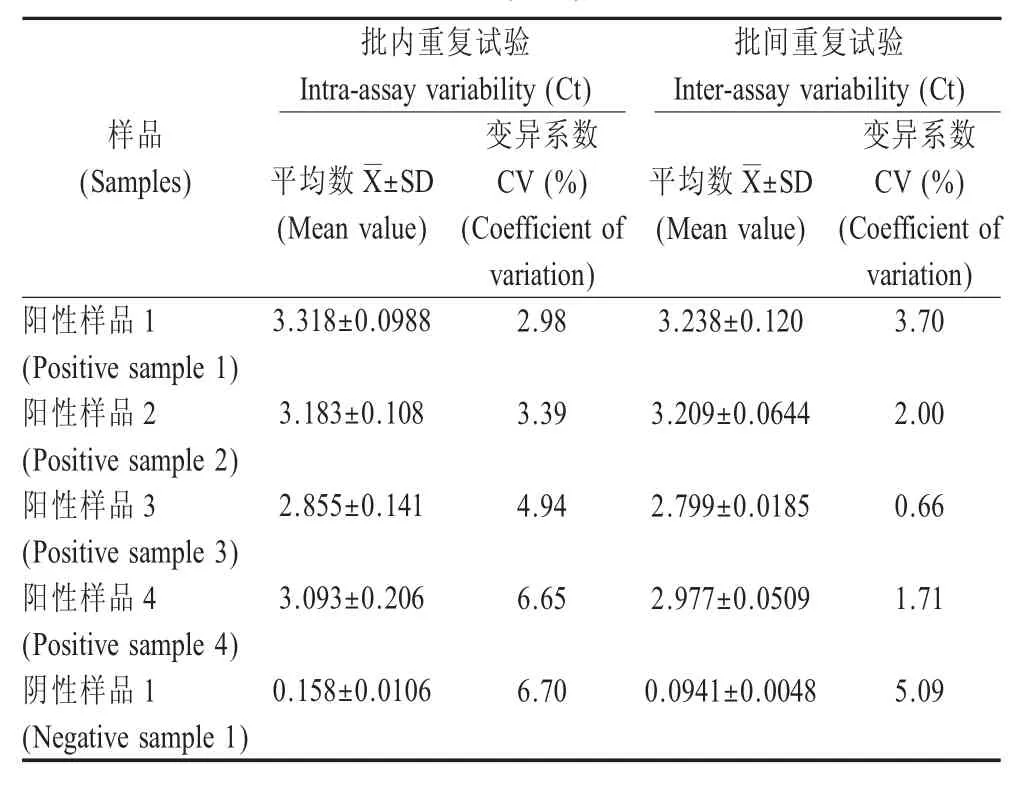
表1 批内和批间重复性试验结果(n=5)Table 1 Results of intra- and inter- assay repeatability test (n=5)
3 讨 论
自2015 年至今,由FAdV-4 在我国大面积流行,引起鸡的心包积液综合征(Hydropericardium syndrome,HPS)和包涵体肝炎(Inclusion body hepatitis in chicken,IBH)[1-2],严重危害我国养鸡业。在感染鸡的FAdV 12 种血清型中,FAdV-4 是主要的流行株。灭活疫苗可以用于防控该病流行[7],为了特异性监测该病的免疫效果,急需建立特异的FAdV-4 血清学检测方法。
马洪涛等应用FAdV-4 病毒作为包被抗原,建立了检测FAdV 的方法,但是用全病毒包被加大了散毒的风险,增加了生物安全危害[8]。谢泉建立了以Hexon 蛋白为包被抗原的检测FAdV 的ELISA 方法,但是阳性血清检出率不高,分析可能是Hexon蛋白自身无法刺激机体产生相应的抗原,从而影响阳性血清的检出[9]。
在FAdV 的其它结构蛋白中,Fiber 在FAdV 的感染与致病过程中扮演着重要的角色,与毒力增强相关[5-6]。FAdV-4 基因组包含两个fiber基因,分别是fiber-1和fiber-2,两个基因分别编码长纤突和短纤突,两个蛋白的多肽图谱也不相同[10]。Fiber-2 对病毒的增殖、组装或扩增中的某些阶段十分必要,有研究发现缺乏Fiber-2 导致病毒粒子无法形成[7]。纤突蛋白中含有FAdV 的重要抗原表位,有主要的种特异性抗原决定簇和次要的亚属特异性抗原决定簇,可诱导中和抗体的产生[10]。
本研究对FAdV-4 AQ 株的fiber-2基因进行原核表达,随后以Fiber-2 蛋白作为包被抗原,建立了以Fiber-2 作为检测抗原的间接ELISA 检测方法。该方法对NDV、IBV、IBDV、EDSV、MDV、ALV 以及H5 和H9 的亚型流感阳性血清均无交叉反应,也与其它FAdV 血清型的特异性抗体无交叉反应,该方法具有较强的特异性。在重复性试验中,批内重复试验的变异系数在2.98 %~6.70 %,批间重复试验的变异系数在0.66 %~5.09 %,均小于10 %,具有较好的重复性。在临床试验中,间接ELISA 试验结果与AGP 结果符合率100 %。本研究建立的ELISA检测方法具有良好的检测效果,可以广泛应用到特异性FAdV-4 抗体的临床检测中。
