富氢气氛下CeO2-NiO纳米棒催化剂的CO选择性氧化性能研究
2019-10-09李树娜朱华青王瑞义李志凯张亚刚
李树娜,朱 刚,石 奇,杜 威,朱华青,王瑞义,李志凯,张亚刚
(1.西安文理学院化学工程学院 陕西省表面工程与再制造重点实验室,西安市智能增材制造重点实验室,陕西 西安 710065;2.中国科学院山西煤炭化学研究所 煤转化国家重点实验室,山西 太原 030001;3.西安科技大学 化学与化工学院,陕西 西安 710054)
质子交换膜燃料电池(PEMFC)是一种绿色高效的环保电源,兼具低排放、比功率大等优点而备受青睐,其工作需要的氢气由甲醇或天然气水蒸气重整提供。通常,在重整气中含有较高浓度的CO,即使经过水煤气变换反应后,其体积分数仍可达0.5%-2.0%[1]。由于CO对燃料电池Pt电极的毒化作用会导致其工作效率下降,所以必须在氢气纯化时将CO的体积分数降至1.0×10-4以下[2]。CO选择性氧化是简单、直接且有效的脱除富氢气体中CO的方法(由于重整产物中O2含量很低,CO选择性氧化需要的O2由外界的空气提供),其应用的关键是制备高活性及选择性的催化剂。近年来,研究较多的贵金属催化剂(如Au、Pt、Pd等)虽然低温催化性能优良,但受其资源及价格等方面的限制而难于规模化推广应用。因此,非贵金属催化剂的开发也成为研究者们关注的焦点。
萤石结构CeO2中的Ce3+/Ce4+能够迅速可逆转化而使其具有良好的氧化还原性能和储放氧能力,常被用作催化剂的助剂及载体。大量研究表明[3-5],在CeO2中引入其他金属离子形成固溶体能够显著提升其热稳定性和催化性能。NiO是不多见的p型半导体之一,具有较宽的带隙。此外,由于Ni具有出色的断裂C-C键的能力,被广泛用于多相催化反应中[6,7];研究者们对CeO2和NiO的相互掺杂也做了大量研究。Shan等[8]研究发现,用NiO掺杂CeO2能形成大量的氧空位进而提升Ce0.7Ni0.3O2催化剂的甲烷燃烧催化活性。Liu等[9]采用草酸盐凝胶共沉淀法制备了一系列CeNiO催化剂,研究发现,Ni的引入使CeO2晶格中形成了大量氧空位,氧空位能够吸附并活化分子氧进而提升催化剂的丙烷氧化脱氢催化性能。
此外,研究还证实CeO2的性能与其自身形貌密切相关,形貌的差异会导致其暴露的晶面不同进而影响其催化性能。目前,研究者们对CeO2形貌的控制合成也做了大量研究工作,不同形貌的CeO2如花朵状[10]、纳米线[11]、纳米棒[12]、纳米片[13]及微球[14]等已被制得。其中,纳米棒CeO2由于暴露活性(110)和(100)晶面利于氧空位的形成而在CO低温氧化及水煤气变换反应中显示出优异的催化性能[15,16]。鉴于此,以NiO对CeO2进行掺杂制备CeO2-NiO纳米棒是进一步提升其催化性能的有效方法。Maitarad等[17]研究了纳米棒NiO/CeO2的NH3选择性催化还原反应,结果显示其NO转化率(250 ℃的NO转化率为65.90%)高于纯CeO2纳米棒和NiO颗粒。Zhang等[18]研究发现,NiO/CeO2纳米棒催化剂可在350-600 ℃将甲烷完全氧化,其催化活性较纯CeO2及NiO/SiO2催化剂高,这主要归因于CeO2纳米棒与NiO颗粒间的协同作用。尽管当前已经制得CeO2/NiO纳米棒及多种不同形貌的CeO2-NiO催化剂并用于各类催化反应体系中,但有关纳米棒CeO2-NiO催化剂控制合成及其用于CO PROX的报道很少。
基于此,本研究采用水热法通过改变Ce/Ni物质的量比制备了一系列纳米棒CeO2(x)-NiO催化剂。以N2吸附-脱附、XRD、TEM、拉曼光谱、H2-TPR及XPS等表征手段对催化剂的形貌、结构进行了表征。考察了Ce/Ni物质的量比对纳米棒CeO2(x)-NiO催化剂形貌及富氢气氛下CO PROX反应性能的影响。
1 实验部分
1.1 样品的制备
不同Ce/Ni物质的量比的CeO2(x)-NiO催化剂采用水热法制备,以Ce/Ni物质的量比为8∶1(x=0.89)的样品为例介绍CeO2(x)-NiO催化剂的水热法制备过程:室温下,将Ce(NO3)3·6H2O(4.0 mmol)和Ni(NO3)2·6H2O(0.5 mmol)溶液混合并滴入KOH(90 mL,6 mol/L)溶液中,剧烈搅拌0.5 h,然后将反应液置于水热合成釜中,在烘箱中于110 ℃下反应24 h;冷却后,经过滤、洗涤,80 ℃下干燥12 h,400 ℃焙烧4 h。得到的催化剂记为CeO2(x)-NiO,其中,x=n(Ce)/[n(Ce)+n(Ni)]。
1.2 样品的表征
在TriStar 3000型物理吸附仪上测定样品的比表面积,测试之前在200 ℃、0.133 Pa下脱气预处理1 h。
催化剂的晶相结构在Bruker公司的AXS D8衍射仪上得到。Cu靶,Kα为发射源(λ=0.15406 nm),5°-85°扫描,扫描步长0.02°。
采用JEM2010型透射电子显微镜测得催化剂的TEM照片。测试前将催化剂经无水乙醇超声分散并滴在铜网碳支持膜上,空气中风干后进行观测。
催化剂的氢气程序升温还原(H2-TPR)在Micromeritics AutoChem Ⅱ 2920化学吸附仪上进行。具体测试过程如下:将50 mg催化剂置于U型管中,先在250 ℃下用5%O2/Ar(体积比)气流吹扫30 min,之后于Ar气流中恒温吹扫30 min,降至室温;基线平稳后,切换为30 mL/min 10%H2/Ar(体积比)还原气,以10 ℃/min的升温速率从室温升至800 ℃并记录TCD信号,用CuO标样校正计算耗氢量。
在Horiva Jobin Yvon LabRam HR800光谱仪上采集样品的拉曼光谱,氩离子激光器光源(λ=154.5 nm)。
催化剂的X射线光电子能谱(XPS)测定在ULVAC PHI-5800光谱仪上进行,AlKα为射线,用284.6 eV的污染碳校正荷电效应。
1.3 CO选择性氧化反应
催化剂的CO PROX活性评价在固定床反应装置中进行。测试时,将200 mg 40-60目的催化剂装入内径为6 mm的U型反应管中;原料气体积组成为1% CO、1% O2、50%H2、N2平衡,总流量为100 mL/min,空速为30000 mL/(h·g)。反应尾气用气相色谱仪SHIMADZU GC-2010在线分析,先用TCD检测O2含量,之后气体进入甲烷化炉并由FID检测CO和CO2含量。CO和O2的转化率及CO2的选择性计算公式如下:
CO conversion (xCO)=[CO2]out/([CO]out+ [CO2]out)× 100%
(1)
O2conversion (xO2)=([O2]in-[O2]out)/[O2]in× 100%
在借助微课教学手段开展小学数学教学的过程中,教师一定要注意教学安排的合理性,保证视频能够激发学生的学习兴趣,能够推动学生思维以及自主学习意识的发展。此外,在具体的教学过程中,教师一定要摆正自身的教学态度,切忌对该种教学模式产生依赖心理,影响整体的教学质量[1]。
(2)
CO2selectivity (sCO2)=xCO/2xO2
(3)
2 结果与讨论
2.1 CeO2(x)-NiO纳米棒催化剂的物相分析和比表面积
图1为CeO2(x)-NiO纳米棒催化剂的XRD谱图。由图1可知,纯CeO2(x=1)在28.6°、33.1°、47.6°、56.4°、59.2°、69.5°、76.8°、79.2°处出现方铈矿(JCPDS 34-0394)立方晶相的特征衍射峰;纯NiO(x=0)在37.3°、43.3°、62.9°、75.4°、79.4°处出现强烈而尖锐的尖晶石结构NiO(JCPDS 75-0197)特征衍射峰。对于CeO2(x)-NiO复合氧化物,镍含量较低(x=0.89)时,XRD谱图中仅观察到CeO2的特征衍射峰,说明少量镍物种对催化剂的晶型结构影响不大,同时也可能是镍物种进入CeO2的晶格内部形成了铈镍固溶体或是高度分散在CeO2的表面上。Tang等[19]发现,NiO-CeO2复合氧化物中Ni物相的物质的量比超过20%时,才检测到有关Ni物相的特征衍射峰。CeO2(0.89)-NiO复合氧化物中Ni的物质的量比仅为11%,因此,没有检测到Ni物相的特征衍射峰,与文献报道一致。随着镍含量的增加,CeO2(0.5)-NiO和CeO2(0.11)-NiO的XRD谱图中出现NiO的特征衍射峰,该衍射峰强度随着镍含量的增加而增强;除此之外,这两个样品的XRD谱图中仍检测到明显的CeO2特征衍射峰,说明NiO的大量掺杂仍没有破坏CeO2的晶体结构。

图1 CeO2(x)-NiO纳米棒催化剂的XRD谱图Figure 1 XRD patterns of the CeO2(x)-NiO nanorods catalysts with different Ce contentsa:x=1;b:x=0.89;c:x=0.5;d:x=0.11;e:x=0
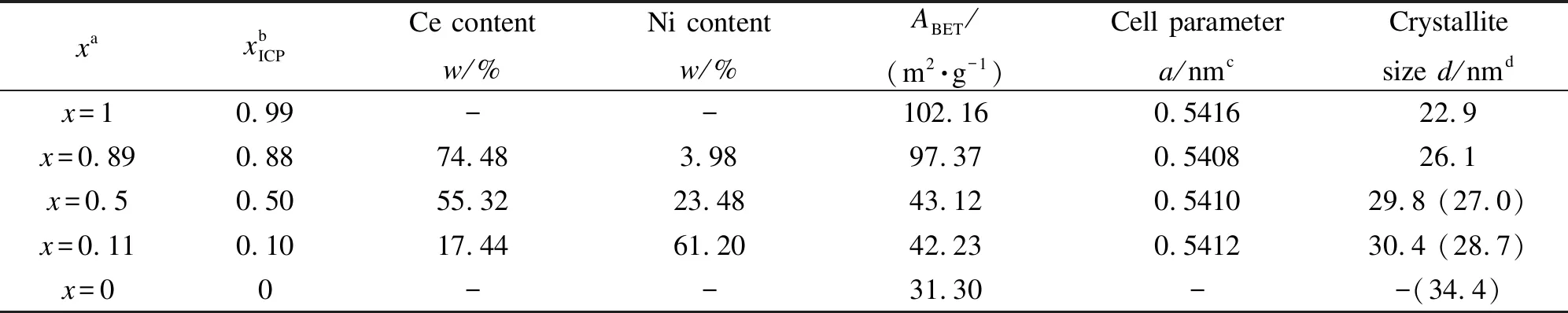
表1 CeO2(x)-NiO纳米棒催化剂的化学组成、比表面积和XRD分析Table 1 Chemical composition,surface area and XRD analysis results of the CeO2(x)-NiO nanorods catalysts with different Ce contents
a:xis the nominal content of Ce in the composite oxides expressed as the atomic ratio ofn(Ce)/(n(Ce)+n(Ni));b:xICPis the value of the atomic ratio ofn(Ce)/(n(Ce)+n(Ni))determined by ICP analysis;c:calculated from the a value of the ceria (111)planes;d:crystalline size is calculated from the line broadening of CeO2(111)and NiO (200)(digitals in brackets)diffraction peak by the Scherrer equation from XRD patterns
表1为CeO2(x)-NiO纳米棒催化剂的化学组成、比表面积和XRD分析。由表1可知,CeO2(x)-NiO纳米棒催化剂中Ce和Ni物质的量比与实际投料比接近,说明水热法能够制得所需化学计量比的样品;与作者前期研究中得到的结果相符[20]。由表1中CeO2(x)-NiO纳米棒催化剂的晶胞参数可知,与纯CeO2相比,CeO2(x)-NiO复合氧化物催化剂的晶胞参数变小,推测离子半径较小的Ni2+(0.072 nm)进入到了CeO2的晶格中(Ce3+半径0.103 nm、Ce4+半径0.099 nm)形成了固溶体[8],引起了晶格收缩变形。由表1还可知,纯CeO2的比表面积为102.16 m2/g,纯NiO的比表面积为31.30 m2/g;掺杂NiO后,随着镍含量的增加,CeO2(x)-NiO催化剂的比表面积逐渐减小。此外,对比表1中纯CeO2与CeO2(x)-NiO复合氧化物催化剂的晶粒粒径可知,镍含量的增加使得催化剂晶粒粒径变大。
2.2 CeO2(x)-NiO纳米棒催化剂的透射电镜分析
图2为CeO2(x)-NiO纳米棒催化剂的TEM照片。由图2可知,纯CeO2(x=1)具有规则的棒状结构,表面光滑,棒的长度为40-100 nm、直径约为10 nm;纯NiO(x=0)粒径为20-30 nm的无规则颗粒和少量短纳米棒。在CeO2中引入少量NiO,得到短粗的CeO2(0.89)-NiO复合氧化物纳米棒,表面仍较为光滑,可能Ni离子进入到CeO2晶格中形成了Ce-O-Ni固溶体,与XRD分析结果一致。由图2(c)可知,当Ce/Ni物质的量比为1∶1时(x=0.5),CeO2(0.5)-NiO复合氧化物纳米棒变粗变长,其直径为50-100 nm,长度为400-700 nm;此外,还观察到明显的NiO颗粒附着在CeO2表面上,表明除部分Ni离子进入到CeO2晶格形成Ce-O-Ni固溶体外,还有纯NiO物相存在。当镍的含量进一步增加至x=0.11时,由图2(d)仍能观察到少量纳米棒,此外,还观察到大量无规则颗粒,联系XRD分析,CeO2(0.11)-NiO复合氧化物纳米棒中仍能检测到明显的CeO2特征衍射峰,说明NiO的大量掺杂没有破坏CeO2的晶体结构,由此推断该样品中少量纳米棒的主要物相可能是CeO2及Ce-O-Ni固溶体,而大量无规则颗粒可能是NiO。

图2 CeO2(x)-NiO纳米棒催化剂的TEM照片Figure 2 TEM images of the CeO2(x)-NiO nanorods catalysts with different Ce contents(a):x=1;(b):x=0.89;(c):x=0.5;(d):x=0.11;(e):x=0

图3 CeO2(x)-NiO纳米棒催化剂的HRTEM照片Figure 3 HRTEM images of the CeO2(x)-NiO nanorods catalysts with different Ce contents(a):x=1;(b):x=0.5;(c):x=0
图3为CeO2(x)-NiO纳米棒催化剂的HRTEM照片。由图3(a)可知,纳米棒CeO2主要暴露CeO2的(110)和(100)晶面,与文献报道及作者前期研究中观察到的结果相符[16,21]。由图3(c)可知,纯NiO主要暴露其(111)和(200)晶面。对于CeO2(x)-NiO复合氧化物纳米棒,当镍含量较低时(x=0.89),尽管ICP分析检测到了NiO的存在,但在HRTEM照片中没有发现有关NiO的晶面信息,只观察到CeO2的(110)和(100)晶面,由此推测,NiO的晶粒粒径很小或以无定型状态存在,也有可能是其进入CeO2晶格中形成了固溶体,与XRD分析结果一致。随着镍含量的增加,由图3(b)可知,CeO2(0.5)-NiO纳米棒中同时检测到了NiO和CeO2的晶面信息,其中,无规则颗粒主要是NiO物相,而纳米棒则主要是CeO2物相,与以上推断一致。
2.3 CeO2(x)-NiO纳米棒催化剂H2-TPR分析
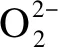
图4 CeO2(x)-NiO纳米棒催化剂的H2-TPR谱图Figure 4 H2-TPR profiles of the CeO2(x)-NiO nanorods catalysts with different Ce contentsa:x=1;b:x=0.89;c:x=0.5;d:x=0.11;e:x=0
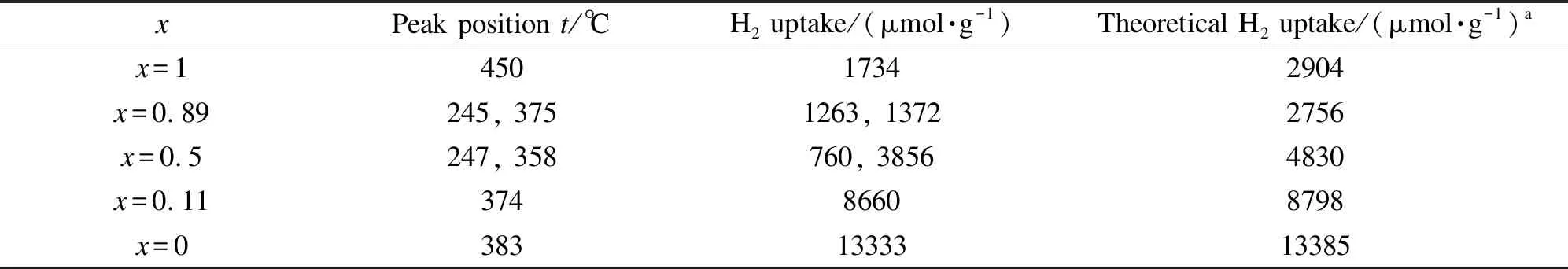
表2 CeO2(x)-NiO纳米棒催化剂的H2-TPR表征Table 2 H2-TPR results of the CeO2(x)-NiO nanorods catalysts with different Ce contents
a:theoretical H2uptake for reduction of CeO2(x)-NiO nanorods catalysts,as calculated by assuming that CeO2and NiO are stoichiometrically reduced to Ce2O3and Ni,respectively
2.4 CeO2(x)-NiO纳米棒催化剂的拉曼光谱分析
图5为CeO2(x)-NiO纳米棒催化剂的拉曼光谱谱图。
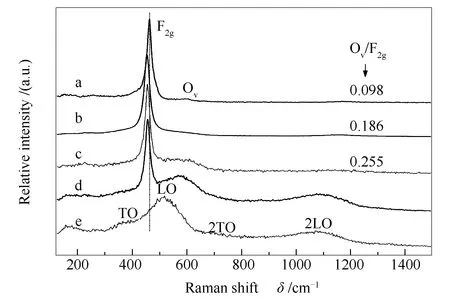
图5 CeO2(x)-NiO纳米棒催化剂的拉曼光谱谱图Figure 5 Raman spectra of the CeO2(x)-NiO nanorods catalysts with different Ce contentsa:x=1;b:x=0.89;c:x=0.5;d:x=0.11;e:x=0
由图5可知,纯CeO2在460 cm-1处出现萤石结构的F2g特征振动峰;大约600 cm-1处出现可以证实Ce3+存在的氧空位弱峰(Ov)[23]。纯NiO大约410和515 cm-1处出现的拉曼振动峰可归属为NiO的一级横向光子(TO)和纵向光子振动(LO),位于约710和1100 cm-1处的弱峰可归属为2TO与2LO的组合[24]。由图5还可知,与纯CeO2的拉曼光谱相比,CeO2(x)-NiO复合氧化物纳米棒中仍可观察到F2g振动峰,但由于NiO与CeO2之间的相互作用改变了Ce离子周围的化学环境导致CeO2(x)-NiO复合氧化物的F2g峰向低波数方向偏移。
根据Raman光谱中Ov与F2g拉曼峰的峰面积之比(Ov/F2g)可以估算催化剂中氧空位的相对含量,比值越大氧空位越多。由图5可知,Ov/F2g随着镍含量的增加而变大,说明增加镍含量可以提高氧空位含量。与CeO2(0.89)-NiO和CeO2(0.5)-NiO复合氧化物纳米棒相比,CeO2(0.11)-NiO复合氧化物纳米棒位于约600 cm-1处的拉曼峰强度虽然更强,但因其镍的含量较高,该峰有可能与纯NiO位于515 cm-1处的纵向光子振动拉曼振动峰(LO)重合,因此,难于精确计算其氧空位的含量。
2.5 CeO2(x)-NiO纳米棒催化剂的XPS分析
图6为CeO2(x)-NiO纳米棒催化剂的Ce 3dXPS谱图。由图6可以看出,Ce出现了两套分别来自于3d3/2和3d5/2的自旋轨道峰U和V。从图6中还可知,纯CeO2及CeO2(x)-NiO纳米棒中的铈主要以Ce4+形式存在,同时含有少量的能够证实氧空位存在的Ce3+离子。其中,901.2和882.4 eV处的U和V信号峰、907.4和888.5 eV处的U″和V″信号峰及916.6和898.3 eV处的U‴和V‴信号峰的出现,证实了Ce4+的存在;899.0、880.4、903.3和884.3 eV处U0、V0、U′和V′信号峰的出现,则证实了Ce3+的存在[21]。
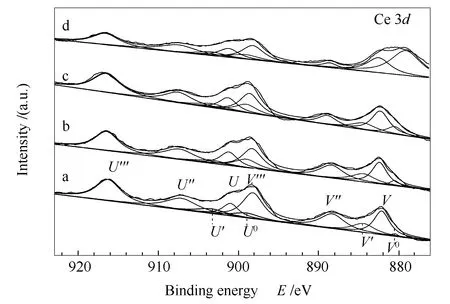
图6 CeO2(x)-NiO纳米棒催化剂的Ce 3d XPS谱图Figure 6 Ce 3d XPS spectra of the CeO2(x)-NiO nanorods catalysts with different Ce contentsa:x=1;b:x=0.89;c:x=0.5;d:x=0.11
图7为CeO2(x)-NiO纳米棒催化剂的Ni 2pXPS谱图。由图7可知,CeO2(x)-NiO纳米棒分别在853.7、855.6和860.7 eV处出现Ni 2p3/2轨道峰;其中,位于853.7和855.6 eV处的主峰(分别记为A和B)归属为Ni2+物种,而位于860.7 eV处的信号峰(sat)是典型的Ni2+(NiO)和Ni3+(Ni2O3)的振荡伴峰[25]。Solsona等[26]报道,运用860.7与853.7 eV处信号峰的强度比(sat/A)可以估算催化剂中Ni2+缺陷位的相对含量,比值越大缺陷位越多。由图7可知,与纯NiO相比,CeO2(x)-NiO纳米棒催化剂的sat/A值均大于纯NiO,表明Ni和Ce之间相互掺杂利于Ni2+缺陷位的形成;其中,CeO2(0.89)-NiO催化剂中sat/A值最大,说明其缺陷位最多。
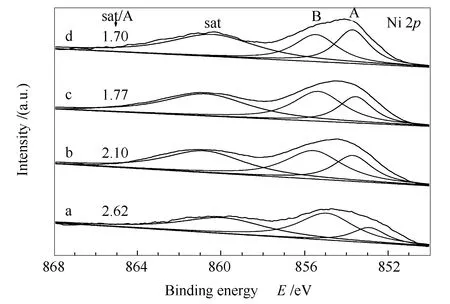
图7 CeO2(x)-NiO纳米棒催化剂的Ni 2p XPS谱图Figure 7 Ni 2p XPS spectra of the CeO2(x)-NiO nanorods catalysts with different Ce contentsa:x=0.89;b:x=0.5;c:x=0.11;d:x=0
图8为CeO2(x)-NiO纳米棒催化剂的O 1sXPS谱图。
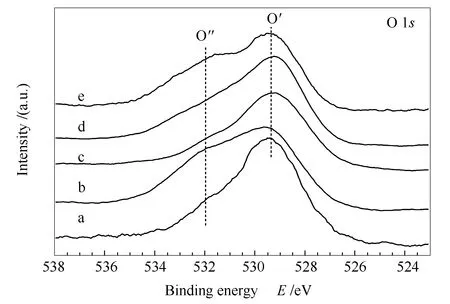
图8 CeO2(x)-NiO纳米棒催化剂的O 1s XPS谱图Figure 8 O 1s XPS spectra of the CeO2(x)-NiO nanorods catalysts with different Ce contentsa:x=1;b:x=0.89;c:x=0.5;d:x=0.11;e:x=0
由图8可知,所有样品的O 1sXPS谱图中均出现两个信号峰,其中,约529.4 eV处的O′峰对应于金属氧化物中晶格氧的峰,532.1 eV处的O″峰是表面吸附活性氧、化学吸附氧及羟基中的氧[27]。与纯CeO2相比,CeO2(x)-NiO复合氧化物纳米棒的O″肩峰强度略有增加,尤其是CeO2(0.89)-NiO纳米棒,表明CeO2(x)-NiO复合氧化物纳米棒的表面吸附氧更多,利于提升催化剂的活性。
2.6 富氢气氛下CeO2(x)-NiO纳米棒催化剂的CO PROX催化性能
图9为富氢气氛下CeO2(x)-NiO纳米棒催化剂的CO PROX催化活性和选择性。
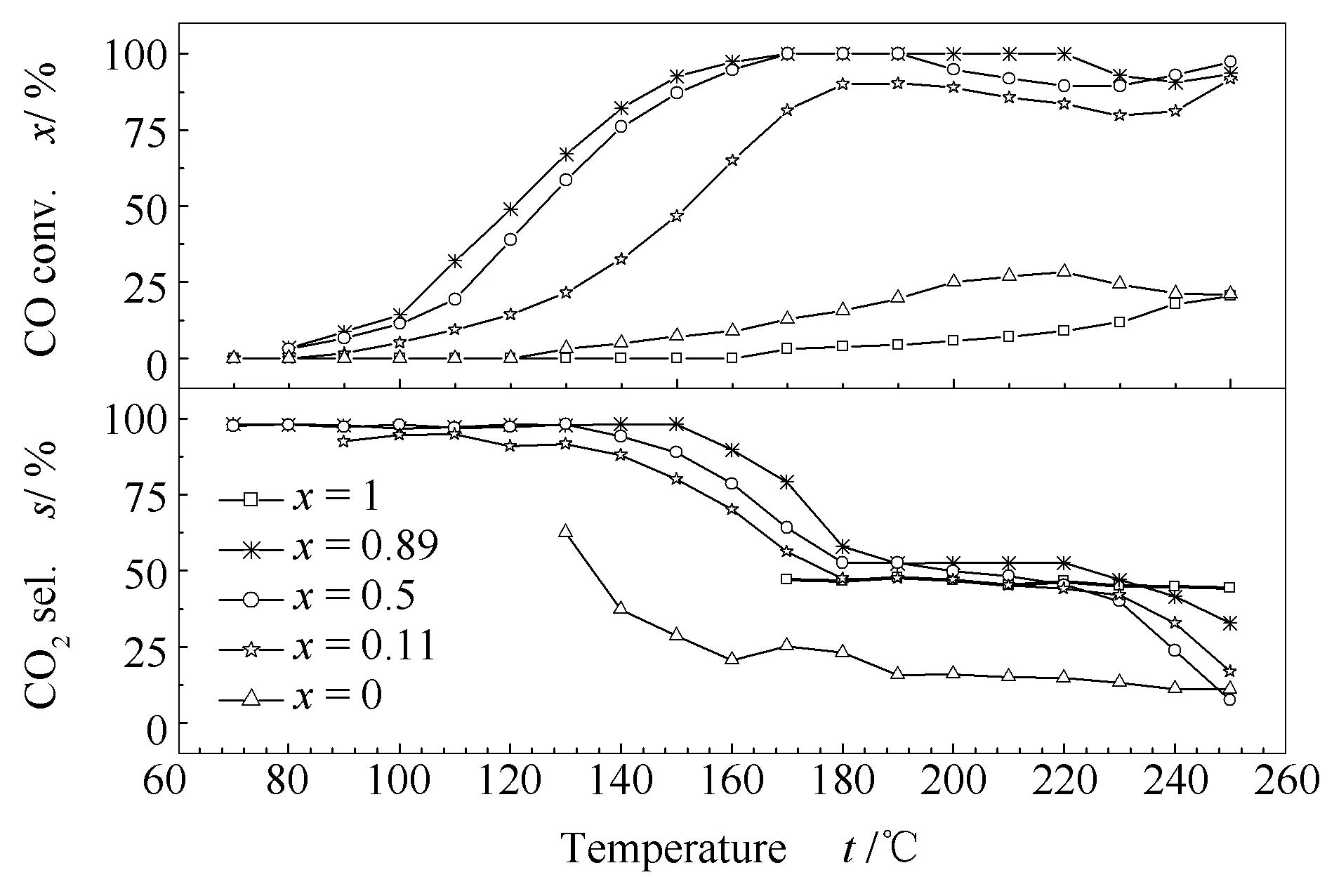
图9 CeO2(x)-NiO纳米棒催化剂的CO PROX催化活性和选择性Figure 9 Temperature-programmed reaction of CO PROX over the CeO2(x)-NiO nanorods catalysts with different Ce contents
由图9可知,在整个测试范围内,纯CeO2和NiO的CO PROX催化活性和选择性均较低;与之相比,CeO2(x)-NiO复合氧化物纳米棒的活性及选择性明显提高;其中,CeO2(0.89)-NiO复合氧化物纳米棒的CO转化率和CO2选择性最好,在170-220 ℃的反应条件下其CO转化率保持100%不变,CO2选择性约为52%,反应温度的升高导致其CO转化率和CO2选择性下降,可能发生了H2与O2结合生成H2O的副反应;CeO2(0.5)-NiO复合氧化物纳米棒的CO转化率和CO2选择性次之,在170-190 ℃反应条件下可将CO完全转化,CO2选择性约为50%,副反应的发生同样也导致其催化性能随反应温度升高而下降;当CeO2(x)-NiO复合氧化物纳米棒中镍含量较高时,CeO2(0.11)-NiO复合氧化物纳米棒的CO转化率和CO2选择性明显降低,190 ℃时,其CO转化率仅为90.32%,CO2选择性约为47%,副反应也使得其催化性能下降。此外,由图9还可知,当反应温度高于240 ℃时,CeO2(x)-NiO复合氧化物纳米棒的CO转化率又开始上升,由此推测,可能是CO与H2发生了甲烷化反应。目前,镍基材料因甲烷化活性、选择性均较高且价格低廉而被广泛用作甲烷化催化剂。Behzad等[28]制得的Ni质量分数为50%的Ni/CeO2催化剂在CO选择性甲烷化反应中显示出良好的催化性能。
联系上述表征结果可知,与纯CeO2和NiO相比,CeO2(x)-NiO纳米棒催化剂中Ce和Ni之间的相互作用提升了其晶格氧的流动性,促进了表面氧空位的形成,最终使得CeO2(x)-NiO纳米棒催化剂的还原能力和CO PROX催化性能均得到提升。当镍含量较少时,部分Ni2+可进入到CeO2的晶格中形成Ce-O-Ni固溶体并伴随氧空位的形成,这些氧空位能够有效地活化O2进而促进氧化反应的进行;当镍含量增加时,如CeO2(0.5)-NiO和CeO2(0.11)-NiO纳米棒催化剂中,部分NiO颗粒可能会覆盖氧空位导致其催化性能下降。
3 结 论
采用水热合成法,通过改变Ce/Ni物质的量比制得了一系列CeO2(x)-NiO纳米棒催化剂。运用N2吸附-脱附、XRD、TEM、拉曼光谱、H2-TPR及XPS等技术对催化剂的形貌、结构进行了表征。考察了Ce/Ni物质的量比对CeO2(x)-NiO催化剂形貌及富氢气氛下CO PROX反应性能的影响。研究结果表明,调变Ce/Ni物质的量比可制得不同粒径的CeO2(x)-NiO纳米棒催化剂,将NiO掺入CeO2明显提升了CeO2(x)-NiO纳米棒催化剂的氧化还原能力。Ce/Ni物质的量比对CeO2(x)-NiO纳米棒催化剂的CO PROX催化性能影响显著,当CeO2(x)-NiO纳米棒催化剂中镍含量较低时其氧空位及表面吸附活性氧物种较多,利于提升其催化性能;因此,镍含量较低的CeO2(0.89)-NiO纳米棒催化剂显示出最好的催化性能,在170-220 ℃的反应条件下可将CO完全转化,CO2选择性约为52%;随着镍含量的升高,部分NiO颗粒可能覆盖了氧空位导致其催化性能下降。
