TREM2基因与中国福建阿尔茨海默病患者相关性分析
2019-10-03江斌毕敏马琪林童绥君
江斌?毕敏?马琪林?童绥君

【摘要】 目的:探讨TREM2基因与中国福建阿尔茨海默病(Alzheimer disease,AD)患者的关联性。方法:纳入中国福建地区106例AD患者(AD组)和120例健康对照者(健康对照组),提取其外周血白细胞DNA和RNA,运用Sanger测序方法检测TREM2基因R47H变异,同时利用实时荧光定量PCR方法检测mRNA表达水平,分析TREM2基因与AD的相关性。结果:AD组与健康对照组TREM2基因R47H变异比较,差异无统计学意义(P>0.05),同時两组人群TREM2基因mRNA水平相比,差异无统计学意义(P>0.05)。结论:TREM2基因可能与中国福建AD患者无明显相关性。
【关键词】 阿尔茨海默病; TREM2基因; R47H变异; 中国福建
Associations between TREM2 Gene and Alzheimer Disease Patients in Fujian Province of China/JIANG Bin,BI Min,MA Qilin,et al.//Medical Innovation of China,2019,16(24):-157
【Abstract】 Objective:To clarify the associations between the TREM2 gene and Alzheimer disease(AD)patients in Fujian province of China.Method:We investigated 106 AD patients(AD group)and 120 healthy controls(healthy control group)in Fujian province.DNA and RNA were extracted from peripheral blood leukocytes,the R47H variant in TREM2 gene was detected by Sanger sequencing.Moreover,the level of mRNA was determined by quantitative Real-time PCR,and the correlation between TREM2 gene and AD was analyzed.Result:The genotypic and allelic distributions of R47H variant were not statistically significant different between AD group and the healthy control group(P>0.05).Meanwhile,the level of mRNA of TREM2 gene was not statistically significant different between two groups(P>0.05).Conclusion:There is no association between TREM2 gene and AD patients in Fujian province of China.
【Key words】 Alzheimer disease; TREM2 gene; R47H variant; Fujian province of China
First-authors address:First Affiliated Hospital of Xiamen University,Xiamen 361003,China
doi:10.3969/j.issn.1674-4985.2019.24.041
阿尔茨海默病(Alzheimer disease,AD)是一种以进行性不可逆的认知功能障碍和行为损害为主要特征的神经退行性疾病,是痴呆最常见的类型,随着疾病的进展,患者的社会能力和工作能力逐渐丧失。目前全世界约有AD患者3 560万人,约占全球总人数的1%,预计患病人数至2050年将增加至1.154亿人[1],同时全世界每年花费在AD患者上的经济费用高达1 830亿美元,可见AD对全人类是一个沉重的负担。根据有无家族史,AD分为家族性AD(familial AD,FAD)和散发性AD(sporadic AD,SAD),其中95%AD患者为SAD,他们的发病年龄多大于65岁。SAD的发病机制尚不明确,目前主要认为与Aβ在脑中聚集形成神经炎性斑和过度磷酸化的Tau蛋白折叠形成神经原纤维缠结相关[2],这些物质的形成导致大脑皮层、杏仁核、海马和基底前脑等多个区域的中枢神经元丢失。
既往研究提示基因在AD的发病和疾病进展中起到重要的作用,基因的变异如基因多态性可以增加AD患病和疾病进展的风险。根据大规模全基因组关联分析,APOE、BIN1、ABCA7、GLU、CD2AP、TREM2等基因证实与SAD发病有关[3-6]。这些基因主要通过影响免疫系统、脂代谢和Aβ代谢参与到AD的发病机制中。其中髓样细胞触发性受体-2(triggering receptor experssed on myeloid cells 2,TREM2)基因是近几年新发现的AD易感基因,其编码区内R47H变异(rs75932628-T)可使SAD的发病风险增加3倍左右[7]。在随后多项高加索AD患者和中国汉族AD患者大样本研究中也证实TREM2基因R47H变异可以显著增加AD的风险[8-10]。
深入研究TREM2基因可以更好地了解AD的发病机制,为药物的治疗提供新的靶点,同时可以结合脑脊液、血清生物标记物和影像表现,观察其与AD进展的相关性。本研究拟验证TREM2基因与中国福建SAD患者是否具有相关性,现报道如下。
1 资料与方法
1.1 一般资料 本研究入组患者为2016年8月-2018年10月在厦门大学附属第一医院神经内科门诊就诊的SAD患者(AD组),共计106例,SAD患者临床评估均由两名以上高年资神经内科专科医师进行。AD临床诊断参照《精神疾病诊断与统计手册第四版》和美国国立神经病语言障碍卒中研究所和阿尔茨海默病及相关疾病协会标准。纳入标准:符合痴呆诊断标准,同时满足隐袭起病,症状逐渐进展;认知损害检查发现遗忘、语言障碍、执行功能障碍、视空间障碍。排除标准:路易小体痴呆、行为变异性额颞叶痴呆、血管性认知障碍、非流利性原发性进行性失语和其他可以导致认知障碍的神经科并发症。同时笔者在同个地区社区中纳入120例健康对照者(健康对照组)。每位患者和健康对照者均进行神经系统检查、神经影像检查和简易智力状态检查量表(MMSE)评估。本研究通过厦门大学附属第一医院伦理委员会批准,参与者均由本人或代理人签署知情同意书。
1.2 方法
1.2.1 外周血白细胞基因组DNA提取 取受试者外周静脉血2 mL加入3倍体积1×红细胞裂解液静置15 min,3 000 r/min室温条件下离心3 min,去除上清。加入2 mL 1×红细胞裂解液重悬细胞,静置10 min后5 000 r/min在室温条件下离心3 min。去除上清后,加入200 ?L 1×PBS液重悬细胞,同时缓慢加入20 ?L蛋白酶和200 ?L AL液,水浴锅内恒温56 ℃孵育20 min。再加入200 ?L無水乙醇,混匀后将EP管内液体转移至QIAamp Spin Colum柱内,室温条件下9 000 r/min离心3 min。加入500 ?L AW1液体后,室温条件下9 000 r/min离心1 min后加入500 ?L AW2液体继续静置,在室温条件下12 000 r/min离心5 min。打开EP管盖子静置15 min使EP管内的乙醇充分挥发。加入150?L预热的AE液室温条件下静置15 min,9 000 r/min离心3 min。EP管内收集到的液体即为外周血白细胞基因组DNA。通过紫外分光光度计检测DNA的质量和浓度,保证其OD260/280比值在1.8~2.0,做好标记后保存于-80 ℃冰箱内。
1.2.2 外周血白细胞RNA提取和逆转录
1.2.2.1 外周血白细胞RNA提取 在外周血白细胞内加入1 mL RNAiso Plus,转移至EP管内。加入200 μL氯仿,上下颠倒使液体充分混匀,在冰上静置15 min后,4 ℃条件下12 000 r/min离心20 min。吸取液体上层水相至新的EP管内,加入500 ?L异丙醇混匀充分,在冰上静置15 min。4 ℃条件下12 000 r/min离心15 min,在EP管底部可见白色沉淀。去除上清,加入1.5 mL 75%乙醇,上下颠倒清洗白色沉淀。4 ℃条件下7 500 r/min离心5 min,去除上清。室温干燥30 min,加入20 ?L DEPC水充分溶解白色沉淀,同时测量RNA浓度,标记后保存于-80 ℃冰箱内。
1.2.2.2 RNA逆转录 使用PrimeScript RT Master Mix试剂盒将RNA逆转录为cDNA。逆转录体系为:2.0 ?L 5×PrimeScript RT Master Mix试剂+500 ng RNA+ddH2O。逆转录PCR反应条件为37 ℃条件下反应15 min,85 ℃条件下反应5 s,4 ℃条件下反应10 min,反应产物保存于-20 ℃条件下。
1.2.3 TREM2基因R47H变异检测 本研究采用Sanger测序方法检测TREM2基因R47H变异,引物由上海生工公司设计合成。实验步骤包括PCR反应、PCR产物纯化、测序反应和酒精纯化,具体操作步骤参考文献[11]。利用Chromas软件对测序结果进行判读,结果与Ensembel数据库中人基因标准序列进行比对。
1.2.4 实时荧光定量PCR 通过Primer Bank设计针对TREM2基因和GAPDH基因特异性引物,建立实时荧光定量PCR反应体系,具体为10 ?mol/?L
浓度正反向引物各0.4 ?L,cDNA模板250 ng,ROX溶液0.2 ?L,SYBR Premix Ex Taq溶液5 ?L,ddH2O 3 ?L。实时荧光定量PCR反应条件:95 ℃条件下变性30 s,40个扩增循环(95 ℃条件下反应5 s,62 ℃条件下反应30 s)。建立溶解曲线,95 ℃条件下反应15 s,62 ℃条件下反应1 min。每个样本3个复孔,重复3次实验,每次实验都设计1组空白对照。
1.3 统计学处理 采用SPSS 16.0(SPSS Inc.,USA)统计软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
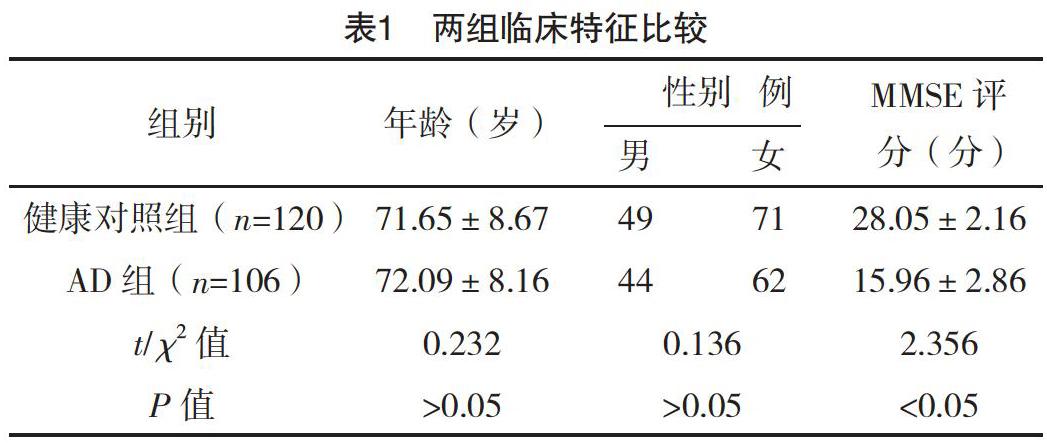
2.1 临床特征 两组年龄、性别比较,差异均无统计学意义(P>0.05);AD组MMSE评分明显低于健康对照组,差异有统计学意义(P<0.05)。见表1。
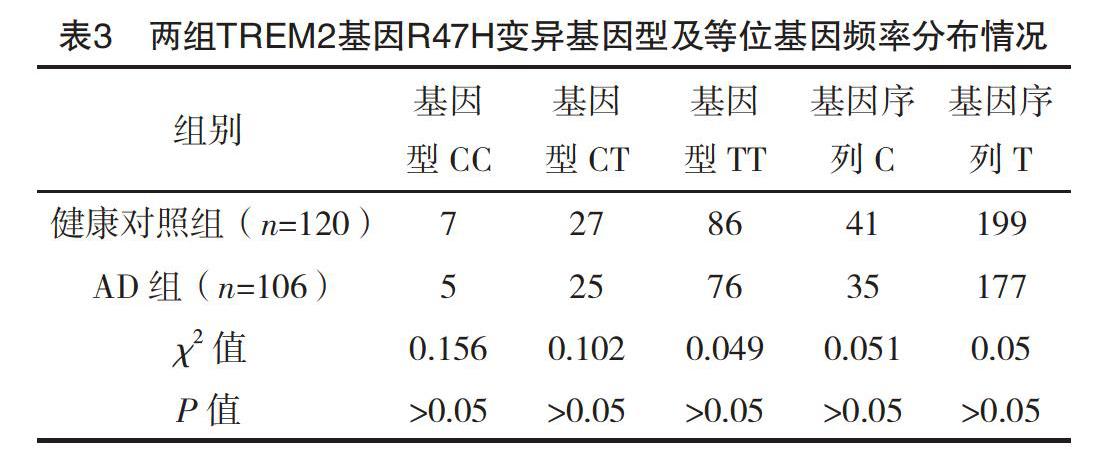
2.2 TREM2基因R47H变异与AD的相关性 TREM2基因R47H变异在正常对照组的基因频率分布符合Hardy-Weinberg平衡(字2=1.96,P>0.05),同时R47H变异在AD组的基因频率分布也符合Hardy-Weinberg平衡(字2=1.65,P>0.05),见表2;两组TREM2基因R47H变异的基因型及等位基因频率比较,差异均无统计学意义(P>0.05),见表3。
2.3 两组TREM2基因mRNA表达水平比较 通过实时荧光定量PCR结果显示:TREM2基因mRNA相对表达水平在AD组和健康对照组分别为(1.211±0.05)和(1.108±0.03),两组比较差异无统计学意义(t=1.609,P>0.05)。
3 讨论
自1907年报道了首例AD患者至今,有超过数以亿计的患者深受其害,其主要表现为认知功能损害,同时常伴有精神行为的异常,最终导致机体功能丧失。有研究显示,淀粉样前体蛋白基因、早老素1基因和早老素2基因是最主要的早发型FAD的致病基因[12]。而晚发型SAD致病机制仍不清楚,目前考虑年龄增加、家族易感性、糖尿病、高血压等因素均与其发病具有一定的相关性[13]。研究提示SAD发病可能与多个易感基因的共同作用有关,已知载脂蛋白E(apolipoprotein E,APOE)ε4等位基因与晚发型AD发病确切相关,它可以明显增加晚发型AD的发病风险[14]。而在2013年Jonsson等[7]学者通过基因组测定分析AD患者和健康人群的基因型差异,发现TREM2基因R47H变异明显提高AD的发病风险3.4倍。同年另外一个研究通过外显子测定发现TREM2基因R47H变异与AD也具有很强的关联性[15]。随后在德国、美国、挪威、荷兰和加拿大等多个大规模AD患者研究中也肯定了TREM2基因R47H变异的致病性,而在中国汉族AD人群中,研究也得到了同样的结果[16]。同时R47H变异也证实与其他神经变性疾病相关,文献[17-18]研究发现R47H变异与帕金森病发病相关。此外有研究发现R47H变异也是肌萎缩侧索硬化和额颞叶痴呆发病的危险因素[19]。TREM2基因上除了R47H变异外,D87N变异也证实与AD具有关联性。此外有报道提出Q33X、Y38C和T66M变异与额颞叶痴呆相关[20]。由此可見TREM2蛋白的功能异常是神经退行性疾病的重要危险因素。
TREM2基因位于染色体6q21上,包含5个外显子。它是由230个氨基酸组成的是一种跨膜糖蛋白,包括1个信号肽、1个IgG结构域、1个跨膜结构域和1个胞内结构域。TREM2蛋白与配体结合后向胞内传递信号,目前认为TREM2蛋白主要由小胶质细胞表达,其在AD发病机制中的作用尚不明确。TREM2具有免疫调节和吞噬作用,有研究提出减弱TREM2的活性可能通过增多炎症反应从而引起大脑的损伤,它主要通过降低TNF-α和IL-6水平调节免疫[21-23]。同时有研究提出TREM2敲低后,小胶质细胞吞噬凋亡神经元的能力明显下降[24]。
此外TREM2可能也通过参与Aβ的清除从而导致AD。由APP蛋白通过β分泌酶和γ分泌酶剪切降解生成的Aβ是AD的发病的重要危险因素,特别是Aβ42能通过聚集形成寡聚体和纤维模式,最终形成淀粉炎性斑块。有研究提出过量表达TREM2的细胞中Aβ的清除与TREM2蛋白的表达水平具有正相关性。同时有研究提出TREM2基因变异可以抑制TREM2蛋白从内质网运输至高尔基体,使其滞留在内质网上,导致内质网压力升高,同时使其在细胞膜表达减少,影响其功能发挥,这被认为是TREM2变异主要的致病因素[25]。此外一系列临床研究证明可溶性的TREM2(soluble TREM2,sTREM2)与AD的进程密切相关,可能参与调控AD的发生和进展。既往研究发现在人体脑脊液中sTREM2水平高于正常人群,考虑sTREM2与AD具有相关性[26]。但是有研究也发现sTREM2能够有效诱导小胶质细胞的增殖,增强其对淀粉样斑块的吞噬和降解功能,从而改善神经突触的可塑性,说明sTREM2在AD中可能具有重要的保护功能[27]。
本研究采用传统的Sanger测序进行基因多态性分析,结果可靠准确,同时检测AD患者中TREM2基因mRNA表达水平,研究结果提示在中国福建地区AD患者发病与TREM2基因R47H变异无相关性,同时AD患者外周血mRNA水平与正常健康人群相比无明显差异(P>0.05)。笔者考虑这可能与本研究样本量相对较小有关,同时仅检测外周血未进行脑脊液检测可能也会导致以上结果,有条件者应进一步扩大样本量同时收集脑脊液再次进行检测。本研究仅对R47H变异进行研究,考虑可以制作基因芯片同时对Q33X、Y38C、T66M等多个位于TREM2基因上的变异进行检测,进一步探讨TREM2基因与中国福建AD患者的关联性。
参考文献
[1] Jia J,Wei C,Chen S,et al.The cost of Alzheimers disease in China and re-estimation of costs worldwide[J].Alzheimers Dement,2018,14(4):483-491.
[2] Jiao B,Tang B,Liu X,et al.Mutational analysis in early-onset familial Alzheimers disease in Mainland China[J].Neurobiol Aging,2014,35(8):1951-1956.
[3] Tan M S,Yu J T,Jiang T,et al.Genetic variation in BIN1 gene and Alzheimers disease risk in Han Chinese individuals[J].Neurobiol Aging,2014,35(7):1781-1788.
[4] Li H L,Yang P,Liu Z J,et al.Common variants at Bin1 are associated with sporadic Alzheimers disease in the Han Chinese population[J].Psychiatr Genet,2015,25(1):21-25.
[5] Tao Q Q,Liu Z J,Sun Y M,et al.Decreased gene expression of CD2AP in Chinese patients with sporadic Alzheimers disease[J].Neurobiol Aging,2017,56(7):212.e5-212.e10
[6] Jiang B,Zhang X P,Chen M F,et al.A cross-sectional study of inpatients with late stage of dementia in Southeast China and the associations between biochemical parameters and apolipoprotein E genotypes[J].Clin Interv Aging,2018,13(5):159-163.
[7] Jonsson T,Stefansson H,Steinberg S,et al.Variant of TREM2 associated with the risk of Alzheimers disease[J].N Engl J Med,2013,368(2):107-116.
[8] Bonham L W,Sirkis D W,Fan J,et al.Identification of a rare coding variant in TREM2 in a Chinese individual with Alzheimers disease[J].Neurocase,2017,23(1):65-69.
[9] Jiang T,Tan L,Chen Q,et al.A rare coding variant in TREM2 increases risk for Alzheimers disease in Han Chinese[J].Neurobiol Aging,2016,42(3):211-213.
[10] Ma J,Zhou Y,Xu J,et al.Association study of TREM2 polymorphism rs75932628 with late-onset Alzheimers disease in Chinese Han population[J].Neurol Res,2014,36(10):894-896.
[11] Li L X,Zhao S Y,Liu Z J,et al.Improving molecular diagnosis of Chinese patients with Charcot-Marie-Tooth by targeted next-generation sequencing and functional analysis[J].Oncotarget,2016,7(19):27655-27664.
[12] Lanoiselee H M,Nicolas G,Wallon D,et al.APP,PSEN1,and PSEN2 mutations in early-onset Alzheimer disease:A genetic screening study of familial and sporadic cases[J].PLoS Med,2017,14(3):270.
[13] Crous-Bou M,Minguillon C,Gramunt N,et al.Alzheimers disease prevention:from risk factors to early intervention[J].Alzheimers Res Ther,2017,9(1):71.
[14] Giau V V,Bagyinszky E,An S S,et al.Role of apolipoprotein E in neurodegenerative diseases[J].Neuropsychiatr Dis Treat,2015,11(3):1723-1737.
[15] Guerreiro R,Wojtas A,Bras J,et al.TREM2 variants in Alzheimers disease[J].N Engl J Med,2013,368(2):117-127.
[16] Desikan R S,Fan C C,Wang Y,et al.Genetic assessment of age-associated Alzheimer disease risk:Development and validation of a polygenic hazard score[J].PLoS Med,2017,14(3):258.
[17] Tan T,Song Z,Yuan L,et al.Genetic analysis of TREM2 variants in Chinese Han patients with sporadic Parkinsons disease[J].Neurosci Lett,2016,612(3):189-192.
[18] Li Z,Zhong L,Gu L,et al.Association study of TREM2 polymorphism rs75932628 with leucoaraiosis or Parkinsons disease in the Han Chinese population[J].BMJ Open,2016,6(1):499.
[19] Chen X,Chen Y,Wei Q,et al.Assessment of TREM2 rs75932628 association with amyotrophic lateral sclerosis in a Chinese population[J].J Neurol Sci,2015,355(1):193-195.
[20] Le Ber I,De Septenville A,Guerreiro R,et al.Homozygous TREM2 mutation in a family with atypical frontotemporal dementia[J].Neurobiol Aging,2014,35(10):2419-2423.
[21] Yeh F L,Hansen D V,Sheng M.TREM2,Microglia,and Neurodegenerative Diseases[J].Trends Mol Med,2017,23(6):512-533.
[22] Gorenjak V,Aldasoro Arguinano A A,Dade S,et al.The polymorphism rs6918289 located in the downstream region of the TREM2 gene is associated with TNF-αlevels and IMT-F[J].Sci Rep,2018,8(1):7160.
[23] Wang M,Gao X,Zhao K,et al.Effect of TREM2 on Release of Inflammatory Factor from LPS-stimulated Microglia and Its Possible Mechanism[J].Ann Clin Lab Sci,2019,49(2):249-256.
[24] Mazaheri F,Snaidero N,Kleinberger G,et al.TREM2 deficiency impairs chemotaxis and microglial responses to neuronal injury[J].EMBO Rep,2017,18(7):1186-1198.
[25] Kleinberger G,Yamanishi Y,Suarez-Calvet M,et al.TREM2 mutations implicated in neurodegeneration impair cell surface transport and phagocytosis[J].Sci Transl Med,2014,6(243):243-286.
[26] Schindler S E,Holtzman D M.CSF sTREM2:marking the tipping point between preclinical AD and dementia?[J].EMBO Mol Med,2016,8(5):437-438.
[27] Zhong L,Xu Y,Zhuo R,et al.Soluble TREM2 ameliorates pathological phenotypes by modulating microglial functions in an Alzheimers disease model[J].Nat Commun,2019,10(1):1365.
(收稿日期:2019-05-20) (本文編辑:程旭然)
