动脉瘤性蛛网膜下腔出血患者脑血管痉挛的危险因素分析
2019-09-24范建江曹心慧
范建江 曹心慧
郑州市第一人民医院,河南 郑州 450004
蛛网膜下腔出血发病率高、病死率高,主要原因是颅内动脉瘤破裂,约占80%[1-4]。脑血管痉挛是蛛网膜下腔出血后的最常见的神经系统并发症,与患者神经功能缺损及较差预后有关[5-7],增加了蛛网膜下腔出血的病死率。如果能有效控制继发脑血管痉挛,势必改善蛛网膜下腔出血的预后。但动脉瘤性蛛网膜下腔出血后脑血管痉挛的预测因素在文献中报道并不一致[8-13],不利于采取有效措施;分析原因主要由于脑血管痉挛在不同研究中的定义或诊断标准不一致。目前,用来定义脑血管痉挛术语包括血管造影血管痉挛(AV)、有症状的血管痉挛(SV)、计算机断层扫描脑梗死(CT)、迟发性脑缺血(DCI),以及经颅多普勒(TCD)显示血管痉挛[14-20]。不同种族患者动脉瘤蛛网膜下腔出血后脑血管痉挛发病率和危险因素也有区别[21-24]。关于中国动脉瘤性蛛网膜下腔出血后脑血管痉挛患者危险因素的报道很少。本研究探讨中国人动脉瘤性蛛网膜下腔出血后脑血管痉挛患者AV、SV或脑梗死的危险因素。
1 资料与方法
1.1一般资料选择郑州市第一人民医院2012-01—2018-03住院治疗的301例动脉瘤性蛛网膜下腔出血患者为研究对象,未发生脑血管痉挛患者作对照。蛛网膜下腔出血后脑血管痉挛的诊断由临床症状和神经影像学表现[数字减影血管造影(DSA)、头颅CT或CT血管造影(CTA)、头颅平扫MRI]联合确诊。动脉瘤性蛛网膜下腔出血诊断标准:(1)有突然发生的头痛等症状;(2)脑膜刺激征阳性;(3)CT平扫证实蛛网膜下腔出血,CT阴性者经腰椎穿刺[7]证实;(4)经MRA、CTA、DSA中至少一种血管评估,证实责任动脉瘤;(5)排除继发性蛛网膜下腔出血,如创伤、脑实质出血破入或脑室出血、脑血管畸形。纳入标准:(1)符合前述诊断标准;(2)发生至入院时间≤2 d;(3)患者和家属均知晓研究内容并签署书面知情同意书。排除标准:(1)年龄<18岁;(2)交流障碍者;(3)合并恶性肿瘤、精神疾病、颅内感染者。
1.2治疗方法入院后,所有患者接受DSA或CTA检查,接受静脉输液以维持血容量。口服尼莫地平,共治疗14 d。根据患者病情选择手术夹闭或血管内栓塞治疗动脉瘤性蛛网膜下腔出血。
1.3评价标准
1.3.1 Hunt-Hess分级:根据患者临床症状和入院时神经影像学检查结果,对患者进行Hunt-Hess分级(共6个级别,0~Ⅴ级,分级越高患者病情越严重)。良好定义为Hunt-Hess分级0~3级。恶劣定义为Hunt-Hess分级4~5级。
1.3.2 Fisher等级:据FRONTERA等[7]修改后Fisher等级/改良Fisher等级对aSAH的严重程度进行了放射学分类,共0~4级,分级越高表示发生血管痉挛的危险性越高。良好定义为改良Fisher等级0~2级。恶劣定义为改良Fisher等级3~4级。
1.3.3 SV:定义为aSAH发作后21 d内发生新的局灶性神经系统体征,以及头痛加重、颈项僵硬、意识模糊、意识水平下降,临床、检验或影像学检查未发现继发脑积水、癫痫发作、代谢紊乱、感染等)。
1.3.4 AV:定义为DSA中度至严重动脉狭窄,且并非动脉粥样硬化、导管引起的痉挛或血管发育不全。比较动脉直径与其预先变窄的节段或亲本血管的最远端确定狭窄程度:当缩小率25%~50%为中等,当缩小>50%时为狭窄严重[8]。
1.3.5 脑梗死:放射学上将脑梗死定义为位于蛛网膜下腔出血后6周内或出院前CT扫描显示增加的符合血管分布的脑内低密度影,并且不归因于其他原因。本研究中,实质内血肿引起的CT扫描的低密度不被视为来自DCI的脑梗死。
1.4观察指标分析患者入院时的基本资料(年龄、性别、吸烟史、高血压史)、动脉瘤大小和数量、Hunt-Hess分级、改良Fisher分级、动脉瘤治疗方法(手术夹闭和血管内栓塞)、实验室检查结果(白细胞计数、血清葡萄糖和甘油三酯)与SV、AV、脑梗死的相关性。
1.5统计学处理本研究中所有数据均使用SPSS 13.0处理,临床资料与SV、AV、脑梗死的关系使用相关性分析,计量资料使用t检验、计数资料使用卡方检验进行单因素分析,使用Logistic回归分析进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1单因素分析纳入301例动脉瘤性蛛网膜下腔出血,无明显血管痉挛37例,AV 121例,SV 81例,脑梗死62例。入院时年龄≥53岁、改良Fisher分级3~4级、Hunt-Hess分级4~5级、白细胞计数水平≥11×109个/ L、血糖水平≥7.0 mmol/L是AV、SV、脑梗死的危险因素(P<0.05)。此外,高血压史和吸烟史是SV或脑梗死的危险因素;动脉瘤直径≥1 cm是AV或SV的危险因素(P<0.05)。见表1。
2.2多因素分析入院时改良Fisher分级3~4级、Hunt-Hess分级4~5级、白细胞计数水平≥11×109个/L、血糖水平≥7.0 mmol/L、高血压史是AV的独立危险因素(P<0.05)。高血压史、动脉瘤直径≥1 cm、改良Fisher分级3~4级、Hunt-Hess分级4~5级、白细胞计数水平≥11×109个/L是SV的独立危险因素(P<0.05)。年龄≥53岁、吸烟史、高血压史、改良Fisher分级3~4级、Hunt-Hess分级4~5级、白细胞计数水平≥11×109个/L是脑梗死的独立危险因素(P<0.05)。见表2。
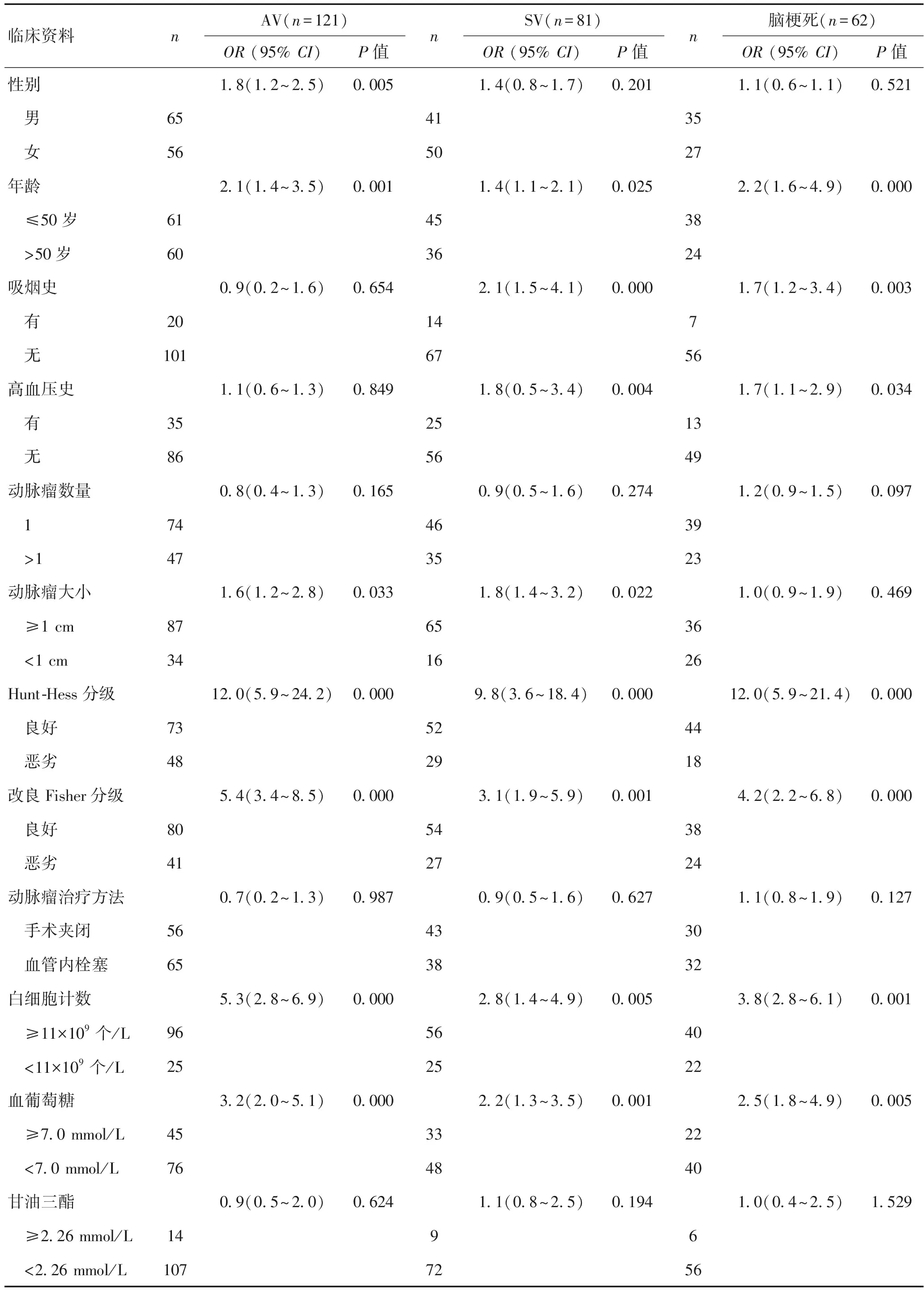
表1 本组患者临床资料与SV、AV、脑梗死相关性的单因素分析
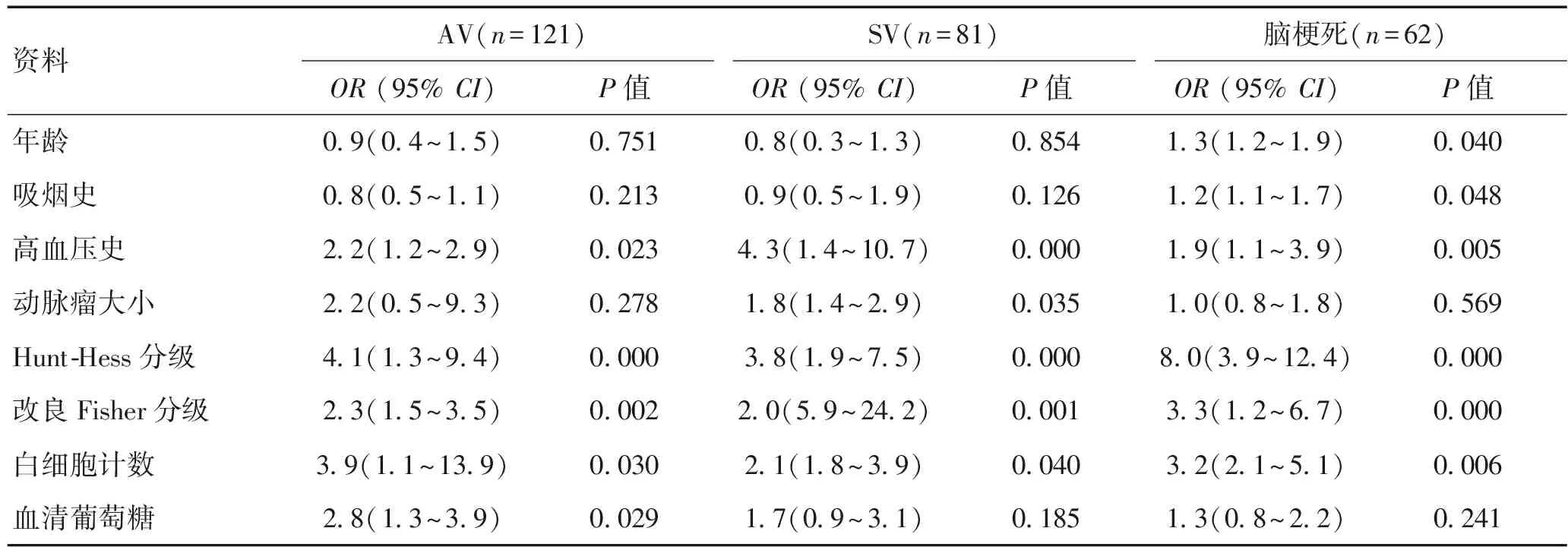
表2 SV、AV、脑梗死的独立危险因素分析
3 讨论
动脉瘤性蛛网膜下腔出血是一种神经科急症,其特征是脑动脉瘤破裂血液进入蛛网膜下腔并随脑脊液循环充满脑脊液[25-31]。脑血管痉挛是造成动脉瘤性蛛网膜下腔出血患者死亡的严重并发症之一[32-36]。该病发病机制复杂,目前尚未完全明确[37-41]。识别脑血管痉挛的危险因素,并有效预测脑血管痉挛的发生具有重要意义。了解脑血管痉挛发展的相关因素可有助于临床医生筛选高危人群,并早期预防[42-46]。有研究指出,脑血管痉挛的发生与其他多种因素相关,如年龄、性别、Hunt-Hess分级、吸烟、高血压、酒精摄入量、心脏病、糖尿病和体重指数,但研究结果并不统一[9-10,47-50]。
本研究显示,性别、年龄、动脉瘤大小、Hunt-Hess分级、改良Fisher分级、血清葡萄糖水平、动脉瘤大小、白细胞计数与AV具有相关性。年龄、吸烟史、高血压史、动脉瘤大小、Hunt-Hess分级、改良Fisher分级、血清葡萄糖水平、白细胞计数与SV、脑梗死具有相关性(P<0.05)。此外,动脉瘤大小与SV具有相关性。值得注意的是,高血压史与AV、SV和脑梗死相关,与TETSUJI等[9]研究结果相似,但与西方国家研究中脑血管痉挛对高血压的作用结果不一致[11,51-53],可能与研究对象种族差异有关。我国高血压患者通常控制差,波动范围大,应进一步扩大样本量,评估控制性高血压对中国动脉瘤性蛛网膜下腔出血后脑血管痉挛发展的影响。改良Fisher分级、Hunt-Hess分级在多项研究中证实与脑血管痉挛有关[12],本研究再次证实改良Fisher分级3~4级、Hunt-Hess分级4~5级是AV、SV、脑梗死的独立危险因素。
本研究中,入院时改良Fisher分级3~4级、Hunt-Hess分级4~5级、白细胞计数水平≥11×109个/L、高血压史是所有类型脑血管痉挛的独立危险因素。临床工作中应对此类非创伤性蛛网膜下腔出血患者加强护理和检测,早期预防或发现脑血管痉挛,及时治疗,以降低脑血管痉挛的病死率。此外,其也是SV的独立危险因素,年龄≥53岁、吸烟史也是脑梗死的独立危险因素,与MAIMAITILI等[13]研究结果一致。
入院时改良Fisher分级3~4级、Hunt-Hess分级4~5级、白细胞计数水平≥11×109个/ L、高血压史是所有脑血管痉挛的独立危险因素。此外,动脉瘤直径≥1 cm、年龄≥53岁、吸烟史也是脑血管痉挛的独立危险因素。各类型脑血管痉挛患者危险因素存在差异,应引起临床重视。
