水貂出血性肺炎二联四价灭活疫苗的研制
2019-09-21张海威程悦宁王晓旭周玉成乔连江周曼莉赵蒙程世鹏杨艳玲
张海威,程悦宁,王晓旭,周玉成,乔连江,周曼莉,赵蒙,2,程世鹏,杨艳玲※
(1.中国农业科学院特产研究所经济动物分子生物学重点实验室,长春 130112;2.山东省乐陵市人民政府,山东 乐陵 253600)
水貂出血性肺炎的病原体由传统的单一病原体(铜绿假单胞菌)感染逐渐转变为多种病原体混合感染,其中,包括肺炎克雷伯、大肠杆菌和金黄色葡萄球菌等,引起水貂的高致病性死亡[1-4]。铜绿假单胞菌和大肠杆菌普遍存在于自然环境中,是畜禽、野生动物、受伤病人的重要病原菌,可导致胃肠炎、出血性结肠炎[5-8]。随着我国水貂养殖业的飞速发展,巨大经济利益诱发水貂养殖户盲目地扩大饲养规模,部分养殖场是小规模养殖户[9],铜绿假单胞菌和大肠杆菌广泛存在于土壤、饲料、产箱等水貂饲养的环境中[10]。出血性肺炎在夏秋时节多发,对10月龄水貂可造成大范围急性死亡,发病率高达54%[11]。铜绿假单胞菌和大肠杆菌均为条件性治病菌,菌体本身带来的耐药性、自身的耐药机制、长时间抗生素的大量使用导致细菌的耐药性逐年增强,导致水貂出血性肺炎的防治难度加大[12-15]。所以,研制一种针对水貂出血性肺炎的多价灭活疫苗,势在必行。
1 材料与方法
1.1 材料
1.1.1 菌株 E、G、D 型3 种高致病性铜绿假单胞菌菌株和H11 基因型高致病性大肠杆菌菌株均由中国农业科学院特产研究所经济动物疫病重点实验室保存。
1.1.2 试剂 胰蛋白胨大豆肉汤(Tryptic Soy Broth,TSB)(美国 BD 公司);琼脂粉(Agar)(西格玛奥德里奇公司);磷酸盐缓冲液(PBS)(北京索莱宝科技有限公司);甲醛(丹东市龙海试剂厂);AL(OH)3(上海创宏生物科技有限公司)。
1.1.3 仪器 一次性注射器(长春金康源医用器具有限公司);分装器(保定创锐泵业有限公司);磁力搅拌器(江苏省金坛市荣华仪器制造有限公司);摇床(QYC 211)(上海福玛实验设备有限公司)。
1.1.4 实验动物 200 只8月龄健康雄性水貂,体重1.6~2.0 kg,购自吉林中特农业科技有限公司异兽路分公司。
1.2 方法
1.2.1 半数致死量的确定 将E、G、D 不同血清型铜绿假单胞菌和H11 基因型大肠杆菌菌种分别命名为1号、2 号、3 号、4 号菌株并将菌株分别划线于TSA 培养基上,挑取单菌落接种于5 mL TSB 肉汤中,37 ℃220 r/min 过夜培养,1 号、2 号、3 号、4 号采用菌落计数法调整菌液浓度,其浓度分别为2.2×108、1.2×108、1.0×108、2.0×108CFU/mL,用 PBS 10 倍梯度稀释,稀释后浓度分别为 2.2×106~2.2×108、1.2×106~1.2×108、1.0×106~1.0×108、2.0×106~2.0×108CFU/mL。将 80 只水貂随机分成16 组,每组5 只。分别取不同稀释度菌液皮下注射水貂,剂量为 1 mL/只,其中第 4、8、12、16组为空白对照组,其皮下注射同量的PBS。连续观察5~7 d 记录水貂死亡情况。
1.2.2 菌株的灭活 将 1 号、2 号、3 号、4 号菌株分别划线于TSA 平板,37 ℃过夜培养,挑取单一菌落接种于 5 mL TSB 培养基中,37 ℃ 220 r/min 过夜培养,采用活菌计数法计算菌体数量。
将上述菌液按照1∶50 比例分别导入2 500 mL TSB中培养24 h,加入最终浓度为0.35%的甲醛溶液,边加边搅拌。37 ℃灭活48 h,每隔3 h 震动摇晃1 次。取1 mL 灭活后接种于TSA 平板上,37 ℃培养48 h,观察TSA平板上是否有细菌生长,若无细菌生长则证明无菌灭活完全。
1.2.3 二联四价灭活疫苗的制备 将灭活的4 株菌液浓度调整为 1.0×109CFU/mL,与 40%的 AL(OH)3溶液按照1∶1∶1∶1∶1 混合充分乳化并加入终浓度为0.01%硫柳汞,即为水貂出血肺炎二联四价灭活疫苗。
1.2.4 超剂量接种安全检验 将制备的二联四价灭活疫苗接种于5 mL 的TSB 培养基中37 ℃静置过夜培养,并设立TSB空白对照组,观察培养液是否浑浊。取3 mL 二联四价灭活疫苗,后腿皮下注射免疫5 只水貂,设置空白对照组,21 d内观察水貂免疫后的精神状态。
1.2.5 最小免疫剂量 将80 只水貂随机分成16 组,5 只/组。第 1 天首免,第 7 天和第 14 天 2 免和 3 免。免疫21 d后,用10 LD50(1.0×108CFU)疫苗菌株(1 号、2 号、3 号、4 号菌株)感染水貂,5~7 d内观察记录水貂死亡率和发病率,其中第4、8、12、16 组均为空白对照组,其余为实验组。见表1。
1.2.6 攻毒保护实验 对40 只水貂随机分成8 组,5只/组,第 1、3、5、7 组为实验组,第 2、4、6、8 组为空白对照组。实验组皮下注射该疫苗0.5 mL,首免疫后第7 d 和14 d 对水貂再次进行2 免和3 免;空白对照组注射同等剂量的PBS 缓冲液。免疫21 d 后用10 LD50 疫苗菌株(1 号、2 号、3 号、4 号菌株)感染水貂。攻毒后5~7 d 内观察并记录水貂死亡率和发病率。见表2。
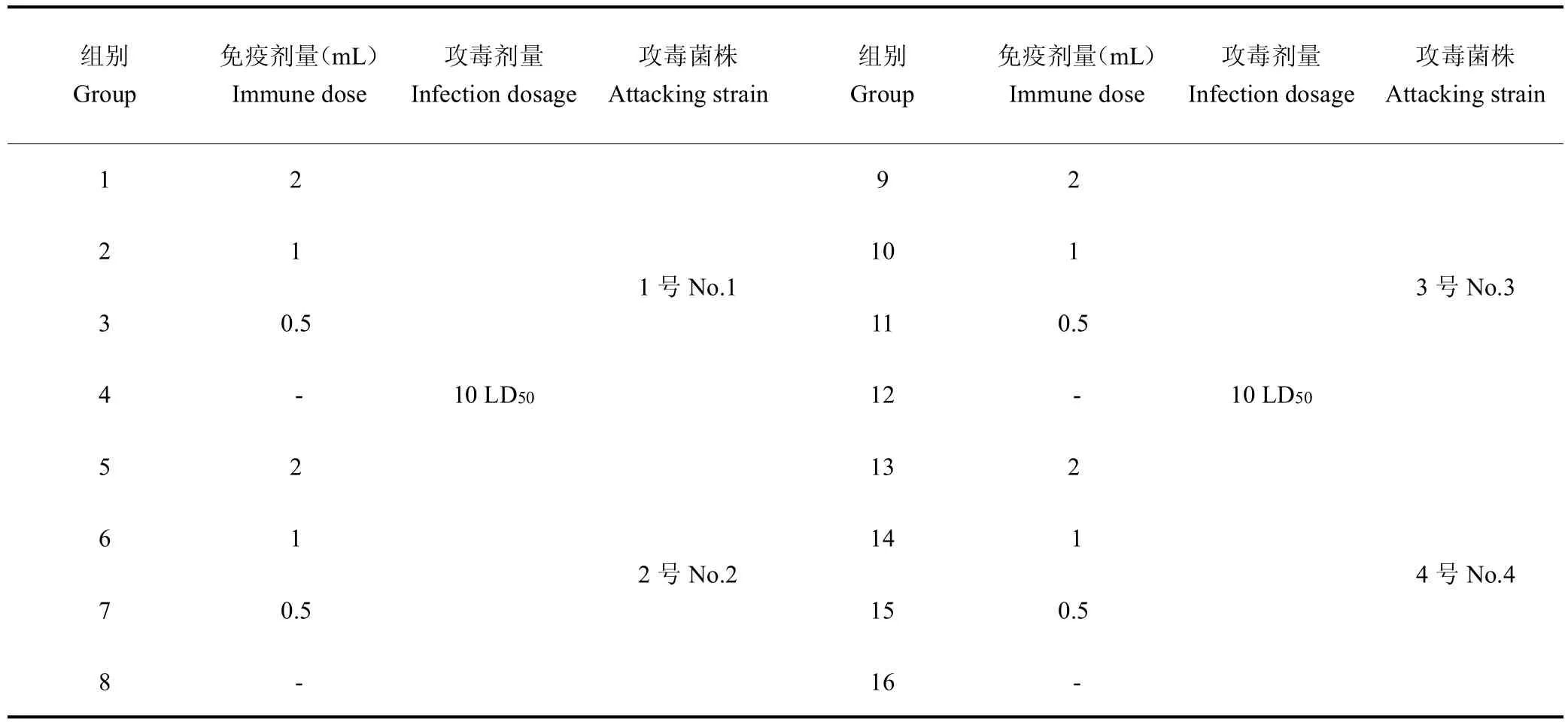
表1 水貂最小免疫剂量分组及测定Tab.1 Minimum immune grouping and determination of mink

表2 水貂攻毒保护试验Tab.2 Immune attack protection of mink
1.2.7 水貂出血性肺炎二联四价灭活疫苗临床应用对山东省、河北省的8 个水貂养殖场共7 000 只水貂进行出血性肺炎二联四价灭活疫苗的接种,观察免疫后水貂情况。
2 结果
2.1 半数致死量的确定
水貂感染分离株后48~72h水貂出现呼吸急促、抖动、快速死亡、食欲下降、被毛凌乱、饮水减少等情况,从死亡水貂肿胀的脾脏中均可分离出大量的1 号、2号、3 号、4 号菌株。1 号、2 号、3 号、4 号菌株的半数致死量分别为 2.2×107、1.2×107、1.0×107、2.0×107CFU,见表3。
2.2 菌株灭活
菌板未见细菌单菌落,1 号、2 号、3 号、4 号菌株灭活完全,可进行下一步实验研究。
2.3 二联四价灭活疫苗的制备及超剂量接种安全检验
TSB 培养基中未出现浑浊,即二联四价灭活疫苗制作成功,同时安全性检验结果显示阴性。超剂量灭活疫苗免疫后21 d内水貂采食、精神状态均未出现明显异常变化,再次证明疫苗制作比较成功。
2.4 水貂最小免疫剂量的确定
0.5 mL 二联四价灭活疫苗对4 种菌株感染的水貂均能达到100%的免疫保护,对照组全部死亡,该疫苗对水貂的最小免疫剂量为0.5 mL,见表4。
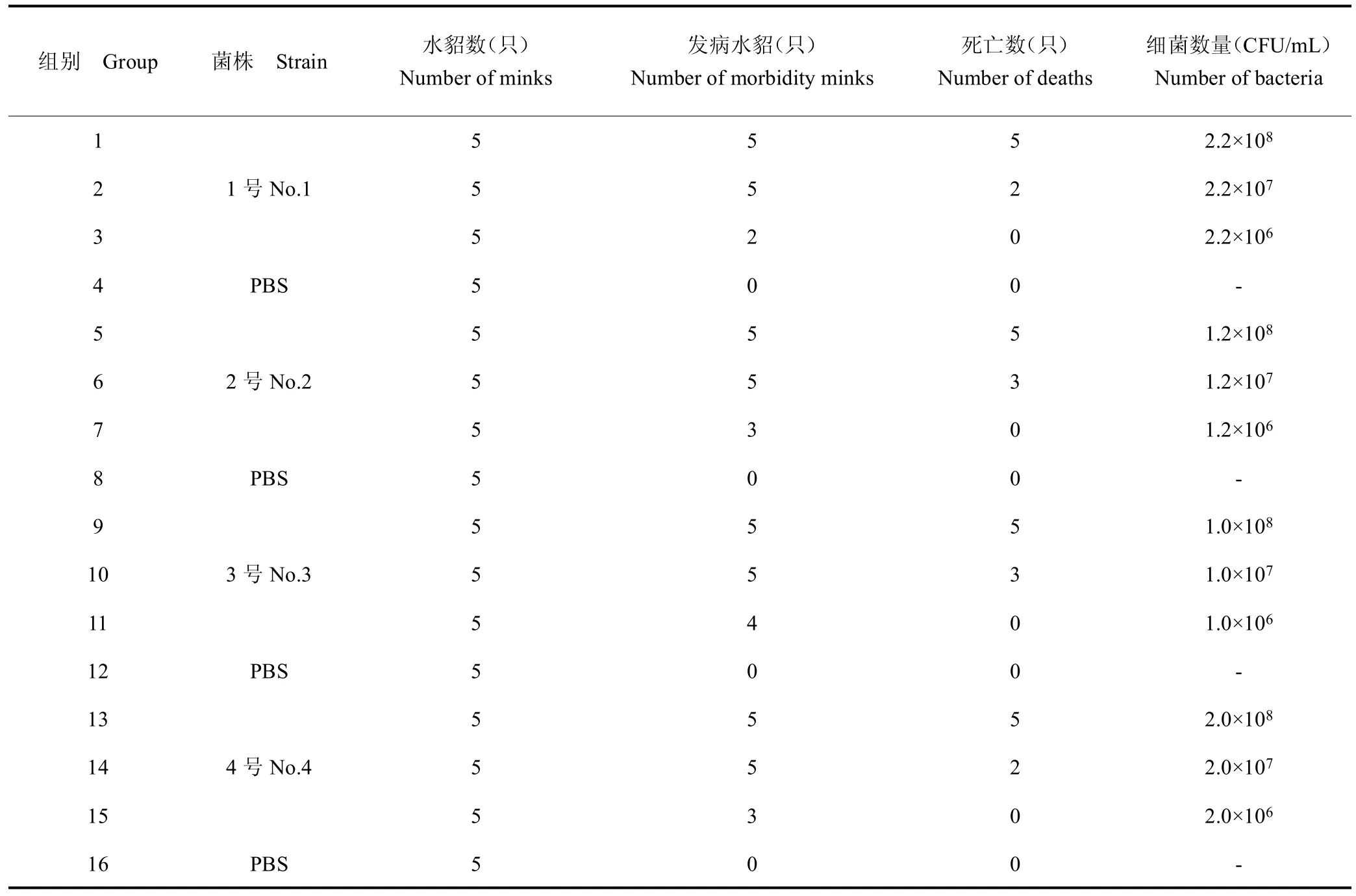
表3 水貂半数致死量试验Table 3 Half lethal dose test of mink
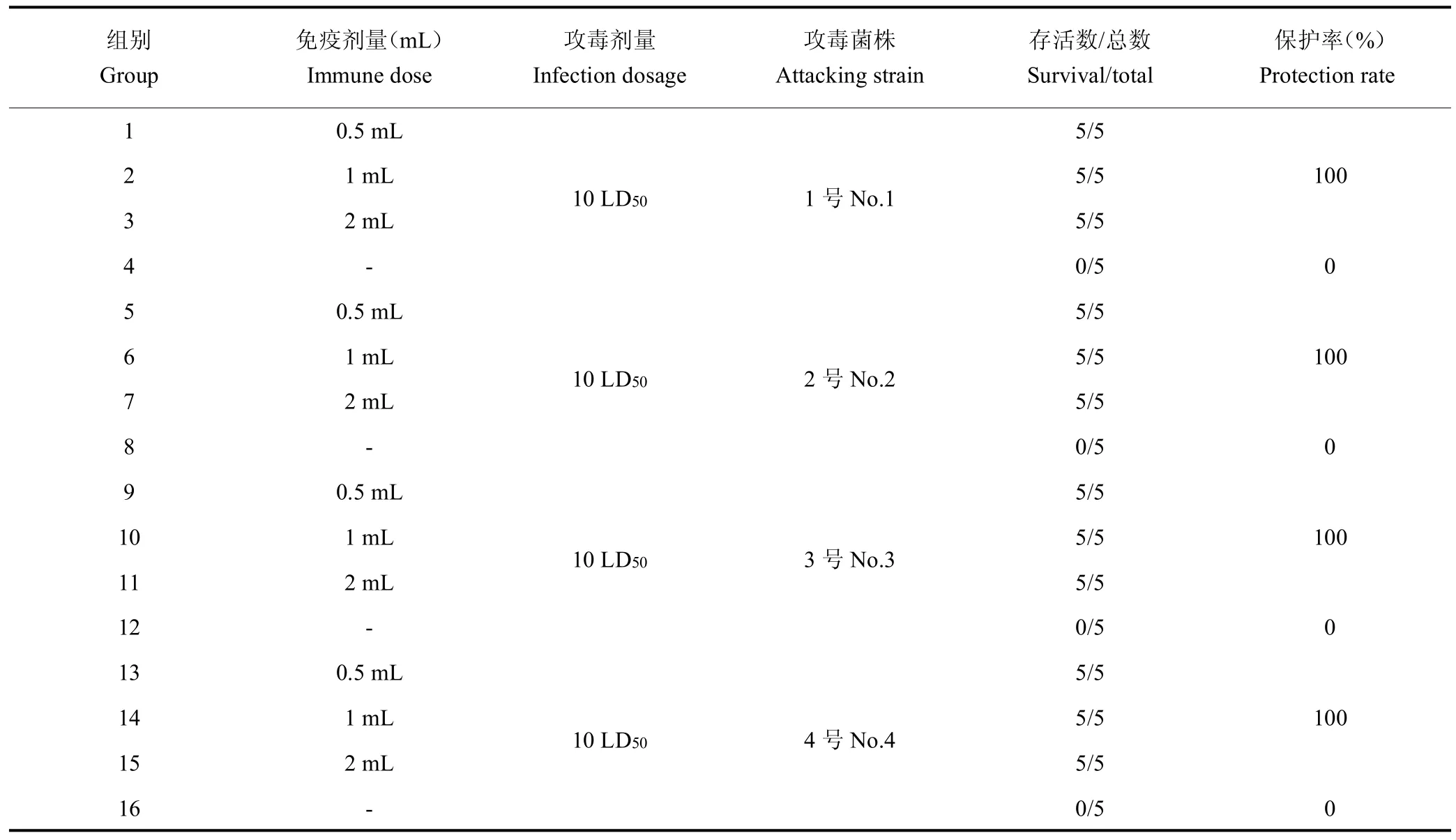
表4 水貂最小免疫剂量确定Tab.4 Minimum immunization dose of mink
2.5 水貂攻毒保护实验
水貂保护率均为100%,即二联四价灭活疫苗对1号、2 号、3 号、4 号备选疫苗株免疫效果较好,见表5。
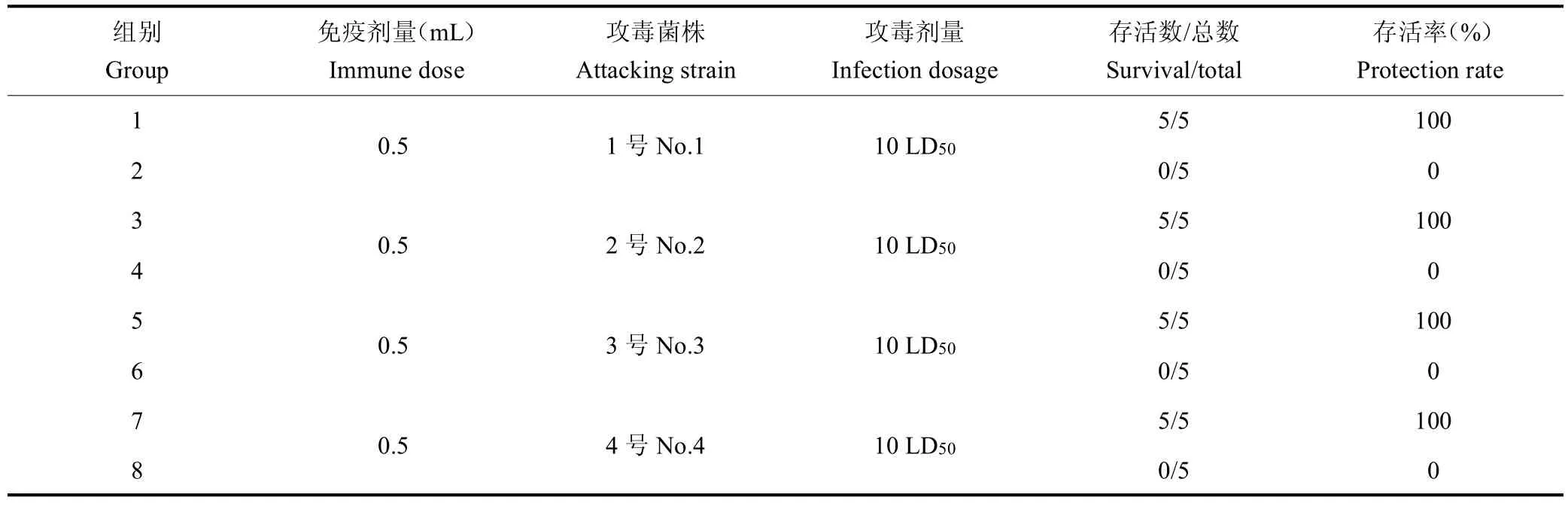
表5 水貂攻毒保护实验Table 5 Immune attack protection of mink
2.6 水貂出血性肺炎二联四价灭活疫苗临床应用
7 000 只水貂均未出现不良反应,说明该疫苗研制成功且对水貂出血性肺炎具有较好的防控效果。
3 讨论
目前,水貂出血性肺炎疫苗的备选菌株均由不同血清型的铜绿假单胞菌灭活后研制而成,其中,铜绿假单胞菌的血清型以G 型为主,B 型为辅[16]。该疫苗对出血性肺炎起到了一定的保护作用,但近年来,免疫该疫苗的水貂仍发生以出血性肺炎为典型症状的死亡病例。通过研究发现,水貂出血性肺炎不再是单一铜绿假单胞菌感染引起发病,而且铜绿假单胞菌的血清型也不再是以G 型为主,B 型为辅。目前,水貂出血性肺炎是一种多病原体混合感染引起的呼吸道细菌性疾病,以铜绿假单胞菌和大肠杆菌为主,存在铜绿假单胞菌或大肠杆菌单独感染和混合感染情况。为此,本研究采集全国四个省份28 份具有典型水貂出血性肺炎症状的病料,分离得到主要致病菌,并制备了水貂出血性肺炎二联四价灭活疫苗,该疫苗填补了我国出血性肺炎疫苗防治的空白,该疫苗研制成功也是首次被公开报道。
细菌灭活疫苗是临床上常用的疾病防控手段之一,在临床上发挥着无法估量的作用[17]。菌株的灭活是衡量疫苗安全性的重要标准,因此对灭活疫苗进行无菌检查是非常重要的环节[18]。若灭活菌株被其它细菌或霉菌污染,会间接造成其它细菌或霉菌对动物体造成感染,进一步对动物体造成二次伤害,很可能会导致免疫动物的大面积死亡,给养殖户带来巨大的经济损失。安全性实验是为确保动物试验中免疫的水貂不会因为疫苗本身对其造成影响,如免疫后水貂的发热、死亡、采食量减少、接种部位的破溃等现象的发生[19]。
免疫灭活疫苗是防治水貂细菌性疾病的主要手段,评价疫苗的好坏主要取决于疫苗的免疫效价、最小免疫剂量和疫苗的安全性等因素影响。本研究通过对自制二联四价水貂出血性肺炎灭活疫苗进行临床动物试验,可知该疫苗对水貂的最小免疫剂量为0.5 mL(含菌量 5.0×108CFU)。
二联四价灭活疫苗免疫水貂后,疫苗的副作用很难评价,虽然我国在这方面没有严格的规定或副反应详情,但动物的安全性方面是必须考虑的。应观察疫苗接种部位的变化,疫苗接种与副反应之间存在明显的时间关系性。免疫水貂在几秒钟或几分钟内出现明显的过敏反应有可能与疫苗的接种有直接关系,但疫苗接种几周后出现的不良反应不一定有因果关系,也可能是其它原因如水貂自身原因、注射操作不当、动物营养不良等[20-22]。相关研究报道表明,疫苗中的致敏原刺激机体产生IgE 抗体,IgE 抗体又是过敏反应的主要抗体,间接引发动物体全身低压肺高压,引起水貂出现呼吸困难、肺水肿、出血、淤血等病理变化[23]。个体原因指个体的差异性造成的,如过敏体质。注射操作不当指捕捉水貂时机体由于高度紧张造成的恐慌情况,突发性的出现免疫副作用反应。注射器械的未完全消毒和交叉使用也可能将病原体间接注射到水貂体内[24]。疫苗副反应严重时可造成水貂当场死亡,给养殖户造成心理上的恐慌同时出现拒绝接种疫苗现象[25]。这种现象的出现间接造成水貂发病后不治而亡,进一步阻碍了水貂养殖业的发展。
小鼠动物免疫效果无法取代本源动物免疫效果,因此,本研究选取水貂为实验动物,并进行下一步实验研究。韩明明[26]等报道,水貂出血性肺炎绿脓杆菌三价灭活疫苗中铜绿假单胞菌血清型分别为G、I型和C型。白雪等[11]等报道,铜绿假单胞菌疫苗研究进展中绿脓杆菌的血清型为G、B 型和C 型。表明水貂出血性肺炎疫苗中铜绿假单胞菌的血清型不同,主要为G型。在感染动物实验中发现,铜绿假单胞菌E 型、D 型与G型毒力相当,E型、D型分离株感染水貂也可造成与G型同等程度的经济损失,且首次发现与G型致病力相当的 D 型菌株。由于铜绿假单胞菌各血清型之间不存在交叉保护,故常规出血性肺炎疫苗只针对特定血清型的铜绿假单胞菌产生较好的保护力。新血清型铜绿假单胞菌感染水貂时,常规出血性肺炎疫苗未必能对水貂产生保护力,可能导致水貂出血性肺炎的全面爆发给养殖户带来巨大的经济损失。
4 结论
成功制备了检验合格的新型水貂出血性肺炎二联四价灭活疫苗。该疫苗对水貂具有较好的免疫保护力且安全性好。水貂的最小免疫剂量为0.5 mL/只,标准免疫剂量为1 mL。临床初步应用结果显示,能够保护水貂出血性肺炎的发生。
