自然铜、鹿衔草对肺癌骨转移模型裸鼠肿瘤组织ICAM-1、MMP-9 及PTHrP 表达的影响
2019-09-21林思思袁拯忠
林思思 袁拯忠
肺癌是常见癌症,也是因癌症死亡的主要原因[1]。肺癌骨转移发生率30%~40%[2],溶骨性转移引起的骨痛、骨折、骨相关事件严重影响晚期肺癌患者生活质量。笔者临证发现自然铜、鹿衔草可以改善肿瘤患者骨转移并发症。有报道发现,自然铜、鹿衔草可以抑制肺癌骨转移裸鼠模型的瘤体增长,其可能机制与促进肿瘤细胞的凋亡相关[3-4]。本实验通过对ICAM-1、MMP-9 及PTHrP 检测,探索自然铜、鹿衔草在肺癌骨转移过程中的作用机制。
1 实验材料
1.1 动 物 4 周龄BALB/c 裸鼠16~22g,25 只雌鼠,25 只雄鼠,购自上海斯莱克动物有限公司,许可证号SCXK(沪)2007—0005,分笼饲养于SPF 环境中,恒温、恒湿、隔音、静电屏蔽、12h/12h 明暗光照环境下,光照度≈100lux,自主获取灭菌普通饲料和饮水。本实验研究经温州医科大学实验动物中心动物实验伦理审核通过(批准编号:wydw2011-0043)。
1.2 实验细胞 选取人肺癌A549 细胞株,用含15%胎牛血清的RPMI-1640 培养基(pH7.0)在37℃、5%CO2的培养箱中培养。细胞株由浙江省温州医学院附属第一医院内科实验室提供。
1.3 药 物 鹿衔草(批号1109001W)、自然铜(批号1110001W)免煎颗粒由温州医科大学附属第一医院中药房购买,由深圳三九现代中药有限公司提供,每1g 免煎剂效量相当于10g 生药量效量。帕米磷酸二钠注射液(规格:5mL∶15mg,批号S0263)由瑞士诺华制药有限公司提供。0.9%生理盐水(规格:500mL,批号11042702)由福建海王公司提供。本实验中药品的溶解稀释均以0.9%生理盐水作为介质。
1.4 试 剂 Evagreen 染料购自上海BIO-RAD 公司(批号172-5200),反转录试剂盒购自美国Fermentas 公司(批号K1621)。山羊二步法检测试剂盒(批号pv9003)、小鼠二步法检测试剂盒(批号pv9002)、细胞间黏附分子-1(ICAM-1)抗体(批号SC-8439)、基质金属蛋白酶-9(MMP-9)抗体(批号SC-8640)均购自北京中杉金桥生物技术有限公司。甲状旁腺激素相关蛋白(PTHrP)抗体(批号A01321)及小鼠/兔IgG 试剂盒(批号SA1020)购自武汉博士德生物工程有限公司。
1.5 引 物 相应蛋白的DNA 序列通过搜索美国国立生物技术信息中心的DNA 数据库获得,根据该序列使用primer3.0 设计软件设计相应的引物,由上海Invitrogen 公司合成。用GAPDH 作为内参。引物序列如下:ICAM-1 F:5'-GTCTGCTGAGACCCCTCTTG-3',ICAM-1 R:5'-TTCACACTGAATGCCAGCTC-3',MMP-9 F:5'-GTGGATAGCTCGGTGGTGTT-3',MMP-9 R:5'-TGAATCAGCTGGCTTTTGTG-3',PTHrP F:5' -CTCCTGTTCTCTGCGTTTCC -3',PTHrP R:5' -CAGCCGAAATCAGAGCTACC -3',GAPDH F:5' -CCAGCCGAGCCACATCGCTC -3',GAPDH R:5' -ATGAGCCCCAGCCTTCTCCAT-3'。
1.6 仪 器 蛋白核酸分析仪购自美国贝克曼库尔特公司(型号:DV640)。梯度PCR 扩增仪购自日本TAKATRA 公司(型号:TP600)。定量PCR 仪购自美国APPLIED BIOSYSTENS 公司(型号:7500)。离心机购自Eppendorf 公司产品(型号:5415D)。倒置显微镜购自德国徕卡公司产品(型号:DM 相差)。CO2培养箱购自美国FORMA 公司(型号:3111)。电子分析天平购自上海天平仪器厂产品(型号:JW2502)。
2 实验方法
2.1 造 模 1%戊巴比妥钠按75mg/kg 麻醉裸鼠后,将裸鼠仰卧于操作台,充分暴露其右下肢,以穿刺点为中心,用75%医用酒精消毒3 次。待皮肤略干后,取19G 注射针头连接装有制备好的A549 单细胞悬液的注射器,从右胫骨上端皮肤处垂直进针,将针头固定于右胫骨骨性粗隆上,然后沿胫骨纵轴缓慢旋转进针,获突破感后再缓慢进针约2mm,确保针头进入骨髓腔后,注入0.1mL 制备好的A549 单细胞悬液,用消毒棉球按压数秒。然后,将裸鼠分笼饲养于SPF 级动物实验中心,恢复1 周后开始给药。
2.2 分组及给药 实验鼠50 只按照随机数字表法分为五组,每组10 只,连续给药3 周。(1)自然铜组:按6g/kg 隔天灌胃自然铜混悬液(约0.5mL),隔7 天腹腔注射0.16mL 生理盐水;(2)鹿衔草组:按6g/kg隔天灌胃鹿衔草混悬液,隔7 天腹腔注射0.16mL 生理盐水;(3)联合给药组:按6g/kg 隔天灌胃自然铜和鹿衔草混合溶液,隔7 天腹腔注射0.16mL 生理盐水;(4)阳性对照组:按10mg/kg 隔7 天腹腔注射帕米磷酸二钠(约0.16mL),隔天灌胃0.5mL 生理盐水;(5)模型对照组:隔天灌胃0.5mL 生理盐水,隔7 天腹腔注射0.16mL 生理盐水。
2.3 免疫组化法检测ICAM-1、MMP-9 及PTHrP 蛋白表达 给药结束后,以颈椎脱臼法处死裸鼠并剥离胫骨处肿瘤组织,每份标本一分为二。一份用4%多聚甲醛溶液固定,制作成常规切片后,按照试剂盒说明书严格执行免疫组化步骤检测ICAM-1、MMP-9 及PTHrP 蛋白表达水平。结果判断:蛋白表达阳性细胞胞浆中可出现棕黄色颗粒。采用两人双盲法观察切片,在200 倍镜下每组随机选取10 个视野,每个视野计数100 个细胞,共计1000 个肿瘤细胞,然后计算每组阳性细胞百分率。
2.4 实时荧光定量PCR(qRT-PCR)检测ICAM-1、MMP-9 及PTHrP 蛋白mRNA 表达 剩余组织在无菌操作台内按步骤提取RNA 后,在梯度PCR 扩增仪内经逆转录获取cDNA,最后以cDNA 及设计的相应引物为模板扩增获得ICAM-1、MMP-9 及PTHrP mRNA 相对表达量。相关操作步骤及反应体系均参考温州医科大学附属第一医院内科实验室的标准[5]。
2.5 统计学方法 应用SPSS 19.0 统计软件处理所有数据,计量资料以均数±标准差表示,采用单因素方差分析(one-way ANOVA)方法检验,P<0.05为差异有统计学意义。
3 实验结果
3.1 各组ICAM-1、MMP-9 及PTHrP 蛋白表达水平比较 自然铜组、鹿衔草组及联合给药组ICAM-1与MMP-9 表达阳性细胞百分率较模型对照组及阳性对照组均明显减少(P 均<0.01)。联合给药组及阳性对照组PTHrP 表达阳性细胞百分率较模型对照组减少(P<0.05,P<0.01),自然铜组、鹿衔草组PTHrP表达阳性细胞百分率与模型对照组比较,差异无统计学意义(P>0.05)。自然铜组、鹿衔草组及联合给药组PTHrP 表达阳性细胞百分率较阳性对照组增多(P均<0.01),见表1。
表1 各组ICAM-1、MMP-9 及PTHrP 蛋白表达阳性细胞百分率比较(%)
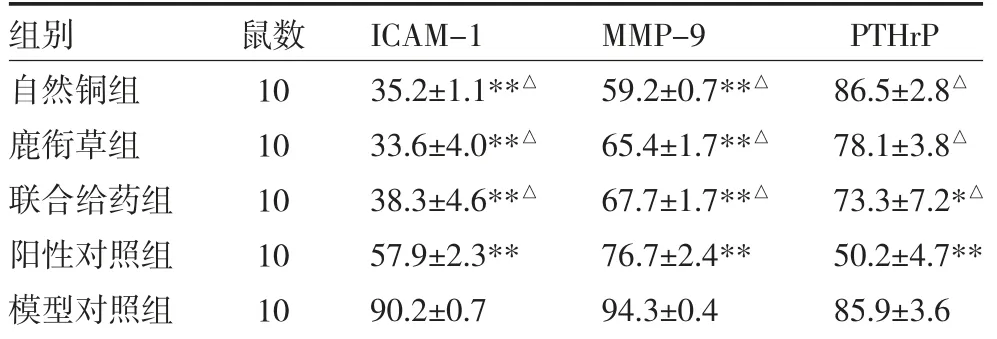
表1 各组ICAM-1、MMP-9 及PTHrP 蛋白表达阳性细胞百分率比较(%)
注:与模型对照组比较,*P<0.05,**P<0.01;与阳性对照组比较,△P<0.01;自然铜组:灌胃自然铜及腹腔注射0.9%生理盐水;鹿衔草组:灌胃鹿衔草及腹腔注射0.9%生理盐水;联合给药组:灌胃自然铜与鹿衔草及腹腔注射0.9%生理盐水;阳性对照组:腹腔注射帕米膦酸二钠及灌胃0.9%生理盐水;模型对照组:灌胃及腹腔注射0.9%生理盐水;ICAM-1:细胞间黏附分子-1;MMP-9:基质金属蛋白酶-9;PTHrP:甲状旁腺激素相关蛋白
组别自然铜组鹿衔草组联合给药组阳性对照组模型对照组鼠数10 10 10 10 10 ICAM-1 35.2±1.1**△33.6±4.0**△38.3±4.6**△57.9±2.3**90.2±0.7 MMP-9 59.2±0.7**△65.4±1.7**△67.7±1.7**△76.7±2.4**94.3±0.4 PTHrP 86.5±2.8△78.1±3.8△73.3±7.2*△50.2±4.7**85.9±3.6
3.2 各组ICAM-1、MMP-9 及PTHrP mRNA 表达水平比较 自然铜组、鹿衔草组及联合给药组ICAM-1、MMP-9 mRNA 表达水平较模型对照组及阳性对照组降低(P<0.05,P<0.01)。联合给药组、阳性对照组PTHrP mRNA 表达水平较模型对照组降低(P<0.01),自然铜组、鹿衔草组及联合给药组PTHrP mRNA 表达水平较阳性对照组升高(P<0.01),见表2。
表2 各组ICAM-1、MMP-9 及PTHrP mRNA 相对表达量比较(×10-2)

表2 各组ICAM-1、MMP-9 及PTHrP mRNA 相对表达量比较(×10-2)
注:与模型对照组比较,*P<0.01;与阳性对照组比较,△P<0.05,△△P<0.01;自然铜组:灌胃自然铜及腹腔注射0.9%生理盐水;鹿衔草组:灌胃鹿衔草及腹腔注射0.9%生理盐水;联合给药组:灌胃自然铜与鹿衔草及腹腔注射0.9%生理盐水;阳性对照组:腹腔注射帕米膦酸二钠及灌胃0.9%生理盐水;模型对照组:灌胃及腹腔注射0.9%生理盐水;ICAM-1:细胞间黏附分子-1;MMP-9:基质金属蛋白酶-9;PTHrP:甲状旁腺激素相关蛋白
组别自然铜组鹿衔草组联合给药组阳性对照组模型对照组鼠数10 10 10 10 10 ICAM-1 10.0±0.5*△7.3±0.6*△△6.6±1.1*△△20.4±3.2*100.8±13.8 MMP-9 11.9±2.2*△△21.7±5.1*△△23.4±5.9*△△45.5±7.4*100.3±9.0 PTHrP 87.8±17.3△△103.1±23.6△△74.7±17.1*△△18.5±3.7*100.9±14.9
4 讨 论
肺癌骨转移的过程可以分为以下4 个阶段:肺癌细胞的脱落与外侵、趋化与迁移、黏附及溶骨性骨破坏[6]。MMP-9 通过降解细胞外基质和基底膜,在肺癌细胞的脱落与外侵过程中发挥作用[7]。此外,MMP-9 的高表达与新生血管的生成有关[8]。本研究发现,自然铜、鹿衔草及两者合用均可以抑制肿瘤骨转移组织MMP-9 蛋白表达水平及mRNA 表达量,从而减少新生血管的形成,降低肺癌细胞外侵的风险。ICAM-1 可促进肿瘤细胞的“归巢”并“定居”骨髓,且ICAM-1 表达水平和肿瘤的分期呈正相关[9-10]。本研究中,自然铜、鹿衔草及两者合用均能较好地抑制肿瘤表面ICAM-1 表达水平,从而抑制肺癌细胞的趋化与迁移以及肺癌细胞的黏附。癌细胞产生的PTHrP 对破骨细胞具有强力的趋化作用。癌细胞骨转移后,引起局部的高钙水平,可以促进骨转移性肿瘤细胞的生长和PTHrP 的分泌,形成破骨性转移的“恶性循环”,而且PTHrP 阳性表达率越高,肺癌骨转移就越容易发生[11-14]。本研究中,自然铜或者鹿衔草单用对PTHrP 的抑制作用不明显,而自然铜、鹿衔草合用却能够明显抑制肿瘤组织PTHrP 表达。提示自然铜、鹿衔草之间可能存在的协同促进作用。但具体机制有待更进一步的实验来探索。
综上所述,自然铜、鹿衔草在肺癌骨转移的脱落与外侵、趋化与迁移及黏附环节中具有较好的抑制作用。而在肺癌骨转移的溶骨性破坏阶段,单用自然铜、鹿衔草效果不理想,其联合用药可以发挥一定的抑制作用,这可能与药物间相互协同作用相关。
