TRAF6基因对缺氧复氧肝细胞凋亡、Caspase-3、Caspase-9表达及线粒体膜电位的影响
2019-09-17孟宏涛
顾 勇, 杨 艳, 孟宏涛, 李 娜
1.武警陕西总队医院消化内科,陕西 西安 710054; 2.空军军医大学第一附属西京消化病医院四科
缺血基础上恢复血流,组织损伤加重,甚至产生不可逆性损伤现象称为缺血性再灌注损伤(ischemia-reperfusion injury,I/RI)[1]。肝I/RI损伤机制复杂,肝缺血再灌注(ischemia reperfusion, I/R)过程中各种机制相互作用,最终可引起肝脏受损,引起肝细胞、肝窦状细胞、胆管上皮细胞发生死亡[2]。研究证实,细胞凋亡是I/R损伤后细胞凋亡的重要方式[3]。因此,抑制I/R引起的肝细胞凋亡,对于I/RI治疗具有重要意义。肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factor,TRAF)是一种重要的接头分子,共有TRAF 1~7七个成员,在多种信号通路中均发挥重要作用[4]。有研究显示,抑制TRAF6表达可明显促进宫颈癌细胞凋亡,上调Caspase-3表达[5]。提示TRAF6可通过调节Caspase家族相关蛋白表达而影响细胞凋亡。抑制TRAF6表达可通过下调NF-κB p65水平,抑制炎症相关细胞因子和炎性介质表达水平,从而减轻内毒素/半乳糖诱导的小鼠急性肝损伤[6];miR-146A可通过抑制IRAK1和TRAF6表达改善肝I/RI[7]。目前TRAF6对缺氧复氧(H/R)引起的肝细胞凋亡及机制尚不清楚。因此,本研究设计合成TRAF6特异性siRNA,并将其转染人正常肝L02细胞,检测细胞凋亡率变化,并进一步检测凋亡相关蛋白Caspase-3、Caspase-9及线粒体膜电位变化。以期为肝损伤的治疗提供理论基础。
1 材料与方法
1.1 试剂和仪器DMEM培养基购自美国Gibco;胎牛血清购自杭州四季青;细胞凋亡试剂盒购自江苏凯基;LipofectamineTM2000购自美国Invitrogen公司;Rhodamine 123购自美国Sigma;TRAF6、Caspase-3和Caspase-9抗体均购自美国CST;流式细胞仪购自美国BD。
1.2 细胞培养及转染人正常肝L02细胞购自中国科学院上海细胞库。细胞使用质量浓度为100 ml/L胎牛血清的DMEM培养液,在体积分数为5%的CO2、37 ℃恒温培养箱培养。转染前以1×105/孔接种L02细胞于6孔板,预先加含青链霉素双抗及血清的DMEM培养液2 ml,在体积分数为5%的CO2、37 ℃恒温培养箱培养,待细胞为80%~90%生长汇合度时,参照脂质体LipofectamineTM2000试剂盒说明,分别制备设计合成的TRAF6特异性siRNA(si-TRAF6)及无干扰作用的siRNA(NC组)与脂质体复合物,并设置仅加脂质体的为空白组,将复合物加入6孔板相应的孔内,于培养箱内常规孵育5~6 h,更换为含血清的培养液继续培养。
1.3 分组及处理将L02细胞随机分为对照组:不进行转染和H/R处理;H/R组:细胞缺氧12 h,复氧12 h;H/R+NC组:通过脂质体LipofectamineTM2000转染无干扰作用的siRNA后进行H/R处理;H/R+si-TRAF6:通过脂质体LipofectamineTM2000转染TRAF6特异性siRNA后进行H/R处理。
1.4 Western blottingsi-TRAF6转染L02细胞及细胞经H/R处理后,加入适量的预冷裂解液(RIPA∶PMSF=100∶1),在冰上裂解反应30 min,以12 000 r/min 4 ℃离心5 min,收集上清。通过BCA试剂盒检测上清中蛋白浓度。按照每泳道50 μg上样,经SDS-PAGE,湿转法将凝胶中的蛋白质转至PVDF膜,质量浓度为50 g/L脱脂奶粉封闭膜1 h,加一抗稀释液(TRAF6、Caspase-3和Caspase-9抗体,均为1∶1 000),4 ℃孵育过夜,TBST洗膜,加HRP标记的二抗稀释液(1∶3 000),37 ℃孵育1 h,TBST洗膜,将ECL显色液滴加至PVDF膜上,曝光,采集图像,Quantity-One软件分析灰度值。蛋白相对表达量=目的蛋白灰度值/内参GAPDH灰度值。实验重复3次。
1.5 细胞凋亡检测分组同1.3。不含EDTA的胰酶消化各组细胞,制备成细胞悬液,预冷PBS洗涤细胞,收集(1~5)×105个细胞,加500 μl Binding Buffer悬浮细胞,之后加入5 μl Annexin V-FITC,混匀,再加入5 μl PI,混匀,暗室室温反应10~15 min,上机前再加入300 μl Binding Buffer,通过流式细胞仪检测。具体操作按照试剂盒说明。实验重复3次。
1.6 线粒体膜电位测定取1.5项制备的细胞悬液,PBS冲洗,以2 000 r/min离心5 min,0.5 ml PBS重悬细胞,取Rhodamine 123储备液(-20 ℃下溶于DMSO,浓度1.0 g/L)加入细胞悬液中,并将终浓度调整为10.0 mg/L。37 ℃下染色,30 min后通过流式细胞仪分析。实验重复3次。

2 结果
2.1 si-TRAF6转染L02细胞效果将TRAF6特异性siRNA转染L02细胞后,TRAF6蛋白表达明显低于空白组(P<0.05),而转染无干扰作用的siRNA对TRAF6表达无影响,说明构建的抑制TRAF6表达的细胞成功(见图1、表1)。

图1 Western blotting检测转染si-TRAF6的L02细胞TRAF6蛋白表达Fig 1 Expression of TRAF6 protein in L02 cells transfected with si-TRAF6 detected by Western blotting
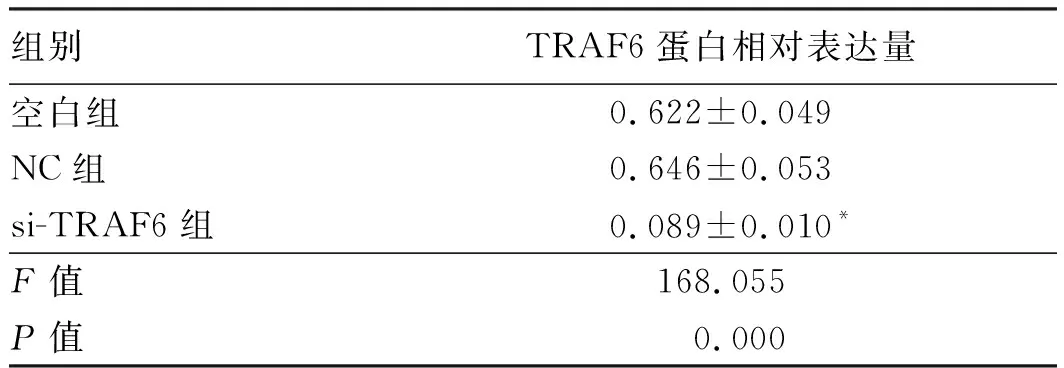
组别TRAF6蛋白相对表达量空白组0.622±0.049NC组0.646±0.053si-TRAF6组0.089±0.010*F值168.055P值0.000
注:与空白组比较,*P<0.05。
2.2 H/R后的L02细胞TRAF6蛋白表达水平H/R可明显上调L02细胞TRAF6蛋白表达,而L02细胞转染si-TRAF6后使用H/R处理,TRAF6蛋白表达明显降低(P<0.05)(见图2、表2)。

图2 Western blotting检测H/R后TRAF6蛋白表达Fig 2 Expression of TRAF6 protein in L02 cells after treatingwith H/R detected by Western blotting
2.3 抑制TRAF6蛋白表达对H/R诱导的L02细胞凋亡及膜电位影响H/R可明显促进L02细胞凋亡,降低细胞膜电位,而抑制TRAF6蛋白表达可减弱H/R对细胞凋亡和膜电位影响(P<0.05)(见图3、表3)。

表2 各组细胞TRAF6的蛋白相对表达量
注:与对照组比较,*P<0.05;与H/R+NC组比较,#P<0.05。

表3 抑制TRAF6蛋白表达对H/R诱导的L02细胞凋亡及膜电位影响Tab 3 Effects of TRAF6 protein inhibition on apoptosis and membrane potential of L02 cells induced by H/R
注:与对照组比较,*P<0.05;与H/R+NC组比较,#P<0.05。
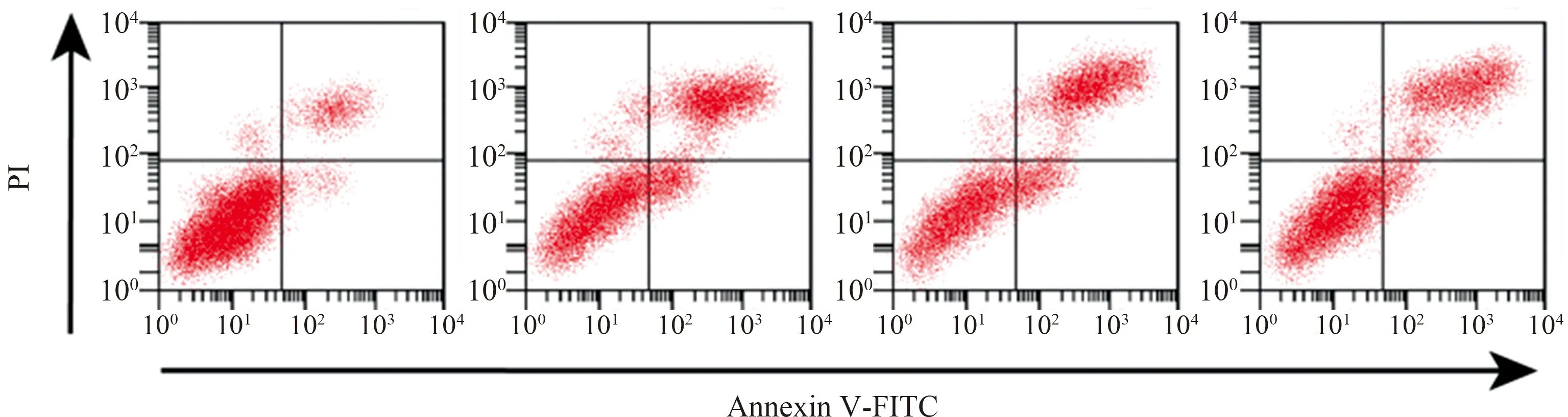
图3 抑制TRAF6蛋白表达对H/R诱导的L02细胞凋亡及膜电位影响Fig 3 Effects of TRAF6 protein inhibition on apoptosis and membrane potential of L02 cells induced by H/R
2.4 抑制TRAF6蛋白表达对H/R诱导的L02细胞Caspase-3和Caspase-9表达影响H/R可明显上调L02细胞Caspase-3和Caspase-9蛋白表达,而抑制TRAF6蛋白表达可减弱H/R对L02细胞Caspase-3和Caspase-9表达上调作用(P<0.05)(见图4、表4)。
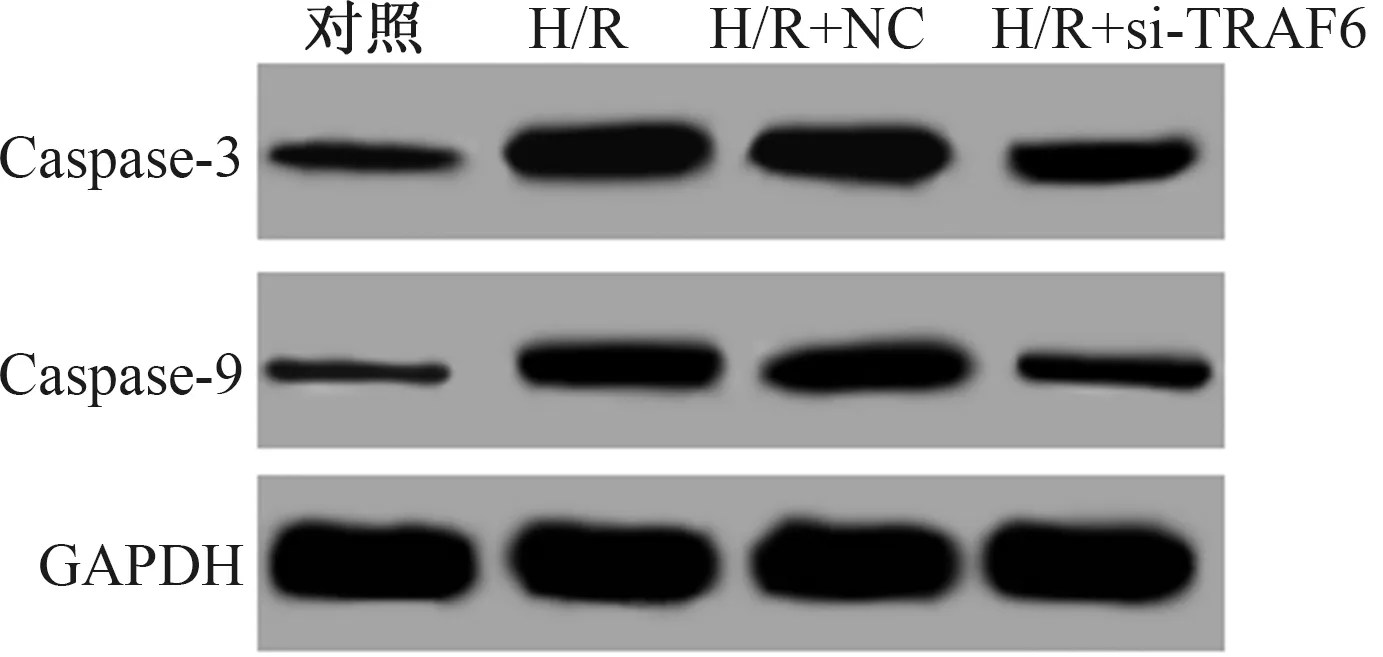
图4 Western blotting检测抑制TRAF6蛋白表达对H/R诱导的L02细胞Caspase-3和Caspase-9表达影响Fig 4 Effects of TRAF6 protein inhibition on expressions of Caspase-3 and Caspase-9 in L02 cells induced by H/R detected by Western blotting

组别Caspase-3Caspase-9对照组0.072±0.0080.051±0.006H/R组0.578±0.056*0.253±0.026*H/R+NC组0.553±0.051*0.269±0.028*H/R+si-TRAF6组0.202±0.018#0.109±0.012#F值125.63384.320P值0.0000.000
注:与对照组比较,*P<0.05;与H/R+NC组比较,#P<0.05。
3 讨论
细胞凋亡是细胞的一种程序性死亡过程。在对肝I/RI机制的初步研究表明,肝I/RI可引起肝细胞内抑凋亡基因和促凋亡基因表达改变,从而引起细胞发生凋亡,肝细胞凋亡是肝I/RI中肝细胞死亡的一种方式[8]。I/RI可引起细胞凋亡,其凋亡途径可能与线粒体信号通路及死亡受体信号通路有关[9]。因此,寻找引起肝I/R损伤的原因具有重要意义。TRAF6是一种重要的细胞内多功能信号因子,具有独特的受体结合特异性,可参与细胞增殖、凋亡、胚胎发育及骨骼代谢等过程[10]。有研究显示,TRAF6与多种肿瘤细胞增殖、凋亡等生物学特性密切相关,抑制其表达可降低肿瘤细胞生长[11-12]。目前TRAF6在肝损伤中的研究较少,有研究显示,异甘草酸镁可能通过抑制TRAF6及JNK信号通路,降低由ConA引起的肝脏自噬和凋亡水平,从而改善肝损伤[13];miR-146可通过抑制IRAK1和TRAF6表达改善肝I/RI[7]。但目前关于TRAF6引起肝损伤的机制尚未明确。
肝细胞凋亡是引起肝脏损伤和肝脏疾病的一个中心环节。细胞凋亡机制主要涉及线粒体诱导的内源性通路、死亡受体介导的外源性凋亡通路、ERS启动的凋亡途径等[14-15]。Caspase蛋白在凋亡起始和信号传导过程中均发挥重要作用,在外源性信号通路中,Caspase-8是由死亡受体激活的,Caspase-8的激活可进一步裂解并激活Caspase-3,此外,Caspase-8还可诱导Bid蛋白裂解,Bid蛋白的裂解可使线粒体释放细胞色素C,进而激活Caspase-3和Caspase-9,而Caspase-3的激活可引起底物PARP裂解活化,引起细胞发生凋亡[16-17]。有研究显示,缺氧等细胞外损伤信号传导到线粒体后,可改变线粒体膜渗透性,使细胞色素C释放入胞质,可相继激活Caspase-9和Caspase-3,从而引起细胞凋亡[18-19]。TRAF6可通过诱导Caspase-8依赖性细胞凋亡和NF-κB活化调节细胞活力[20];提高线粒体膜电位可减弱肝损伤[21]。本研究旨在探讨TRAF6蛋白对H/R诱导的肝细胞凋亡影响及机制。通过将TRAF6特异性siRNA转染L02细胞,发现细胞中TRAF6蛋白表达明显降低,TRAF6蛋白表达降低可明显减弱由H/R诱导的L02细胞凋亡,且可下调Caspase-3蛋白和Caspase-9蛋白表达,提高线粒体膜电位。提示TRAF6对H/R肝损伤机制可能与调控线粒体途径有关。
综上所述,抑制TRAF6基因表达可降低H/R诱导的L02细胞凋亡,提高线粒体膜电位,下调Caspase-3蛋白和Caspase-9蛋白表达。提示TRAF6可能是一个用于肝损伤治疗的有效分子靶点,但目前TRAF6在肝脏疾病研究中相对较少,还需进一步探讨和研究。
