miR-223-3p在乙型肝炎相关慢加急性肝衰竭患者中的表达及其与预后的关系
2019-09-17邱源旺黄利华苏婷婷周学士毛燕群戴亚萍
周 莉,邱源旺,黄利华,苏婷婷,周学士,毛燕群,陆 雁,汪 铮,阎 岩,王 俊,戴亚萍
无锡市第五人民医院感染病重症医学科,江苏 无锡 214000
乙型肝炎病毒(hepatitis B virus,HBV)感染引起的慢加急性肝衰竭病死率极高,严重危害患者的健康[1]。然而乙型肝炎相关慢加急性肝衰竭(HBV-related acute-on-chronic liver failure,HBV-ACLF)的发生和发展机制尚不明确。微小核糖核酸(microRNA,miR)是近年来备受关注的一类分子,研究报道微小核糖核酸223-3p(miR-223-3p)与肝脏恶性肿瘤、肝纤维化、肝损伤的发病密切相关[2-4],但miR-223-3p是否参与HBV-ACLF的发生及发展知之甚少。本研究旨在探讨miR-223-3p在HBV-ACLF患者血浆中的表达及其与预后的关系,以期寻找新的HBV-ACLF诊断和预后评价的生物标志物。
1 资料与方法
1.1 一般资料选择2014年1月至2017年12月无锡市第五人民医院住院和门诊就诊的HBV-ACLF、慢性乙型肝炎(chronic hepatitis B,CHB)患者50例,诊断符合我国2015年更新的《慢性乙型肝炎防治指南》[5],纳入标准:(1)HBsAg阳性持续6个月以上,HBV DNA≥2 000 IU/ml;(2)血清总胆红素每天上升≥17.1 μmol/L,或大于正常上限10倍;(3)PTA≤40%或INR≥1.5。排除标准:(1)经影像学、Fibrotouch或肝活检诊断为肝硬化的患者;(2)合并药物性肝损伤、酒精性肝病、自身免疫性或胆汁淤积性肝病;(3)孕妇;(4)伴有恶性肿瘤、严重全身性疾病者;(5)近6个月内使用过激素等免疫调节剂的患者;(6)近6个月内使用过干扰素或核苷酸类似物抗病毒治疗的患者。
1.2 检测方法
1.2.1 血浆miR-223-3p检测:采集HBV-ACLF、CHB患者及健康体检者空腹外周血3 ml,分离血浆,-80 ℃冰箱保存备用。以U6为外源性内参,运用PRISM®7500型荧光定量PCR仪(美国,ABI公司),采用实时荧光定量PCR(RT-qPCR)法检测各组患者血浆中miR-223-3p的表达水平,has-miR-223-3p的Stem-Loop RT引物(5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTGGGGT-3′)和PCR引物(F:5′-GGGGTGTCAGTTTGTCAAA-3′,R:5′-CAGTGCGTGTCGTGGAGT-3′)、U6RT引物(5′-AAAATATGGAACGCT-3′)和PCR引物(F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCACGAATTTGCGT-3′),均购自上海生工生物工程(上海)股份有限公司,严格按照miRNeasy Mini Kit试剂盒(Qiagen,德国,217004)、miRcute增强型miRNAcDNA第一链合成试剂盒(北京天根生化科技有限公司,KR211)、miRcute 增强型miRNA荧光定量检测试剂盒(北京天根生化科技有限公司,FP411)说明书进行操作。每个样本检测设置3个平行孔,取均值并根据△Ct计算每个miRNAs的相对表达量,且标准差的差值<0.5,△Ct=Ct miR-223-3p-Ct U6,△△Ct =△Ct 实验组样品-△Ct对照组样品,以公式2-△△Ct计算miR-223-3p的相对表达量。
1.2.2 检测肝功能和肾功能:生化指标、HBV DNA、HBV基因型、凝血功能,包括凝血酶原活动度(prothrombin activity,PTA)、国际标准化比值(international normalized ratio,INR)。HBV DNA及基因型由罗氏Lightcycle基因荧光定量分析仪(瑞士,罗氏公司)检测,HBV DNA试剂盒购自瑞士罗氏公司,检测灵敏度为20拷贝/ml;乙型肝炎病毒标志物(HBV-M)应用1235时间分辨荧光免疫分析仪(芬兰,Perlin Elmer Life Sciences公司)检测;凝血功能(PTA、INR)采用Stago-Evolution血凝仪(法国,Stago公司)及配套试剂检测;肝功能和肾功能生化指标采用日立7600全自动生化分析仪(日本,株式会社日立高新技术公司)及配套试剂检测。
1.3 统计学分析采用SPSS 19.0统计软件分析,计量资料以均数±标准差表示,采用方差分析或t检验,组间率的比较采用χ2检验,采用Pearson法进行相关性分析,Cox模型分析HBV-ACLF患者预后的相关影响因素,所有统计分析基于双侧假设检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 基本临床资料选取HBV-ACLF、慢性乙型肝炎(CHB)患者各50例,健康对照者(healthy controls,HC)30名,3组患者年龄、性别比较,差异均无统计学意义(F=0.285、0.979,P均>0.05),HBV-ACLF组与CHB组间HBV DNA水平、基因分型比较差异均无统计学意义(t=1.585,χ2=0.164,P均>0.05),HBV-ACLF组丙氨酸转氨酶(alanine transaminase,ALT)水平、总胆红素(total bilirubin,TBil)、终末期肝病模型(model for end-stage liver disease,MELD)评分显著高于CHB组和HC组(t=5.199、17.938、6.578和9.541、19.636、13.383,P均<0.001),PTA水平显著低于CHB组和HC组(t=-15.146、-53.277,P均<0.001)(见表1)。

表1 不同人群基线特征比较Tab 1 Comparison of baseline characteristics among different populations
注:与HC组比较,*P均<0.001。
2.2 不同人群外周血血浆中miR-223-3p相对表达量比较HBV-ACLF组miR-223-3p表达量显著高于CHB组和HC组,组间比较差异有显著统计学意义(t=11.935、17.053,P均<0.001),CHB组miR-223-3p表达量高于HC组,差异有统计学意义(t=9.581,P<0.001)(见表1)。
2.3 血浆miR-223-3p相对表达量与ALT、TBil、HBV DNA、PTA、MELD评分的相关性miR-223-3p的表达量与HBV-ACLF患者的ALT、TBil、MELD评分呈正相关(r=0.610、0.808、0.702,P均<0.001),与PTA水平呈负相关(r=-0.846,P<0.001),但与HBV DNA水平无相关性(r=0.040,P=0.695)。
2.4 血浆miR-223-3p相对表达量与HBV-ACLF患者预后的相关性将HBV-ACLF患者按照24周预后分为存活组和死亡组,HBV-ACLF死亡组PTA水平显著低于存活组(t=-6.845,P<0.001),MELD评分高于存活组(t=2.883,P=0.006),miR-223-3p相对表达量显著高于存活组(t=6.127,P<0.001)(见表2)。
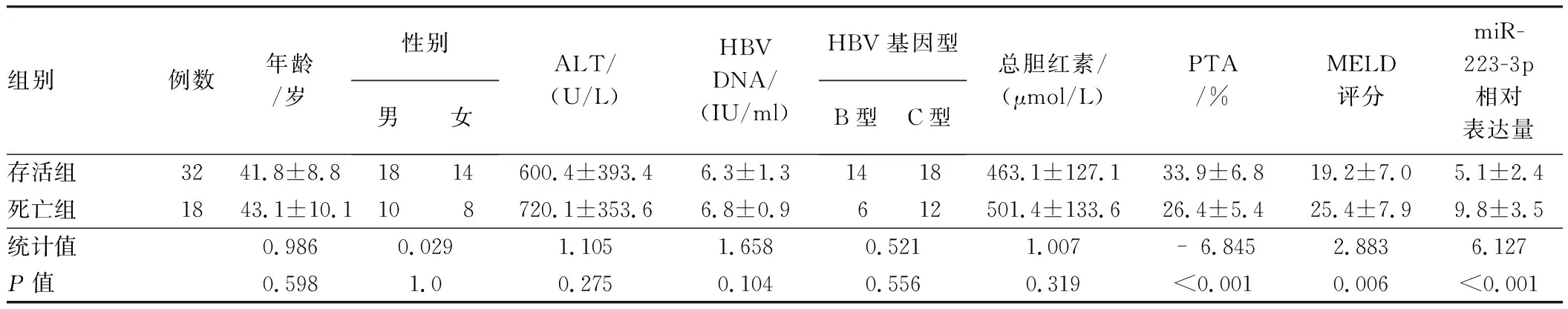
表2 HBV-ACLF存活组与死亡组患者的基线特征比较Tab 2 Comparison of baseline characteristics of HBV-ACLF between survival group and death group
2.5 多因素Cox模型分析将年龄、性别、ALT水平、TBil水平、基线HBV DNA、HBV基因型、PTA、MELD评分进行单因素分析差异有统计学意义的ALT、TBil、PTA、MELD评分、miR-223-3p相对表达量进行多因素Cox模型分析,结果显示,与HBV-ACLF患者死亡相关的影响因素依次为停药时血浆miR-223-3p表达量(P=0.023)、PTA(P=0.044)和MELD评分(P=0.049)(见表3)。

表3 停药后复发的多因素Cox模型分析Tab 3 Multivariate Cox model analysis of recurrence after drug discontinuation
注:模型似然比检验,χ2=36.580,P<0.001。
3 讨论
miRNA是近年来新发现的一类非编码小分子RNA,其表达丰富,作用广泛,胚胎发育、细胞增殖分化均受miRNA的调控,同时miRNA是HBV感染和乙型肝炎进展的重要介质,与血中氨基转移酶(ALT/AST)等指标相比miRNA的变化发生得更早,更具组织特异性和可靠性[6],因此,作为机体免疫应答的始动者,miRNA在HBV感染发病机制中的作用也日益得到重视。miR-223位于X染色体q12上,其异常表达与肝脏炎症损伤、肝细胞癌密切相关。QI等[7]研究报道,在肝细胞癌患者较健康人血清中miR-223明显高表达,但miR-223在HBV感染患者血清中表达较肝细胞癌和健康人均升高,结果提示miR-223与肝细胞损伤有关。YU等[8]研究miR-223在小鼠缺血再灌注肝脏损伤模型中的作用时,发现miR-223在肝缺血再灌注后表达水平显著增加,而且miR-223表达水平与小鼠缺血再灌注肝损伤的血清标记物(ALT/AST)呈正相关,提示miR-223的异常高表达可能参与缺血再灌注肝损伤的关键过程。SCHUELLER等[9]研究结果显示,在急性和慢性小鼠肝脏损伤模型中,肝脏miR-223表达上调仅限于肝细胞并且与肝损伤程度和肝细胞死亡相关。然而,miR-223在CHB患者与HBV-ACLF患者间的表达差异及miR-223的表达在HBV-ACLF发生中的作用鲜见报道。本研究结果显示,HBV-ACLF患者miR-223-3p表达量不但较健康人群明显升高,且显著高于CHB患者(P均<0.001),结果提示miR-223-3p水平高表达与HBV-ACLF的发生密切相关。
目前有研究结果显示,不同的miRNA表达在病毒性肝炎的发生中作用不同,有的促进病毒复制,有的抑制其复制,因此,miRNA的表达可能与HBV DNA水平相关。WAIDMANN等[10]研究结果显示,miR-22表达水平与HBV DNA水平密切相关,而且在乙型病毒携带、e抗原阳性慢性乙型肝炎、e抗原阴性慢性乙型肝炎的不同HBV感染阶段及HBV DNA>2 000 IU/ml、HBV DNA<2 000 IU/ml的不同HBV DNA定量水平,其表达水平差异均有统计学意义。HAYES等[11]报道,在慢性乙型肝炎患者血清miR-99a、miR-122和miR-125b表达水平与HBV DNA水平相关。然而,miR-223-3p表达水平与HBV DNA水平的相关性鲜见报道,本研究结果显示,两者并无相关性,可能与我们入组观察的CHB和HBV-ACLF病例HBV DNA水平差异无统计学意义,能否说明HBV-ACLF患者血浆miR-223-3p表达水平升高与病毒复制无相关性仍需进一步研究和验证。
目前,miR-223-3p的表达水平与ACLF患者的预后是否相关并不清楚。本研究结果显示,死亡组患者miR-223-3p相对表达量显著高于存活组,单因素及多因素Cox模型分析结果显示,miR-223-3p的表达水平与HBV-ACLF患者死亡相关。而且miR-223-3p的表达与ALT、TBil、MELD评分呈正相关,与PTA水平呈负相关,提示miR-223-3p水平的高表达与HBV-ACLF的预后密切相关。
综上所述,血浆miRNA-223-3p在HBV-ACLF患者中表达水平升高与HBV-ACLF的发生及预后密切相关,有望成为HBV-ACLF诊断和预后评价的新指标。由于本研究入组病例数相对较少,有待扩大样本量进一步研究。
