长春新碱抗CD20免疫脂质体的制备及其对人B细胞淋巴瘤的靶向特异性杀伤作用研究
2020-11-27张亚柯黄玉娇杨玉娇
张亚柯 黄玉娇 李 英 崔 潇 杨玉娇 李 军
(聊城大学 药学院,山东 聊城 252059)
0 引言
免疫脂质体制剂作为靶向制剂的一种,具有精确靶向性、生物相容性好、毒性低、降低给药剂量、避免耐药性[1]和提高病人用药顺应性等优点[2,3].CD20在95%以上的B淋巴细胞型的非霍奇金淋巴瘤中特异性高表达[4,5].罗氏公司研发的抗CD20单克隆抗体药物美罗华(Rituximab,利妥昔单抗)上市以来,已经有多款以CD20为靶点的单克隆抗体药物在全球范围内上市或者处于研发管线[6],用于复发的或化疗抵抗性非霍奇金淋巴瘤[7,8].长春新碱作为常规联合化疗用药,在临床上广泛用于非霍奇金淋巴瘤等癌症治疗[9,10].然而,由于长春新碱对肿瘤细胞和正常体细胞具有非特异性杀伤作用[11],临床上会引起周围神经病(peripheral neuropathy)、低钠血症(Hyponatremia)等毒副作用[12].我们制备了长春新碱脂质体,并通过anti-CD20单克隆抗体免疫化修饰获得了包裹长春新碱的免疫靶向脂质体制剂[13],一系列体外实验证实该制剂可以特异性靶向杀伤B细胞淋巴瘤细胞[14].
1 材料和方法
1.1 主要试剂与仪器
Raji和Ramos细胞(美国标准生物品收藏中心(ATCC));细胞培养基RPMI-1640、胎牛血清(Thermo Fisher Scientific-GIBCO公司,美国);鞘磷脂、DSPE-PEG、Mal-PEG2000-DSPE(Avanti,美国);胆固醇(Sigma公司);50、100、200 nm孔径聚碳酸酯膜(Whatman公司);anti-CD20单克隆抗体(上海张江生物技术有限公司);氯仿、无水乙醇等试剂(J.T.Baker公司);Cell Counting Kit-8试剂盒(DOJINDO公司,日本);硫酸长春新碱(Vincr istine,VCR)(大连美仑生物公司,中国);Zeta电位仪Zetasizer Nano ZS(Malvern公司,英国);脂质体挤出器LF-1(Avestin公司,美国);托利多XP6百万分之一超微量天平(梅特勒,德国).
1.2 脂质体(LP)的制备—薄膜水化法
使用超微量天平,精密称量39 mg鞘磷脂、15 mg胆固醇、12 mg DSPE-PEG、2 mg Mal-PEG2000-DSPE于250 mL茄型旋转蒸发瓶中,溶于8 mL氯仿.37 ℃抽真空旋转蒸发45-60 min至薄膜形成,高纯氮气吹尽残留氯仿.加入6 mL 0.3 mol/L pH 4.0的柠檬酸溶液,顺时针震摇旋转蒸发瓶,把脂质薄膜从瓶壁上洗下来,得到半透明的脂质乳浊液.待水合完后,超声1分钟,使用脂质体挤出器,使其依次通过200、100、50 nm孔径聚碳酸酯膜,每种膜挤过10-20次,得到粒径均一的空白脂质体约5.5 mL.用截留分子量为1000的透析袋在0.3 mol/L柠檬酸溶液 (pH 4.0) 1 L透析6-8 h/次重复2次.每39 mg鞘磷脂加入0.4 mg CFPE [(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(carboxyfluorescein) (ammoniumsalt) ],利用上述制备方法制备荧光标记的脂质体Lip,随后进行Anti-CD20 Fab’免疫化修饰获得免疫化荧光脂质体Clip和BSA修饰免疫荧光脂质体Nlip,免疫化和BSA修饰方法如下所述[15].
1.3 长春新碱脂质体(LPV,Liposome-Vincristine)制备—pH值梯度法
取透析后的脂质体溶液0.2 mL,1 mg/mL长春新碱溶液0.5 mL,加入0.6 mL 1 mol/L Na2HPO4溶液中;将溶液pH值调至7.0,再加水补至2 mL体积,50 ℃水浴孵育10 min.取脂质体溶液加入到截留分子量为1000的透析袋中,置于1 L PBS溶液透析,6-8 h/次,共两次.
1.4 Anti-CD20 Fab’免疫化长春新碱脂质体(CLPV)制备
Anti-CD20 Fab’巯基化,Anti-CD20 Fab’与2-IT(2-Iminothiolane.HCL,蛋白巯基化试剂),按1:200的摩尔比例混合,室温下轻柔摇摆反应2 h,混匀样品.使用分子量1000透析袋,在1 L含5 mM EDTA的预冷PBS透析液中,透析去除未反应的2-IT,低速轻柔磁力搅拌,4 ℃,6-8 h,中间换液两次.通过BCA法测蛋白浓度和Ellman法测巯基浓度共同计算抗体片段的巯基化程度.使用Stewart分析法测定LPV脂质度,计算出Mal-PEG2000-DSPE浓度.按Mal-PEG2000-DSPE:Anti-CD20 Fab’摩尔比为1:10吸取LPV和巯基化的Anti-CD20 Fab’混匀,于16 ℃孵育过夜.使用分子量100000的透析袋去除游离的Anti-CD20 Fab’,PBS透析6 h,每2 h换一次液.
1.5 BSA修饰长春新碱脂质体(NCLPV)对照脂质体制备
制备方法与CLPV的制备流程相同,只是用BSA(牛血清白蛋白)替代Anti-CD20 Fab’,其他条件不变.
1.6 粒径测定
使用英国Malvern公司Zetasizer Nano ZS分析仪测定样品的粒径与zeta电位,每份样品重复3次.
1.7 包封率测定
配制1 mg/mL VCR水溶液,倍比稀释得到0.5 mg/mL、0.25 mg/mL、0.125 mg/mL、0.0625 mg/mL溶液.紫外分光光度计(Agilent公司),用400 μL 1%的TritonX-100,298 nm调零.分别取100 μL各浓度的长春新碱溶液加入700 μL 1%的TritonX-100溶液,制定标准曲线.取已透析好的长春新碱脂质体50 μL加入350 μL 1%的TritonX-100,涡旋1 min,室温放置5 min.检测其298 nm处光吸收度,代入建好的标准曲线,即可得到脂质体包封长春新碱的浓度.通过公式计算包封率,包封率=(脂质体中包封的药物/制备脂质体所加药物总量)×100%
1.8 免疫脂质体的靶向特异性检测
制备插入CFPE(488 nm激发发绿光荧光染料)的空白脂质体(Lip).分别用上述修饰方法用anti-CD20-Fab’和BSA修饰Lip,透析去除未连接的抗体和BSA获得免疫荧光脂质体Clip和NLip.将Clip、NLip和Lip分别与Raji和Ramos细胞孵育,4 ℃,1 h.然后使用BD流式细胞仪进行荧光检测.
1.9 细胞杀伤实验
以每孔3000个细胞分别接种Raji和Ramos细胞于96孔培养板(每孔100 μL).每孔加入9 μg/mL、3 μg/mL、1 μg/mL、0.3 μg/mL的CLPV、NCLPV和长春新碱溶液.每种药物设3个复孔,另设不加药物对照组.37 ℃,7% CO2中继续培养.分别在给药后24 h和48 h,使用CCK-8 Kit试剂盒测定细胞的增殖效率.
2 结果与分析
2.1 脂质体粒径检测
应用英国Malvern公司的Zeta电位仪Zetasizer Nano ZS分别检测空载脂质体LP、包封长春新碱脂质体LPV,anti-CD20 Fab’免疫化长春新碱脂质体CLPV和BSA修饰长春新碱脂质体NCLPV粒径.结果显示脂质体在经过脂质体挤出器多次挤出后,LP,LPV,CLPV,NCLPV的平均粒径分别为134、140、141、150 nm,四种脂质体平均粒径均小于200 nm, 分布均匀,呈正态性,跨距较小(图1).

注:(A)空载脂质体LP,(B)包封长春新碱脂质体LPV,(C)anti-CD20 Fab’免疫化长春新碱脂质体CLPV,(D) BSA修饰长春新碱脂质体NCLPV粒径.
图1脂质体粒径检测
2.2 包封率

图2 标准曲线
首先制备长春新碱1%的TritonX-100溶液298 nm浓度-光吸收标准曲线(图2),50 μL制备好的长春新碱脂质体加入350 μL 1%的TritonX-100测得OD值0.365,将测得的OD值代入方程y=1.7304x-0.007,OD值为Y值,计算可得浓度为0.215 mg/mL,包裹的总体积为2 mL,即:0.215 mg/mL×2 mL=0.43 mg,脂质体制备时长春新碱投料量为0.5 mg,所以测得包封率.包封率=(脂质体中包封的药物/制备脂质体所加药物总量)×100%=0.43/0.5×100%=86%.
2.3 免疫化脂质体与CD20阳性细胞的结合特异性
荧光标记的脂质体Lip, Anti-CD20 Fab’免疫化荧光脂质体Clip和BSA修饰免疫荧光脂质体Nlip,分别与CHO细胞(CD20-)、Raji细胞(CD20+)以及Ramos细胞(CD20+)孵育,流式细胞仪检测他们与CHO细胞(图3)、Raji细胞(图4)以及Ramos细胞(图5)的结合特异性.三种脂质体与CHO均几乎不能结合,Clip可以与CD20+细胞Raji和Ramos高亲和力特异性结合(结合率分别达到90.3%和83.0%),非免疫化Lip与BSA修饰Nlip与CD20+细胞Raji和Ramos几乎不能结合.

注:(A)Clip与CHO细胞的结合率为3.66%;(B)Nlip与CHO细胞的结合率为1.45%;(C)Lip与CHO细胞的结合率为0.280%.
图3免疫化和非免疫化脂质体与CHO细胞的结合特异性
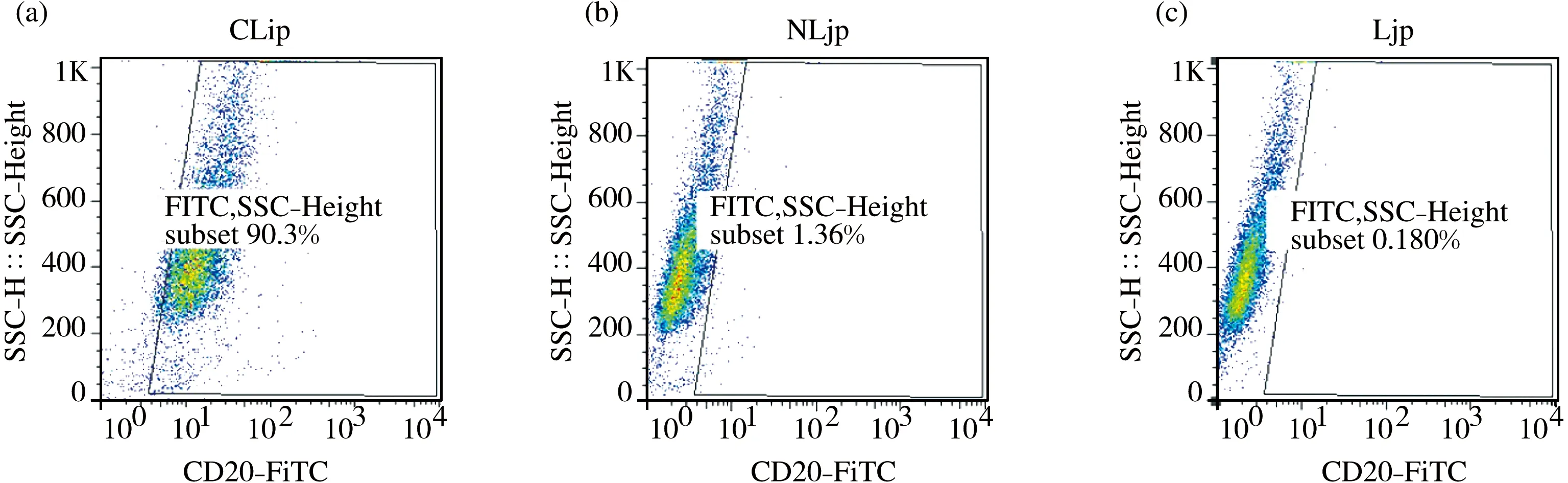
注:(A) Clip与Raji细胞的结合率为90.3%;(B)Nlip与Raji细胞的结合率为1.36%;(C)Lip与Raji细胞的结合率为0.180%.
图4免疫化和非免疫化脂质体与Raji细胞的结合特异性

注:(A)Clip与Ramos细胞的结合率为83.0%;(B)Nlip与Ramos细胞的结合率为1.10%;(C)Lip与Ramos细胞的结合率为0.290%.
图5免疫化和非免疫化脂质体与Ramos细胞的结合特异性
2.4 CLPV、NCLPV和VCR对B淋巴瘤细胞的靶向杀伤
CLPV与NCLPV和VCR分别以0.3,1,3,9 μg/mL四个不同浓度梯度处理Raji和Ramos细胞24 h和48 h,CCK-8 kit试剂盒检测细胞增值率,计算IC50(表1),检测CLPV与NCLPV和VCR对Raji和Ramos细胞的杀伤毒性.结果表明结果免疫化长春新碱脂质体24 h,48 h IC50值均远低于NCLPV和VCR.CLPV较NCLPV和VCR显著的提高了对B淋巴瘤细胞的杀伤作用(*p<0.05,**p<0.01),而NCLPV和VCR的杀伤效果较低;从时间点上观察,48 h的CLPV、NCLPV和VCR的细胞杀伤效果差距比24 h的差距更为明显.含有相同长春新碱浓度的CLPV对B淋巴瘤细胞杀伤效果比NCLPV和VCR的杀伤效果要提高10%-25%(图6).

表1 制备的各种脂质体的IC50值
3 讨论
恶性肿瘤现已超越心脑血管疾病成为全球第一位的死亡病因.据2011年公布的全球最新最全的癌症统计数据,2008年全世界约有1270万癌症新增患者,760万人死于癌症.世界卫生组织估计到2020年前,全球每年新增癌症患者将达到1500万.
化学药物治疗是当今癌症治疗的主要手段之一,临床上有超过40种常用化疗药物用于治疗各种癌症.然而化疗药物往往因其对正常细胞和癌症细胞无差别的毒性而“杀敌一千,自损八百”,引起严重的毒副作用.要进一步提高恶性肿瘤的医疗水平,除了研发新药,开发现有临床药物的新剂型,提高其对癌症组织的靶向性是一条切实可行的思路.自1965年Bangham等人发现了脂质体以来,经过众多科研人员近五十年的不懈努力,脂质体以其生物体内可降解,毒性低,无免疫原性,肝、脾网状内皮系统的被动靶向性等特性,作为药物传递系统取得了许多里程碑式的工作,如:pH梯度包埋法的发明,长循环脂质体(隐型脂质体)的制备及主动靶向脂质体的发明等.现如今已经有阿霉素脂质体注射液Doxil,紫杉醇脂质体Taxosomes,阿霉素柠檬酸盐脂质体注射液Myocet等多个脂质体药物上市.
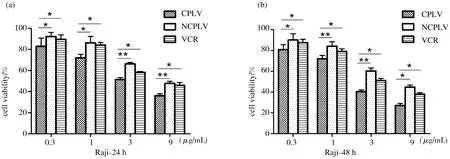

注:(A)处理Raji细胞24 h;(B)处理Raji细胞48 h;(C)处理Ramos细胞24 h;(D)处理Ramos细胞
48 h(*p<0.05,**p<0.01).
图6 CLPV、NCLPV和VCR对B淋巴瘤细胞的靶向杀伤
本课题结合当前最先进的脂质体制备技术和单克隆抗体药物的研发成果,探索一种以CD20+非霍奇金淋巴瘤为靶点的长循环免疫脂质体制备方法.以鞘磷脂、胆固醇、DSPE-P EG、Mal-PEG2000-DSPE为处方脂材制备脂质体,以pH梯度法DSPE-PEG的加入使脂质体表面PEG化,获得长循环脂质体(隐型脂质体)降低脂质体的被动靶向性,以anti-CD20 Fab’对脂质体进行免疫化修饰,使脂质体具有主动靶向性.
通过粒径和包封率对制备的脂质体进行表征分析.粒径分析表明,我们获得的长循环空白脂质体(LP)平均粒径为134 nm.pH梯度法包封长春新碱后获得的长循环长春新碱脂质体(LPV)粒径较LP略有增大,平均粒径为140 nm.而对LPV进行anti-CD20-Fab’修饰最终获得长循环长春新碱免疫脂质体(CLPV),平均粒径141 nm,较LPV几乎没有变化.以上结果表明我们制备的长循环空白脂质体(LP),长循环长春新碱脂质体(LPV),长循环长春新碱免疫脂质体(CLPV)平均粒径均在150 nm以下,作为药物载体具有很好的粒径分布范围,而且粒径分析图也表明粒径分布均匀,呈正态性,且跨距较小.包封率分析表明,我们获得了86%的包封率,说明pH梯度法在将来的长春新碱脂质体工业化制备过程中具有良好的应用前景.
体外抗肿瘤实验表明获得的长春新碱免疫脂质体其具有较好的生物活性.结合特异性分析表明anti-CD20修饰脂质体对CD20+阳性的Raji和Ramos具有90%和83%的结合率,而非修饰脂质体和BSA修饰脂质体对照与两种细胞的结合率均低于5%.然而anti-CD20修饰脂质体同非修饰脂质体和BSA修饰脂质体一样与CD20-的CHO细胞结合率均低于5%,结合实验说明anti-CD20修饰使脂质体其具有了与CD20+细胞的超强的靶向性特异性和超高的亲和力,这就为脂质体特异性递药到肿瘤组织提供了保证.
体外杀伤实验表明在相同长春新碱给药浓度的情况下,长春新碱免疫脂质体(CLPV)比BSA修饰长春新碱脂质体(NCLPV)和游离长春新碱(VCR)对CD20+细胞Raji细胞和Ramos的24 h和48 h杀伤能力都更强,杀伤效率提高10-25%左右.IC50计算得到CLPV的对Raji和Ramos细胞的24 h,48 h杀伤的IC50值都是NCLPV和VCR50%以下,预示着临床上可以显著降低给药剂量,进一步降低药物毒性.以上实验表明Anti-CD20 Fab’通过提高长春新碱脂质体对CD20+的靶向特异性和结合效率赋予了长春新碱脂质体良好的体外抗肿瘤细胞的活性.
