下调GPC-3转录经Wnt/β-catenin通路对肝细胞癌生长的抑制作用
2019-09-17沈水杰姚登福
姚 敏, 沈水杰, 陈 洁, 陈 颖, 王 理, 姚登福
1.南通大学医学院免疫学系,江苏 南通 226001; 2.南通大学附属医院临床医学研究中心
肝细胞癌(hepatocellular carcinoma,HCC)仍是我国最常见恶性肿瘤之一[1]。因HCC患者早期无明显症状,早期诊断困难,手术切除和肝移植为主要治疗方法;HCC术后易复发,且对放、化疗不敏感,预后差[2]。尽管索拉非尼为HCC非手术患者提供新的方法,但其作用有限,因此寻找更有效的治疗方法已成为肝癌诊治亟待解决的难题。肝细胞恶性转化过程中涉及染色体畸变、基因突变、表观遗传学改变和多种信号通路调节异常[3-4]。临床研究显示,磷脂酰肌醇蛋白多糖-3(glypican-3,GPC-3),在HCC组织中高表达,有助于HCC特异诊断及患者预后分析[5-6]。GPC-3通过糖基磷脂酰肌醇锚定于细胞膜表面,位于Wnt/β-catenin通路上游,在HCC进展过程中与肝细胞恶性转化密切相关,但其调控机制仍有待阐明。本文以特异性miRNA下调HCC细胞GPC-3表达,观察对Wnt/β-catenin通路信号分子的影响,以论证对HCC生长的抑制作用。
1 材料与方法
1.1 对象
1.1.1 体外研究:人HCC HepG2、Hep3B细胞株购自中科院上海细胞所,设空白对照组(untreated组)、阴性对照组(neg-miRNA组)和干预组(miRNA组)。
1.1.2 体内研究:18只BALB/c裸鼠由南通大学实验动物中心提供,鼠龄4~6周,体质量18~20 g,雌雄各半,随机分为空白对照组(untreated组)、阴性对照组(neg-miRNA组)和干预组(miRNA组),每组6只,于SPF(specific-pathogen free)条件下饲养。
1.2 方法
1.2.1 GPC-3-miRNA设计与质粒构建:根据GPC3(Gene ID:2719)转录本序列,以Invitrogen miRNA软件设计特异miRNA寡聚DNA(5′-TGCTGTGAATTAGTTCCCTTCTTCGGGTTTTGGCCACTGACTGACCCGAAGAAG
AACTAATTCA-3′和5′-CCTGTGAATTAGTTCTTCTTCGG
GTCAGTCAGTGGCCAAAACCCGAAGAAGGGAACTAAT
TCAC-3′)及阴性对照DNA(5′-TGCTGAAATGTACTGCGCGTGGAGACGTTTTGGCCACTGACTGACGTCTCCA
CGCAGTACATTT-3′和5′-CCTGAAATGTACTGCGTGGAGACGTCAGTCAGTGGCCAAAACGTCTCCACGCGCAG
TACATTTC-3′)(http://rnaidesigner.thermofisher.com/rnaiexpress/)。以双蒸水溶解成100 μmol/L,与互补单链和10×退火缓冲液混匀,于95 ℃ 5 min形成双链DNA并稀释成10 nmol/L溶液;取4 μl,加入pcDNATM6.2-GW/EmGFP-miR 2 μl,5×连接缓冲液4 μl,T4 DNA连接酶1 μl,双蒸水至20 μl,室温30 min。
1.2.2 转化质粒与电泳:100 μl DH5α感受态细菌加50 ng质粒,置冰上35 min,42 ℃水浴90 s后置冰上30 min,加600 μl LB液体培养基(5 g酵母,10 g蛋白胨,10 g氯化钠,900 ml双蒸水溶解后加至1 000 ml),37 ℃,220 r/min× 1 h,5 000 r/min×3 min,弃上清。吸取菌液涂LB平板(含奇霉素50 μg/ml和不含2种),37 ℃ 1 h,待无液体流动后倒置过夜,平板上长出单菌落为转化成功。按Omega产品说明书抽提质粒;将质粒纯化柱置于1.5 ml离心管内,加入60 μl洗脱液,静置1 min,10 000×g5 min收集质粒。以1.5%琼脂糖胶TAE缓冲液电泳鉴定,以DNA Ladder作DNA分子量标准,在320 nm观察并摄像。
1.2.3 细胞培养和转染:常规细胞培养,待细胞融合度>80%时消化、传代。弃培养液PBS洗涤加含EDTA胰酶消化,当细胞变圆、胞质回缩及间隙增大时弃胰酶,加完培重悬细胞,传代,计数细胞数,以台盼蓝着色鉴别死/活细胞。细胞活力(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。95%以上时依据说明书行转染,转染前24 h,6孔板每孔种入50×104细胞,使转染时细胞密度达到70%,转染前60 min换新鲜完培。100 μl DMEM中加入2 μg质粒配制成A液,100 μl DMEM中加入6 μl转染试剂配制成B液,将B液中加入A液,滴入6孔板,培养,转染48 h后于倒置荧光显微镜下观察转染效率,取细胞备用。
1.2.4 总RNA抽提及定量:按试剂说明制备细胞总RNA,计算总RNA浓度。预冷离心管内加1 μl总RNA (1 μg/μl)、1 μl随机引物(50 μmol/L Oligo)及1 μl 10 mmol/L dNTP mix,DEPC水定容至10 μl,65 ℃水浴5 min,立即置冰上2 min;依次加入2 μl 10×RT butter、4 μl 25 mmol/L Mg2+、2 μl 0.1 mol/L dTT、1 μl RNaseout (40 U/μl)及1 μl SuperScript Ⅲ RT(200 U/μl),终体积为20 μl;50 ℃水浴50 min,85 ℃水浴5 min,立即置冰上2 min;加1 μl RNase H,37 ℃ 20 min得GPC-3-cDNA。
1.2.5 PCR引物及FQ-PCR扩增:GPC-3及磷酸甘油醛脱氢酶(GAPDH)引物由Invitrogen公司合成。GPC-3正向引物5′-TACCCAAGCCTGACTCCACA-3′和GPC-3反向引物5′-CATCAGTCCCTGGCAGTAAGAG-3′;GAPDH引物序列为5′-GAAGGTCGGAGTCAACGGATT-3′和5′-CGCTCCTGGAAGATGGTGAT-3′。以cDNA为模板用SYBR染料法进行FQ-PCR。10 μmol/L引物各0.5 μl,cDNA 1.2 μl,SYBR (50×) 0.5 μl, ddH2O加至25 μl;95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火30 s,70 ℃延伸45 s,循环40次,85 ℃溶解。根据相对定量法计算(n=3):干扰效率=1-2-△△Ct(△Ct=CtGPC-3-CtGAPDH, △△Ct = △Ct样本-△Ct空白)。
1.2.6 免疫印迹分析:依据说明书抽提细胞总蛋白,以BCA法测定浓度。制备10%SDS聚丙烯酰胺凝胶,50 μg待测蛋白加5×SDS上样缓冲液,沸水5 min后上样,恒压60 V×40 min后110 V×60 min,转膜,漂洗,质量浓度为50 g/L脱脂牛奶封闭。加兔抗人β-catenin(1∶500)或p-GSK3β(1∶500)或Cyclin D1(1∶500)或鼠抗人GPC-3(1∶250),β-actin抗体(1∶1 000)作为内参,4 ℃过夜,洗涤,辣根过氧化物酶标记的羊抗兔及羊抗鼠IgG二抗(1∶1 000)37 ℃ 1 h,洗涤后ECL显色并拍照。
1.2.7 CCK-8法分析:细胞瞬时转染48 h后,分别接种于96孔板(n=3),每组含调零、空白、阴性及干扰孔,分别于规定时间点添加CCK-8试剂10 μl,继续培养4 h,脱色摇床1 min后于酶标仪检测A450值。
1.2.8 克隆形成分析:细胞瞬时转染48 h后,分别接种于6孔板(n=3),每3 d换液,37 ℃培养14 d;吸弃培养液,PBS洗涤1次,预冷75%乙醇固定15 min,0.1%结晶紫染色10 min,PBS洗涤3次,拍照,Quantity One软件克隆计数。
1.2.9 细胞周期分析:依据试剂说明书操作。转染48 h后,换新鲜完培继续培养24 h,收集(5~10)×105细胞,于70%预冷乙醇-20 ℃固定过夜,预冷PBS洗涤沉淀,加0.5 ml碘化丙啶染色,37 ℃避光温浴30 min,随后4 ℃或冰浴避光存放;用流式细胞仪在488 nm波长处检测红色荧光,数据由Beckman Coulter公司Multicycle软件收集、存储和分析。
1.2.10 裸鼠移植瘤模型:细胞培养、转染及筛选人HCC HepG2细胞以质量浓度为100 g/L胎牛血清的DMEM培养基,于37 ℃、体积分数为5%的CO2培养箱中贴壁培养,待细胞融合度>80%时传代。细胞密度达到70%时,利用GenjetTM转染试剂将neg-miRNA、GPC-3-miRNA分别转染至阴性组及干预组HepG2细胞中,经杀稻瘟菌素筛选,得稳定转染细胞克隆。收集对数期生长细胞,以2×107/只(0.2 ml/只)接种于裸鼠右肩胛部皮下,形成直径4 mm左右皮下隆起。
1.2.11 肿瘤生长曲线测绘:接种后观察裸鼠生存状况、注射部位有无感染和破溃、肿瘤生长自然消退并记录每组肿瘤长出时间。肿瘤出现后,用游标卡尺测量长、短径,肿瘤体积V(mm3)= 0.5×a×b2(a=长径,b=短径),并根据体积均数值绘制生长曲线。于接种后35 d用颈椎脱臼法处死裸鼠,大体观察移植瘤的生长状况及周围脏器受累情况。剥离肿瘤生理盐水冲洗、擦干,拍照。浸入4%多聚甲醛固定,备用。
1.2.12 免疫组织化学分析:常规脱蜡,水化,双氧水阻断内源性过氧化物酶,高压加热法修复抗原,动物血清封闭非特异性结合。加GPC-3、β-catenin、p-GSK3β及Cyclin D1抗体,4 ℃过夜,PBS漂洗;滴加生物素标记二抗,孵育10 min,PBS漂洗;加链霉素抗生物素-过氧化酶,孵育10 min,PBS漂洗;加新鲜配制四盐酸二氨基联苯胺溶液,显色,水洗,苏木素复染,无水乙醇脱水透明、封片。Olympus公司BX50光学显微镜观察、摄像;以0.01 mol/L PBS(pH=7.5)替代一抗、二抗作阴性对照。阳性细胞百分数即5个视野阳性细胞平均数:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。

2 结果
2.1 HCC细胞miRNA转染效率分析将特异GPC-3-miRNA转染HepG2和Hep3B细胞(见图1),用于体内、外研究。EmGFP标记GPC-3-miRNA质粒,分别转染HCC HepG2和Hep3B细胞,转染后24 h于倒置荧光显微镜下观察,成功转染细胞呈绿色荧光,随机5个视野细胞计算转染效率,显示HepG2细胞为82%,Hep3B细胞为86%。
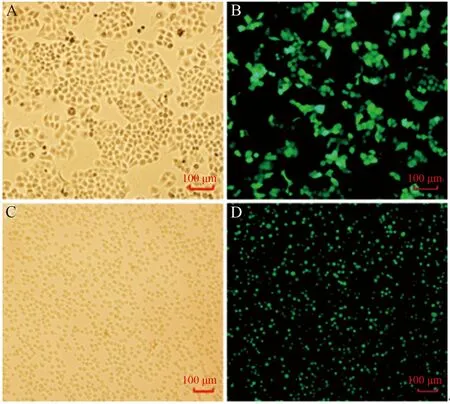
注:A、C:普通光;B、D:荧光。放大倍数为100倍。
2.2 干预GPC-3抑制癌细胞增殖转染GPC-3-miRNA干扰质粒48 h后HepG2及Hep3B细胞抑制GPC-3的表达对HCC细胞生长的影响(见图2)。转染24 h、48 h、72 h检测细胞生长情况,与对照组(untreated 组和neg-miRNA组)相比,GPC-3-miRNA转染HepG2和Hep3B细胞后明显抑制HepG2及Hep3B细胞生长,呈时间依赖性。与对照组(untreated组和neg-miRNA组)相比,miRNA组平板克隆能力明显降低[HCC HepG2组(t=24.50,P<0.01)vsHCC Hep3B组(t=11.90,P<0.01)];与对照组相比,均显示转染miRNA后HCC细胞克隆形成能力明显降低[HepG2细胞(t=8.462,P<0.01)vsHep3B细胞(t=7.311,P<0.05)]。
2.3 干预GPC-3影响癌细胞增殖周期HCC细胞转染GPC-3-miRNA后流式细胞仪分析DNA含量分布见表1,HCC HepG2和Hep3B细胞与对照组(untreated组和neg-miRNA组)相比,干预组G1期细胞明显增多,G2和S期细胞明显减少,HCC增殖周期发生G1期阻滞。
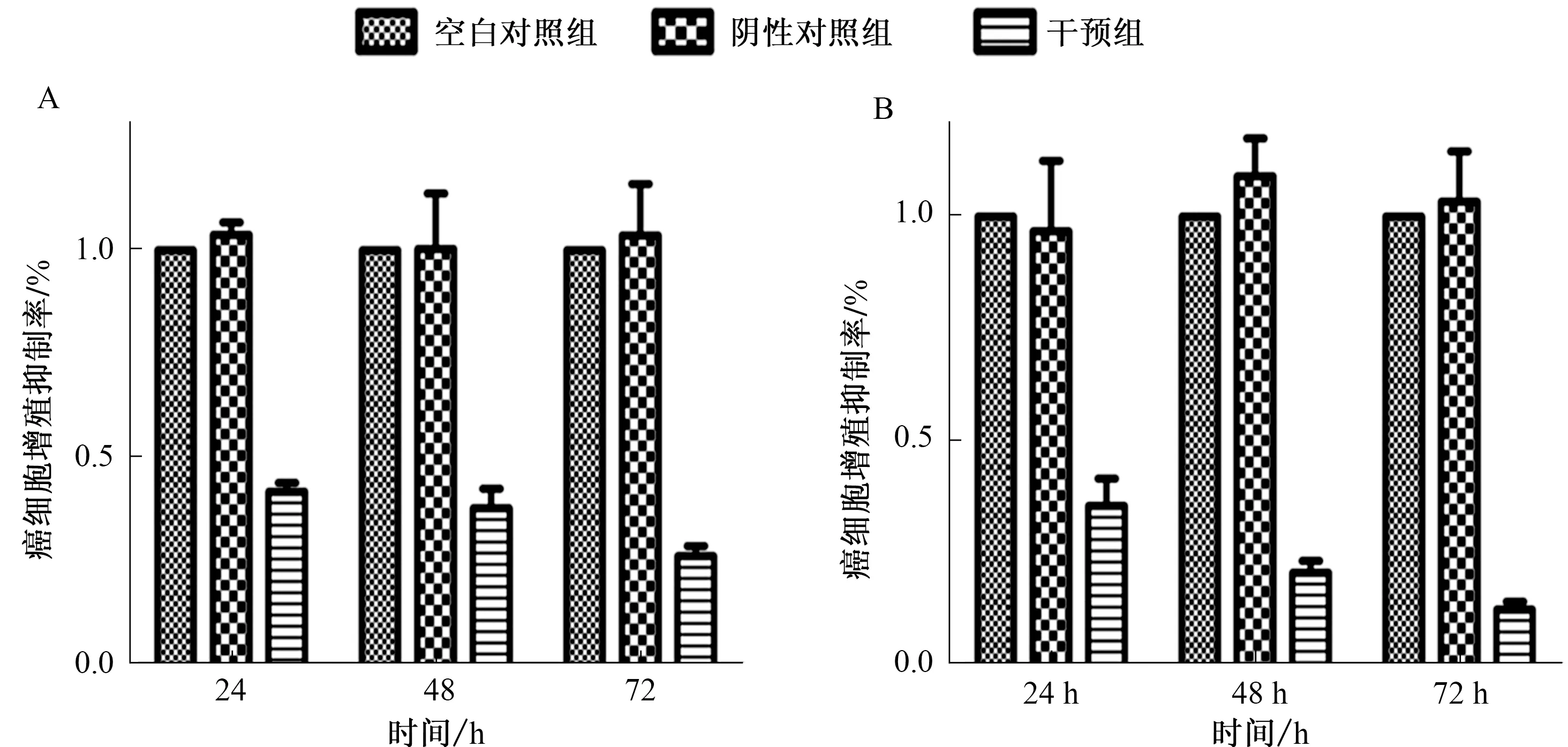
图2 下调GPC-3对HCC细胞生长的影响 A:HepG2细胞;B:Hep3B细胞Fig 2 Effect of GPC-3 reduction on the growth of HCC cells A: HepG2 cells; B: Hep3B cells
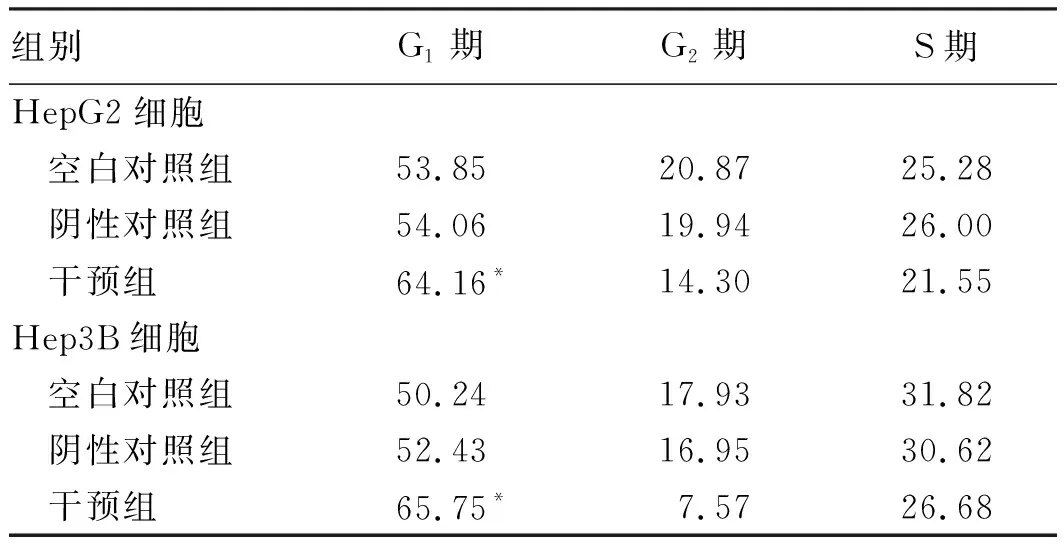
表1 特异miRNA干预GPC-3基因影响细胞周期Tab 1 Specific miRNA intervention in GPC-3 gene affected cell cycle %
注:与空白对照组比较,*P<0.01。
2.4 下调GPC-3 显著影响Wnt/β-catenin通路信号分子沉默HepG2及Hep3B细胞GPC-3影响Wnt通路信号表达。GPC-3 miRNA分别转染于HepG2(见图3A~3B)及Hep3B(见图3C~3D)细胞,Western blotting分别检测GPC-3、β-catenin和p-GSK3β表达,以及信号蛋白与β-actin的相对比率,可见在GPC-3过表达的HepG2及Hep3B细胞中,空白对照组和阴性对照组中未见明显改变(P>0.05),而在干预GPC-3后HCC细胞Wnt通路中关键信号分子β-catenin、p-GSK3β表达水平均明显降低(P<0.01)。
2.5 干预GPC-3经Wnt/β-catenin通路影响裸鼠荷瘤生长沉默GPC-3经Wnt/β-catenin通路对裸鼠荷瘤生长的影响(见图4)。裸鼠皮下肿瘤形成(11.17±0.98)d比阴性对照组(5.5±0.55)d、空白对照组(5.33±0.52)d潜伏期延长,肿瘤形成明显延迟(P<0.01)。GPC-3-miRNA组瘤体积为(65.48±13.66)mm3明显小于对照组(空白对照组和阴性对照组),空白对照组和阴性对照组分别为(404.83±52.63)mm3、(365.67±14.47)mm3,干预组与对照组(空白对照组和阴性对照组)相比,差异有统计学意义(P<0.01,见图4A)。对照组(空白对照组和阴性对照组)瘤体较大、胞浆丰富、核/浆比大、染色深、有丝分裂多见、细胞丰富,排列紊乱,呈巢状,胞膜多不完整;而干扰组肿瘤分界相对较清,排列呈条索状,板状,偶可见细胞核与浆固缩坏死样改变,胞膜较完整且明显。免疫组化(见图4B)检测miRNA组瘤内GPC-3、β-catenin、p-GSK3β和cyclin D1表达均明显减少,与对照组(空白对照组和阴性对照组)比较,差异有统计学意义[GPC-3(t=6.67,P<0.01)、β-catenin(t=9.61,P<0.01)、p-GSK3β (t=4.81,P<0.01)、cyclin D1(t=5.90,P<0.01)]。
3 讨论
肝癌的有效治疗仍为亟待解决的医学难题。HCC中GPC-3过表达,为肝癌诊断具有特异性[5,7-8]的分子标志物[9-10],然而GPC-3表达与Wnt/β-catenin通路的关系尚不清楚[5]。本文以miRNA特异性抑制HepG2及Hep3B细胞GPC-3表达,探讨干预GPC-3表达癌细胞生物学行为的影响。miRNA成功转染后,癌细胞GPC-3降低、生长明显受抑,呈时间依赖性;平板克隆形成数减少;干预组G2期和S期细胞减少,癌细胞增殖周期发生G1期阻滞;下调β-catenin和p-GSK3β表达[11-12],提示位于Wnt/β-catenin通路上游GPC-3,可调控该通路信号分子,在HCC进展中起关键作用。
细胞膜表面GPC-3与Wnt/β-catenin等多条信号通路关系密切[13],以调节自分泌/旁分泌的经典Wnt/β-catenin信号通路刺激HCC细胞生长,其过表达可使细胞结合Wnt能力增强。HCC组织硫酸酯酶-2(Sulfatase-2,SULF-2)过表达可诱导GPC-3表达,促进GPC-3与成纤维生长因子-2结合刺激细胞生长,提高Wnt3a及稳定β-catenin表达,参与磷脂酰蛋白聚糖-Wnt/生长因子复合物组成[14];Wnts与GPC-3的硫酸类肝素链(heparan sulfate,HS)结合形成磷脂酰蛋白聚糖-Wnt/生长因子复合物,在SULF-2作用下Wnts从HS上释放,与Frizzled受体结合激活Wnt/Frizzled下游区域的信号传导,使GSK3β磷酸化,p-GSK3β使降解β-catenin的复合物分解,胞质β-catenin聚集并向胞核移动,使核Tcf/Lef转录增强,上调相关靶基因如Cyclin D1,促进HCC细胞增殖[15],被裸鼠模型证实。
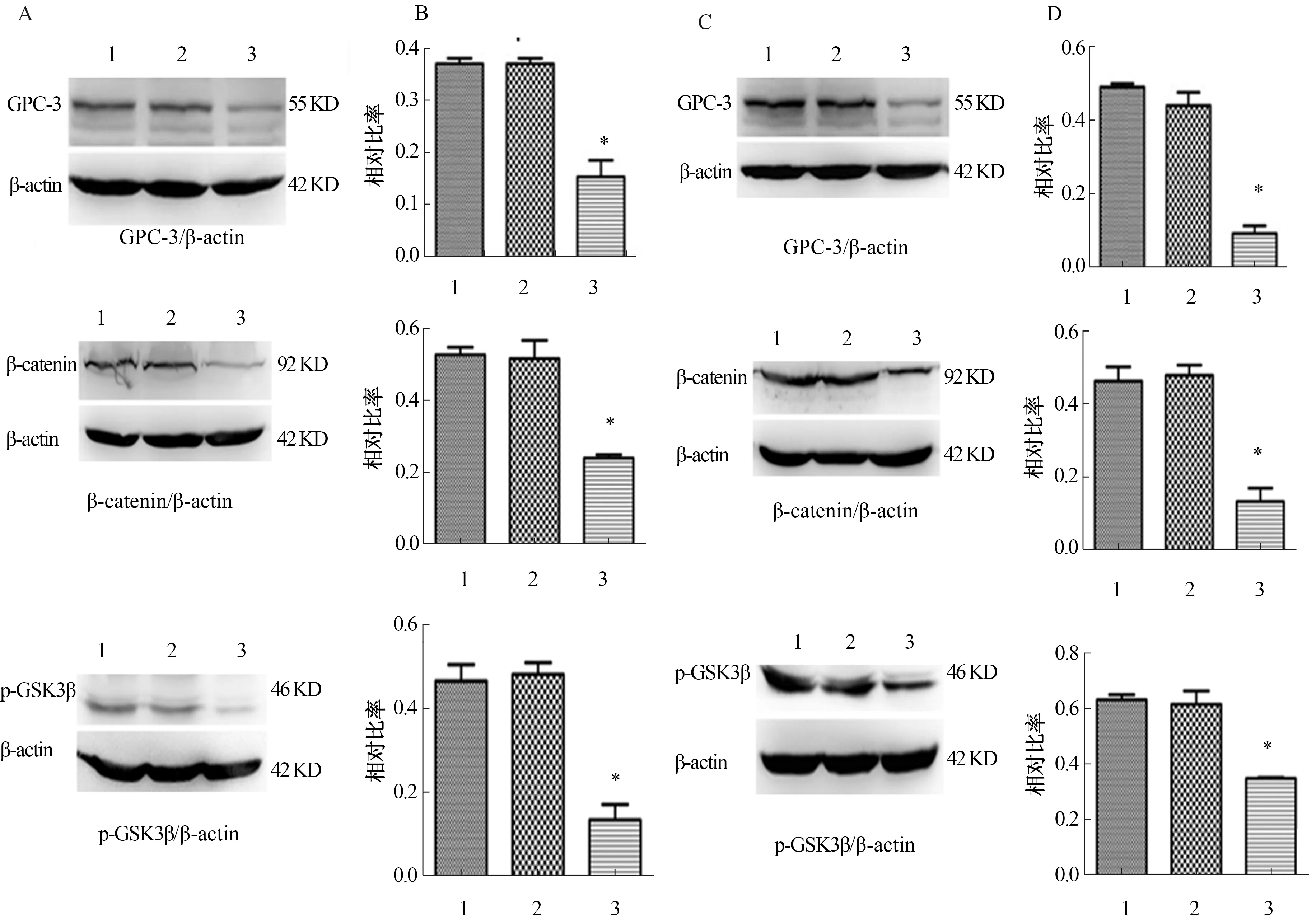
注:1:空白对照组;2.阴性对照组;3.干预组;与空白对照组比较,*P<0.01。
图3 沉默GPC-3影响Wnt/β-catenin通路信号分子A:HepG2细胞GPC-3、β-catenin和p-GSK3β免疫印迹分析;B:对应蛋白与
β-actin的Quantity One (Bio-Rad)灰度值;C:Hep3B细胞GPC-3、β-catenin和p-GSK3β免疫印迹分析;D:对应蛋白与β-actin的Quantity One (Bio-Rad)灰度值
Fig 3 Silence GPC-3 affects Wnt/β-catenin pathway signal moleculesA: analysis of immune imprints of HepG2 cells GPC-3, β-catenin and p-GSK3; B: corresponding protein and β-action Quanticity One (Bio-Rad) gray value; C: analysis of immunoimprinting of Hep3B cells GPC-3, β-catenin and p-GSK3; D: corresponding protein and β-action Quanticity One (Bio-Rad) gray value

注:1、2:空白对照组;3、4:阴性对照组;5、6:干预组。
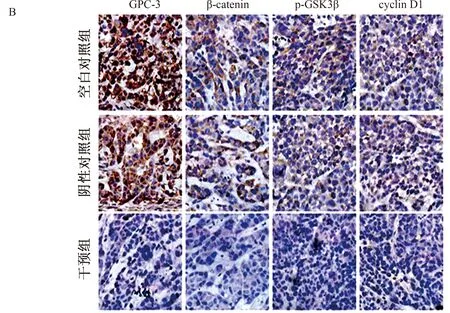
注:SP,放大倍数为100倍。
沉默GPC-3后HepG2细胞在裸鼠皮下成瘤能力明显降低,干预GPC-3抑制HepG2细胞在裸鼠体内的增殖能力。检测瘤组织Wnt通路关键信号分子p-GSK3β及下游β-catenin和Cyclin D1表达,显示沉默GPC-3后几种信号蛋白表达均减少。与体外研究结果一致[16]。推测GPC-3可能通过磷酸化抑制GSK3β使胞质p-GSK3β升高,p-GSK3β抑制β-catenin降解,β-catenin在胞质蓄积与转录因子LEF-1结合入核,上调下游靶基因Cyclin D1,促进细胞周期进程,刺激HCC细胞增殖[13]。推论干预GPC-3基因转录或抗-GPC-3[17-18],均可影响Wnt/β-catenin通路关键信号分子表达,展示了GPC-3活化促进肝癌细胞增殖的分子机制。
综上所述,靶向干预GPC-3基因转录经Wnt/β-catenin通路抑制肝癌细胞增殖和HCC生长,提示GPC-3为HCC治疗潜在的有效靶目标。
