抗肿瘤工程菌Escherichia coli Nissle 1917发酵培养基优化及微胶囊制备
2019-09-16吴柳娟莫相涛胡益波丁学知夏立秋
吴柳娟, 李 躺, 莫相涛, 胡益波, 丁学知, 夏立秋
(湖南师范大学 生命科学学院,湖南 长沙 410081)
大肠埃希菌EscherichiacoliNissle 1917(EcN)是革兰阴性菌,从一次志贺菌痢病蔓延时一名没有出现腹泻的士兵粪便中分离得到,基本上没有致病性,是目前广泛应用的一种基因载体益生菌[1]。Stritzker等[2]研究了几种肠道细菌对肿瘤的靶向性,发现EcN能够在免疫正常和免疫缺失的小鼠移植瘤部位聚集,而在其他组织、器官的EcN不会长期停留,说明EcN是一种具有较高抗肿瘤靶向性的细菌,为EcN应用于抗肿瘤靶向治疗奠定了基础。已有文献报道对EcN进行遗传改造,使其分泌表达能使肿瘤细胞发生凋亡的天青蛋白(Azurin)。通过静脉注射的方式治疗乳腺癌、黑色素瘤和人结肠癌的荷瘤小鼠,取得了很好的治疗效果[3-4]。随着研究的不断深入和广泛的应用开发,抗肿瘤靶向工程菌将为人类健康发挥越来越重要的作用[5]。但是,目前在应用层面上提高抗肿瘤靶向工程菌的治疗效果有待进行两个方面的研究:一是如何通过有效的方法快速优化工程菌发酵条件,提高菌体发酵产量,促进合成抗肿瘤蛋白;二是在制剂方面如何保藏大量活性菌体,延长有效抗肿瘤时间。目前,在培养基优化中除了普遍使用的正交设计和响应曲面设计外,利用BP人工神经网络(BP Artificial neural networks, ANN)结合遗传算法(Genetic algorithm, GA)优化发酵培养基是目前热门的研究方法之一[6-7]。BP人工神经网络是以自变量为输入,目标值为输出,构建人工神经网络模型。在模型的模拟过程中,取培养基优化中几组数据作为训练和验证数据,BP人工神经网络的误差函数作为遗传算法的适应度函数,对BP人工神经网络的权值和阈值进行优化,再以优化的BP人工神经网络作为循环算法的函数进行循环寻优。本研究采用BP人工神经网络结合遗传算法优化发酵培养基组分,期望提高靶向工程菌EcNA的菌体生物量。大量的研究表明该优化方法取得了很好的结果。如Nagata等[8]利用中心组合设计的30组试验数据为训练数据和验证数据,建立BP人工神经网络模型,然后利用遗传算法全局寻优。结果显示,该组合优化比响应面的二次多项式模型拟合和预测能力要好。近年来已有研究表明将活菌制备成微胶囊的可行性。如罗佳琦[9]用阿拉伯胶与麦芽糊精作为壁材包埋嗜酸乳杆菌,通过喷雾干燥的方法固化微胶囊,经参数优化后益生菌存活率最高可达 63%。本研究采用海藻酸钠和壳聚糖复合包埋EcNA制成活菌微胶囊,期望提高菌体稳定性。益生菌从加工、储藏、运输乃至进入人体后经过胃部到达肠道的过程中,需经受一系列低酸、高胆盐环境的影响,导致到达肠道的活菌数大量减少,从而限制了益生菌功能的发挥。研究表明微胶囊包埋技术不但可以增强益生菌对温度、pH、光线、氧气等外界不良环境的抵抗能力,还能显著提高益生菌在胃肠道低酸和高胆盐环境中的存活率[10-11],为临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 大肠埃希菌Nissle 1917工程菌株(CCTCM2010313),为本实验室构建表达抗肿瘤蛋白Azurin的工程菌[12],由本实验室保存。
1.1.2 培养基(g/L) LB培养基:胰蛋白胨10,酵母提取物5,氯化钠10,pH调为7.0;LB固体培养基:每升LB培养基中添加琼脂15 g;发酵初始培养基:蛋白胨12,酵母粉24,甘油5,K2HPO416.43,KH2PO42.3[13]。
1.1.3 试剂与仪器 NaCl、K2HPO4、KH2PO4、CaCl2、甘油:分析纯;壳聚糖:化学试剂;海藻酸钠:化学纯,上海国药化学试剂有限公司;玉米浆:分析纯,上海源叶生物有限公司;胰蛋白胨、酵母粉、琼脂粉、蛋白胨:分析纯,英国OXOID公司。冷场电子扫描显微镜(Hitachi Su801000,日本日立公司);分光光度计(SmartspecTM3000,美国BIO-RAD 公司);培养振荡器(INNOVATM4900,美国NBS公司)。
1.2 方法
1.2.1 种子复壮 从-80 ℃超低温冰箱中取出菌种保藏液10 μL,涂布到含有氯霉素和卡那霉素的LB平板,37 ℃恒温培养箱培养24 h。
1.2.2 种子培养 从LB平板上挑取单菌落接种于20 mL LB液体培养基中,37 ℃、160 r/min震荡培养12 h。
1.2.3 摇瓶发酵 将种子液以3%接种量接入20 mL发酵初始培养基中,37 ℃、120 r/min培养18 h。
1.2.4 活菌微胶囊的制备 将EcNA新鲜菌体用0.9% NaCl洗涤3次,加入适量的0.035 g/mL海藻酸钠溶液,200 r/min磁力搅拌40 min,加入适量的0.012 g/mL壳聚糖溶液(用1%冰醋酸溶解),用1 mL无菌注射器将海藻酸钠-壳聚糖混合液匀速滴加到0.1 g/mL CaCl2溶液中,静置固化,放入4 ℃冰箱备用[14]。
1.2.5 微胶囊形态观察 ①微胶囊的基本形态观察:固化后的湿微胶囊放在干净透明的平板内,然后拍照。②冷场电子显微镜观察微胶囊的超微结构:在样品台上贴上黑色的双面胶,将洗涤后微胶囊滴加到双面胶上并自然风干,在样品上镀金进行SEM观察。
1.2.6 耐胃酸试验 模拟胃液:取0.1 mol/L稀HCl溶液16.4 mL,加无菌水约800 mL及胃蛋白酶10 g,搅拌均匀后加无菌水定容至1 000 mL,0.22 μm滤膜过滤除菌备用[15-16]。称取1 g微胶囊加入到9 mL模拟胃液中,37 ℃恒温震荡2 h,分别在0、0.5、1.0、1.5、2.0 h取出,7 000 r/min离心8 min,弃上清,收集沉淀物,放入pH为7.4的PBS缓冲溶液中,37 ℃下振荡至完全溶解,进行活菌计数。
1.2.7 肠溶性试验 模拟肠液:称取KH2PO46.8 g,加无菌水500 mL搅拌溶解,称取胰蛋白酶10 g,加适量无菌水溶解,两液混合后搅拌均匀,加无菌水定容至1 000 mL,0.22 μm滤膜过滤除菌备用[15,17]。称取1 g微胶囊加入到9 mL模拟肠液中,37 ℃恒温震荡2 h,分别在1、2、3、4 h取出,以7 000 r/min离心8 min,弃上清,收集沉淀物,放入pH为7.4的PBS缓冲溶液中,37 ℃下振荡至完全崩解,进行活菌计数。
1.2.8 微胶囊存活率的测定 包埋率(%)=(A1/A2)×100%,式中:A1为微胶囊中活菌数(cfu/mL);A2为微胶囊化前总活菌数(cfu/mL)。
1.2.9 实验设计 ①培养基优化单因素试验:以发酵初始培养基为基础,改变甘油的浓度(2.0、3.5、5.0、6.5、8.0 g/L),筛选出甘油的最适添加量;改变蛋白胨、酵母粉两种氮源的配比(4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4)和总添加量(40、60、80、100、120、140、160 g/L),筛选复配氮源的最适配比和最适生长总浓度;玉米浆是玉米制备淀粉过程中的副产物,含有丰富的可溶性蛋白和无机盐等,可作为微生物发酵的生物素来源,广泛应用于微生物发酵生产中[18-19]。为了考察补充玉米浆对EcNA菌体浓度的影响,本研究在发酵培养基中加入不同浓度的玉米浆(0.5、2.5、4.5、6.5、8.5、10.5、12.5 g/L),筛选出最适添加量。②Box-Behnken 试验设计:发酵过程中培养基组分存在一定的交互影响,通过简单的单因素试验很难获得最佳优化配方,由于该初始培养基成分不复杂,考虑到碳源和氮源基质是影响发酵产量的重要因素,而玉米浆的添加能显著影响发酵产量,选取甘油、复配氮源、玉米浆浓度3个因素进行Box-Behnken 试验,综合考察3个因素对EcNA菌体浓度的影响,获得更可靠的试验结论[20]。每个因素选取3个水平,试验设计如表1所示。③BP人工神经网络预测模型的构建:以发酵培养基组分(X1为甘油质量浓度,X2为复配氮源质量浓度,X3为玉米浆质量浓度)作为BP人工神经网络输入,取EcNA菌体浓度Y为输出,构建人工神经网络。在网络的模拟过程中,取Box-Behnken试验数据为训练和验证数据,BP神经网络的误差函数作为遗传算法的适应度函数进行寻优。建模过程在Matlab2015b中进行[21-22]。

表1 Box-Behnken 设计因素水平表
1.2.10 微胶囊制剂正交试验 根据文献[23-24],选择海藻酸钠、壳聚糖、壁芯比和氯化钙4个因素,设计4因素3水平正交试验(表2),以微胶囊包埋率为指标,确定最佳优化条件。
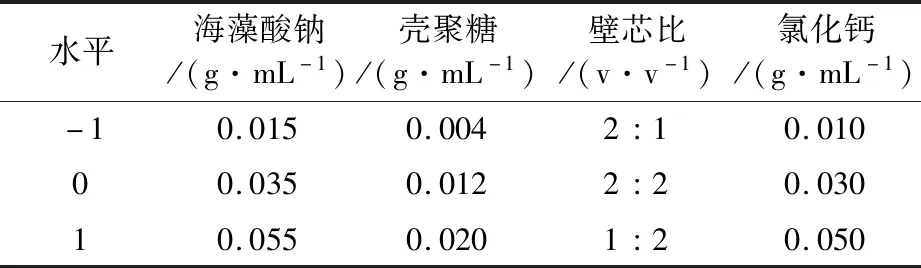
表2 正交试验因素水平
2 结果与分析
2.1 碳源及氮源筛选结果
如图1所示,当甘油添加量大于5 g/L时,菌体生长受到抑制,而小于5 g/L时能促进生长,因此选择5 g/L作为甘油的最适添加量。如图2所示,当V蛋白胨∶V酵母提取物=1∶3时,菌体浓度显著提高,OD600达到8.89。在氮源复配比为1∶3条件下,控制其他条件一致,将氮源总浓度设置浓度梯度,考察氮源总浓度的最适添加量。如图3所示,复配氮源浓度对菌体生长影响较大,当氮源总浓度为120 g/L时(蛋白胨30 g/L,酵母提取物90 g/L),菌体浓度显著提高,且在一定范围内呈浓度梯度依赖性。
2.2 玉米浆补加优化
如图4所示,添加玉米浆能促进菌体生长,在玉米浆质量浓度为8.5 g/L时菌体浓度达到最高,OD600达到10.12。当加入过高浓度的玉米浆,培养基的黏度增大,不利于工程菌的发酵。
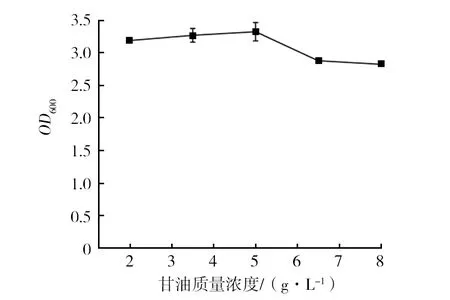
图1 甘油对EcNA菌体浓度的影响Fig.1 Effects of glycerol on concentration of EcNA
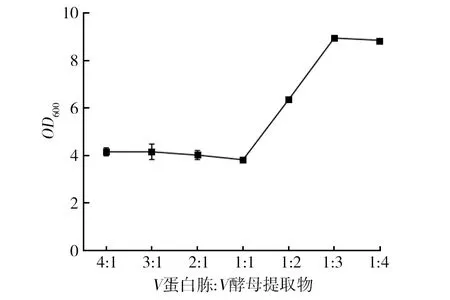
图2 氮源复配比对EcNA菌体浓度的影响Fig.2 Effects of source of nitrogen compound ratio on concentration of EcNA
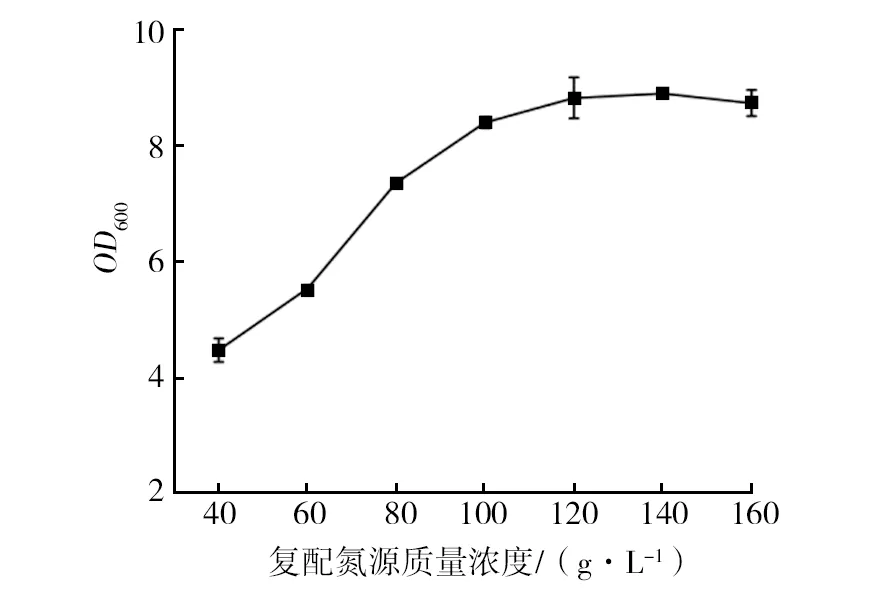
图3 复配氮源对EcNA菌体浓度的影响 Fig.3 Effects of compound source nitrogen on concentration of EcNA
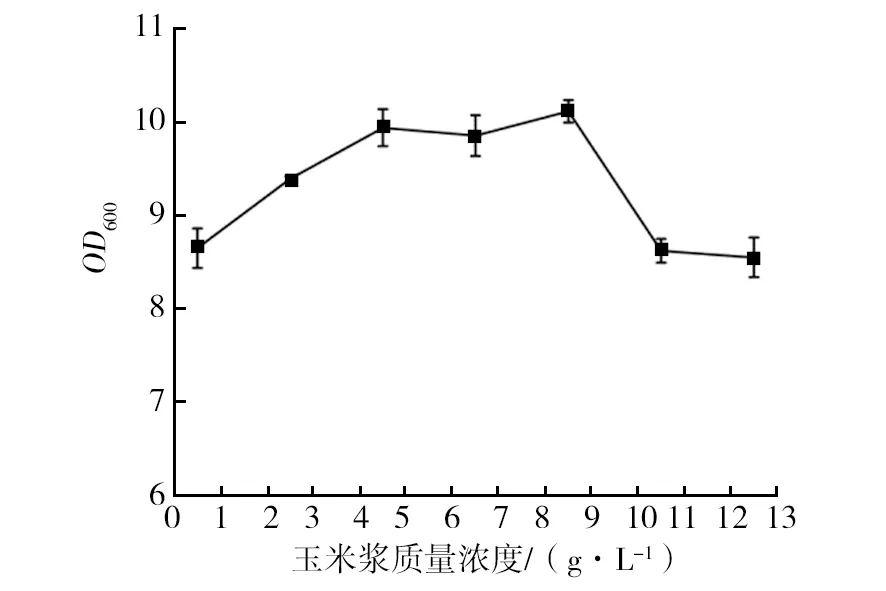
图4 玉米浆对EcNA菌体浓度的影响Fig.4 Effects of corn starch on concentration of EcNA
2.3 Box-Behnken 设计结果及回归分析
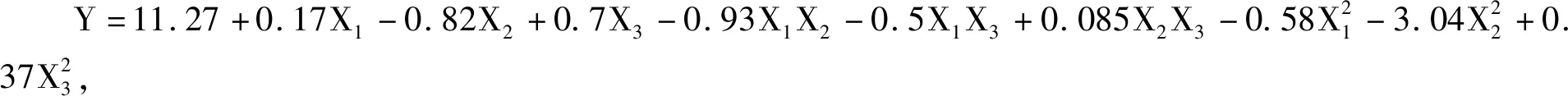
根据回归分析,响应面显著地表示了Y与X1、X2、X3的关系,通过该模型绘制等高线图(图5)和响应面分析图(图6)。图5中两因素作用构成的图形越椭圆,交互作用越强,表明甘油与复配氮源在发酵过程中存在交互作用。如图6所示,当甘油质量浓度在5 g/L不变,复配氮源质量浓度在70~170 g/L时,菌体浓度呈现先升高后降低趋势,说明过高或过低的氮源浓度都不利于菌体生长。
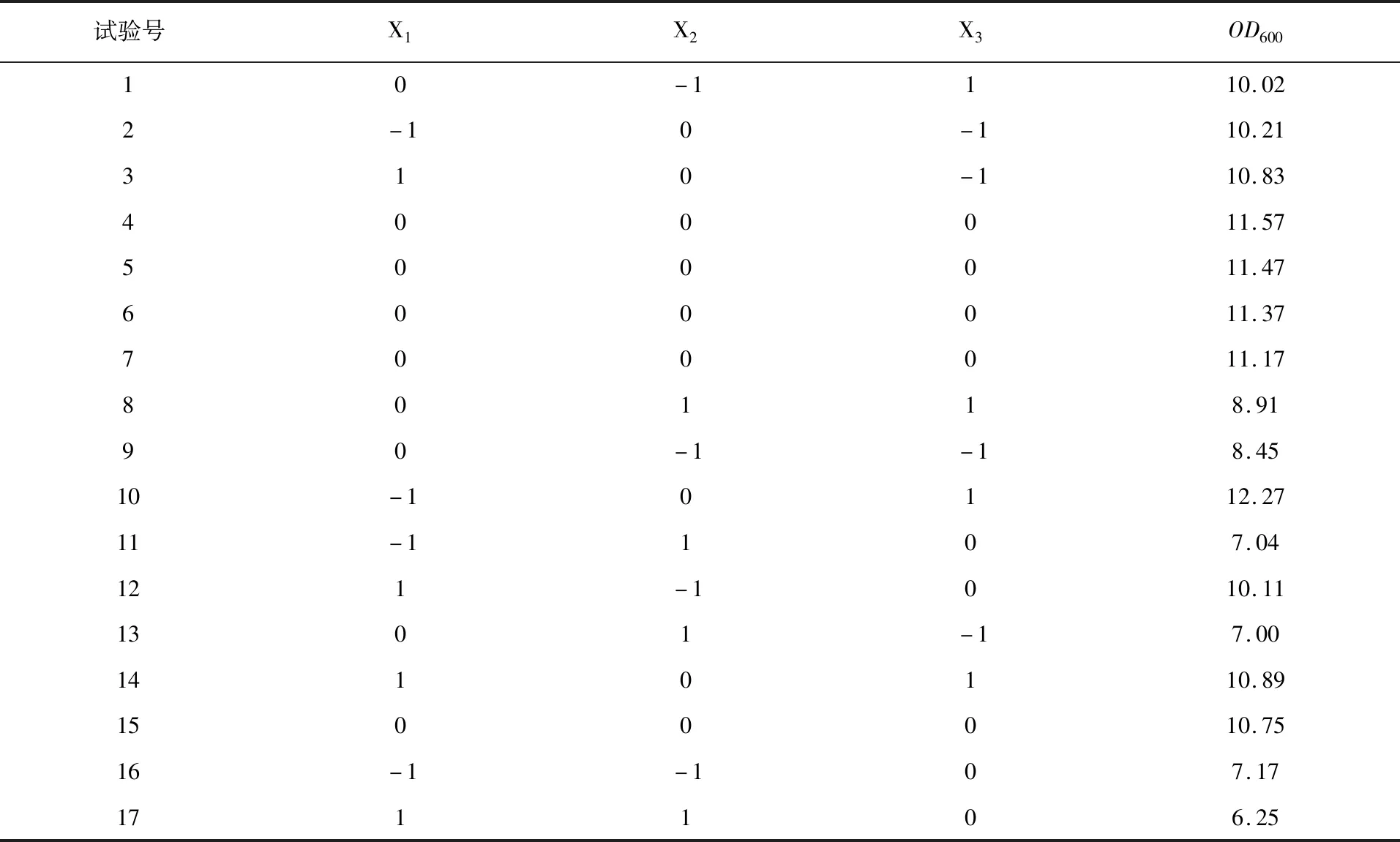
表3 Box-Behnken 设计及结果
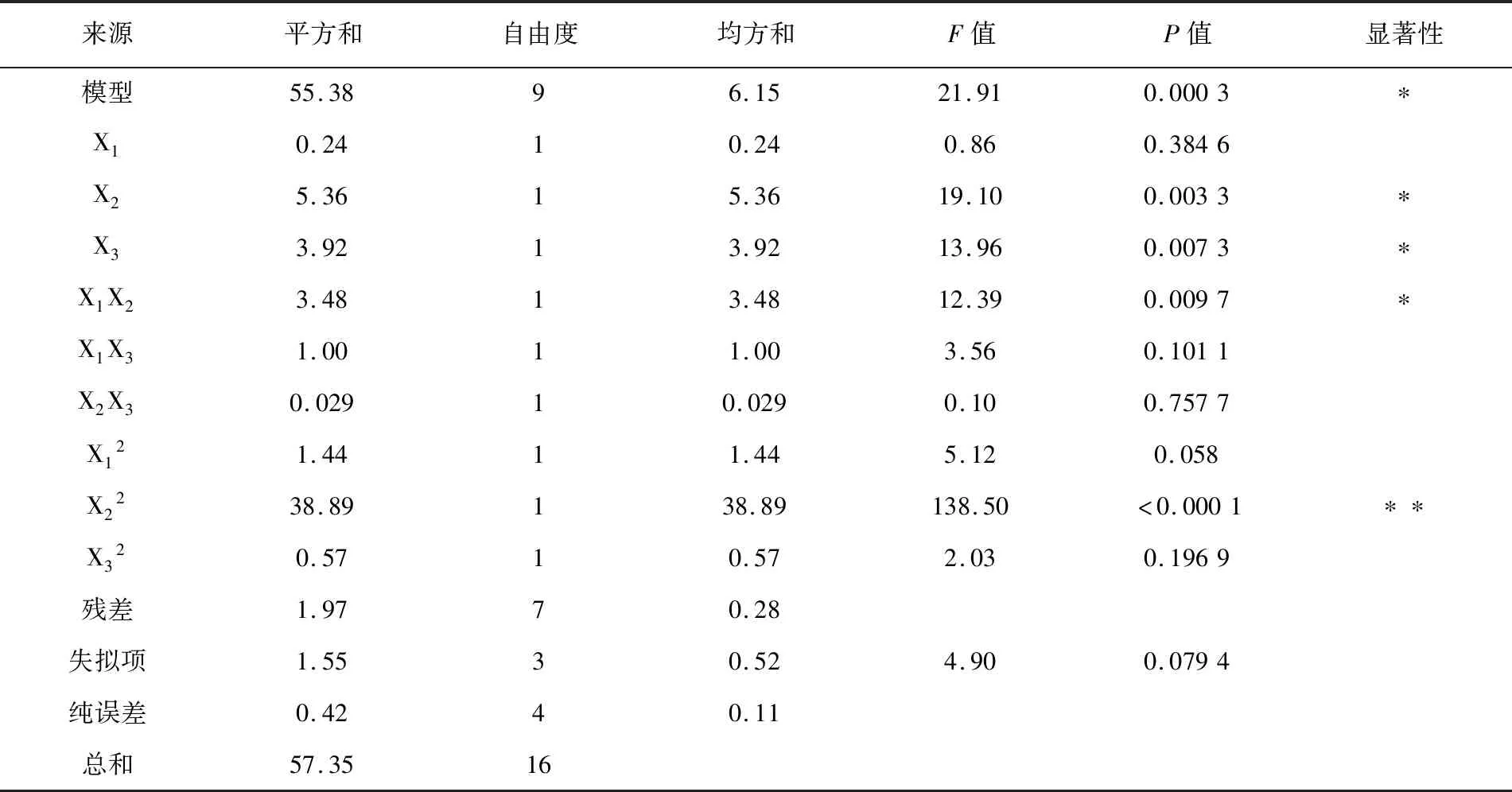
表4 Box-Behnken 试验各因素的回归分析
注:**P<0.01,差异极显著;*P<0.05,差异显著
2.4 BP人工神经网络模型的建立及遗传算法优化结果
为了验证算法的有效性,针对相同Box-Behnken样本数据集,分别用响应面模型(RSM)和BP人工神经网络模型对该样本进行预测,由图7可知,相比响应面模型,经BP神经网络预测的值与实际测定值拟合得更好,表明BP人工神经网络模型对该菌株发酵条件优化将具有更优的预测能力。
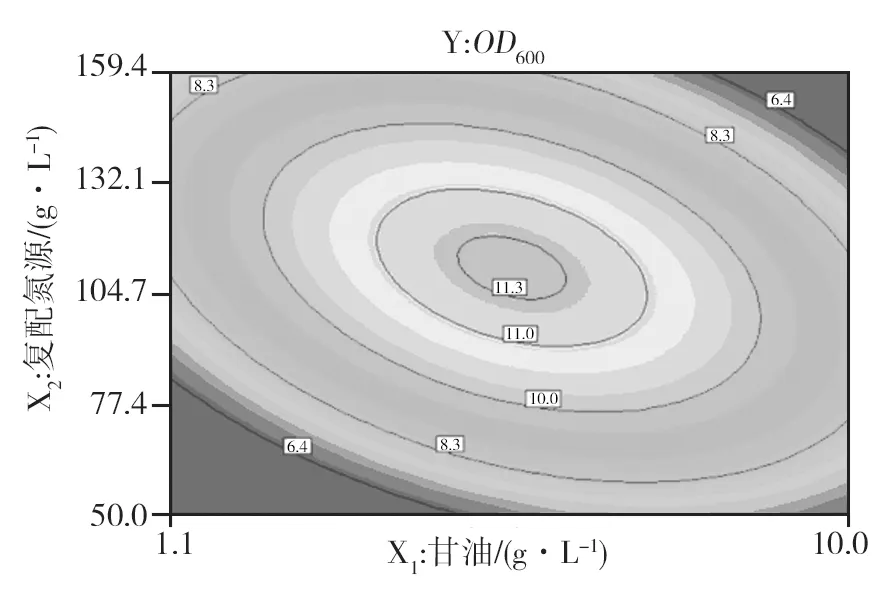
图5 甘油与复配氮源浓度对工程菌EcNA菌体浓度影响的等高线和响应面分析Fig.5 The contour analyze of effects of glycerol and compound source nitrogen on concentration of EcNA
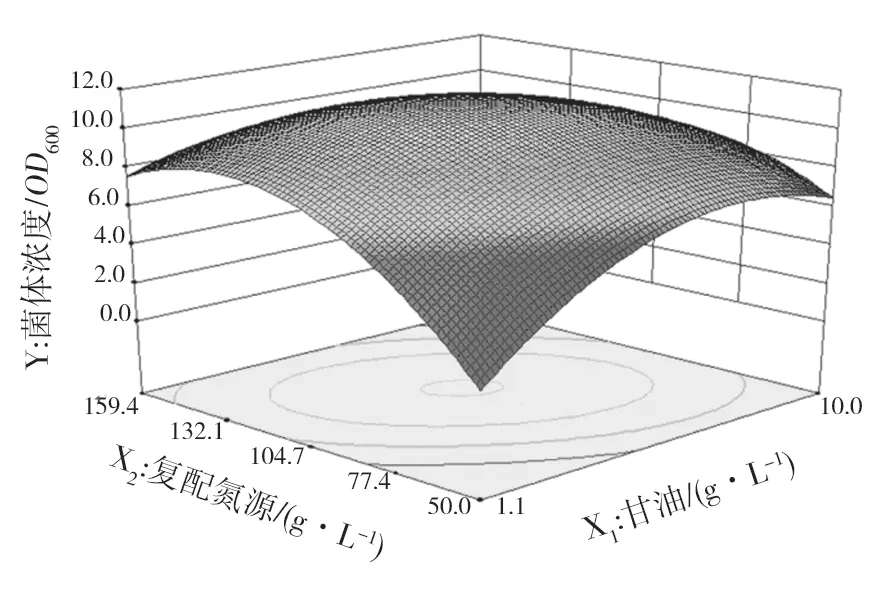
图6 甘油和复配氮源对工程菌EcNA菌体浓度影响的响应面分析Fig.6 Response surface analyze of effects of glycerol and compound source nitrogen on concentration of EcNA
2.5 两种模型的对比
如表5所示,采用BP人工神经网络结合遗传算法预测优化后,预测最大值对应的培养基组分为甘油7 g/L,复配氮源115 g/L,玉米浆10 g/L,经发酵3次验证,工程菌EcNA菌体浓度OD600达到12.92,相比于响应面模型实际验证的最佳生物量高4.95%,说明BP人工神经网络和遗传算法在培养基优化中效果更好。
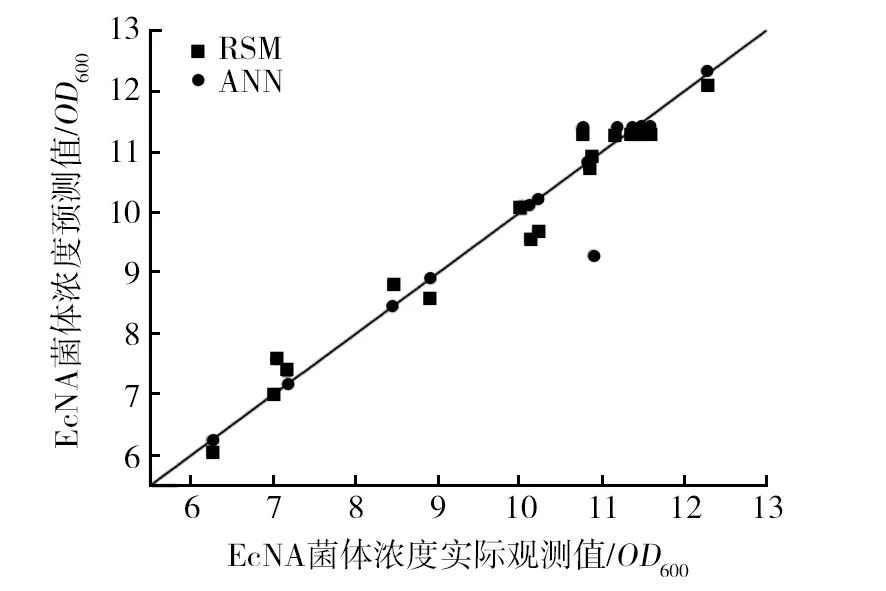
图7 神经网络和响应面预测值和实际观测值分析Fig.7 Predicted by the ANN model and by the RSM model vs. Actual biomass

模型EcNA菌体生物量/OD600甘油/(g·L-1)复配氮源/(g·L-1)玉米浆/(g·L-1)ANN12.92±0.137.00115.0010.00RSM12.31±0.244.55115.7212.44
2.6 工程菌EcNA活菌微胶囊的制备结果分析
2.6.1 EcNA微胶囊正交试验及方差分析 由表6可知,通过对试验结果进行极差分析,各因素影响微胶囊包埋产量的主次顺序为海藻酸钠>壳聚糖>壁芯比>氯化钙,最佳试验组合为A2B1C2D3,即海藻酸钠质量浓度为0.035 g/mL,壳聚糖质量浓度为0.004 g/mL,壁芯比为2∶2,氯化钙为0.05 g/mL,包埋率为94.5%。由表7方差分析结果可知,海藻酸钠、壳聚糖、壁芯比对活菌微胶囊的包埋率有显著影响,各因素的F值反映其对试验指标的影响大小,各因素对包埋效果的影响大小顺序为海藻酸钠>壳聚糖>壁芯比>氯化钙,与正交试验的极差分析结果一致。
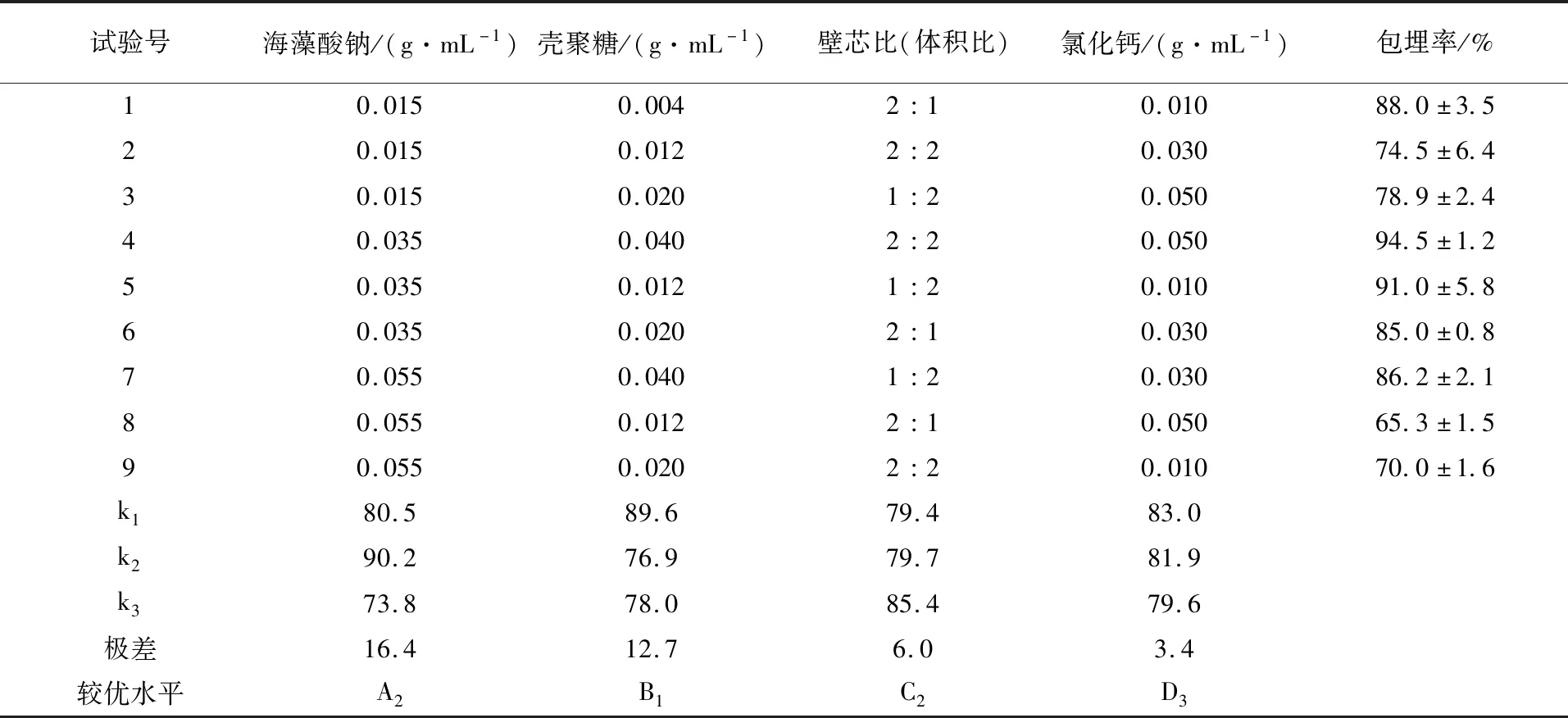
表6 L9 (34)正交试验结果与极差分析Table 6 Experimental results and range analysis for L9 (34) orthogonal array Design
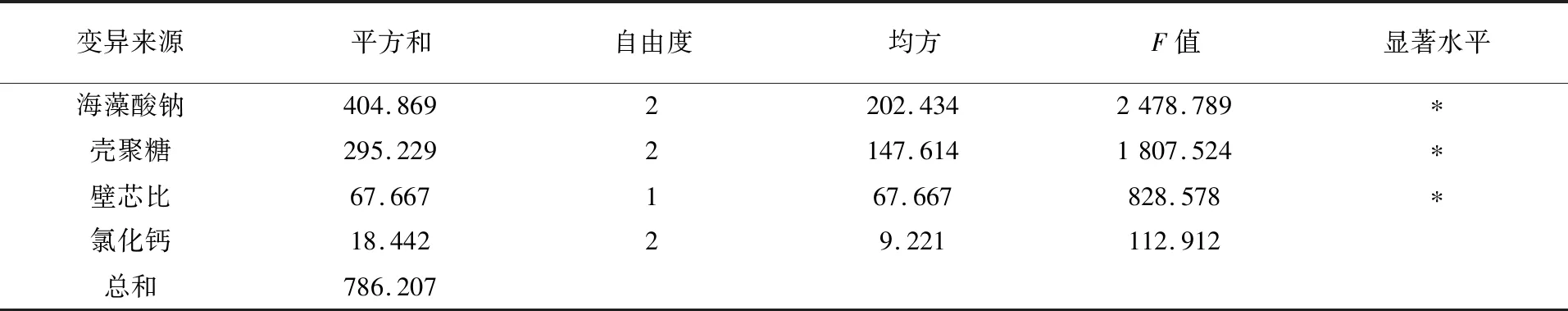
表7 正交设计方差分析Table 7 Analysis of variance for orthogonal array design
注:**P<0.01,差异极显著;*P<0.05,差异显著;F0.01(2,8)=99,F0.05(2,8)=19
2.6.2 微胶囊形态观察 如图8A所示,通过挤压法制得的微胶囊形状均一,呈圆球状,粒径在1 mm左右,具有一定的机械强度,颗粒外面一层是凝胶膜,是钙离子与海藻酸钠-壳聚糖液滴发生交联形成的凝胶层。图8B、C是微胶囊的扫描电镜图,形成的微胶囊排列比较紧密,有时也会随机出现较完整的圆球形。从图B中可以看出,微胶囊化后表面没有出现缝隙,囊壁结构较完整,说明能很好地将EcNA包埋其中,起到很好的保护作用。
2.6.3 胃耐受性试验 人体胃部消化食物的过程为1~2 h,所制备的微胶囊应该在这段时间内保护工程菌EcNA抵御胃部的酸性环境,使其顺利进入肠道发挥作用,由于食物的成分不同,人体胃液通常会发生波动,试验选择2.5和4.5两个pH值人工胃液模拟胃部环境,考察微胶囊对工程菌EcNA的保护作用。如图9所示,在两种pH人工胃液中处理2 h后,未微胶囊化的菌体数量迅速下降,而经包埋后的微胶囊仍保持较高的水平,均在80%以上,说明微胶囊化能很好地保护工程菌EcNA抵御胃部的酸性环境。

图8 EcNA活菌微胶囊形态表征Fig.8 The microcapsule morphology characterization of EcNAA:EcNA微胶囊的基本形态观察;B、C:冷场电子显微镜观察EcNA微胶囊的超微结构A:asic morphological observation of microcapsule EcNA;B,C:ltrastructure of microcapsules ice electronic microscope EcNA
2.6.4 肠溶性试验 微胶囊化的EcNA经人工肠液处理4 h,如图10所示,在人工肠液中微胶囊开始发生溶解,随着处理时间的延长,微胶囊的肠溶出率也不断增加,1 h后可观察溶液几乎不含固体颗粒,基本完全溶解,肠溶性较好。
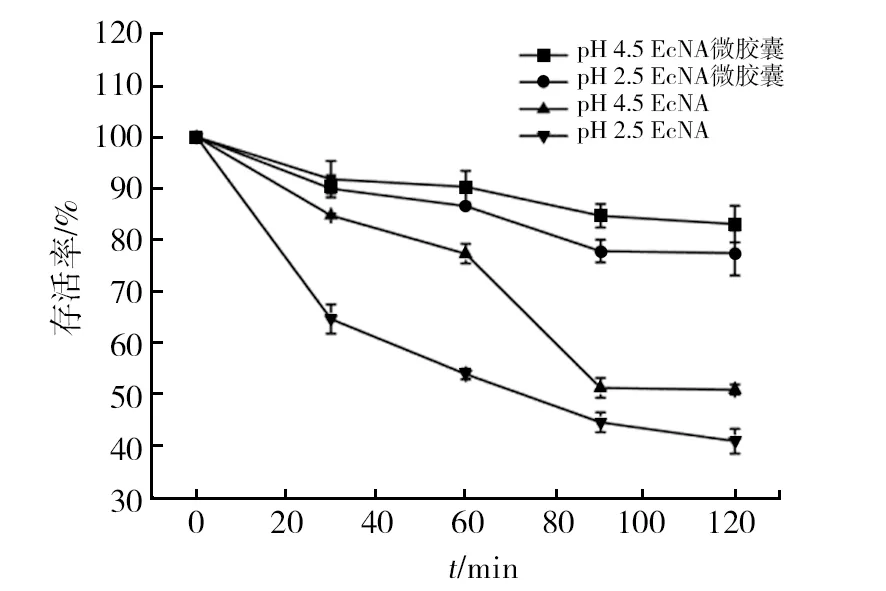
图9 EcNA微胶囊活菌在人工胃液中的存活率Fig.9 The survival rate of living bacterium microcapsules in artificial gastric juice

图10 EcNA微胶囊活菌在人工肠液中的释放率Fig.10 Living bacterium microcapsules release rate in artificial intestinal juice
3 讨 论
大肠埃希菌的基因工程菌在发酵时应尽量控制其代谢产物乙酸的产生,这样更有利于菌体生长和目的蛋白的表达。但过低的甘油浓度不利于基因的转移形式,过高的甘油浓度会增加3-磷酸甘油的积累而抑制菌体生长,所以在EcNA发酵过程中应添加适量甘油有利于菌体生长。本研究通过单因素试验筛选出甘油的最适添加量为5 g/L,此时EcNA生长状况最好。在发酵过程中添加氮源是菌体生长所必需的,酵母提取物营养物质较丰富,但只含有少量的氨和碳水化合物,如果将其作为单一氮源,则要加入大量的酵母提取物才能满足菌体对氮源组分的需求,但酵母提取物黏度较大,过量加入不利于菌体生长。蛋白胨虽然营养物质不够丰富,但本身含有较多的氨基酸,主要作用就是用来提供氮源。当两种组分复合添加到发酵培养基中,既满足了菌体对氮源和营养物质的需求,也克服了单一氮源的不利因素对菌体生长造成的影响。本研究以EcNA为对象,考察了酵母提取物和蛋白胨复配添加对EcNA菌体浓度的影响,结果显示与添加单一组分相比,其菌体浓度显著增高。
本研究已经在培养基中添加了足够的蛋白胨和酵母提取物,玉米浆因含有大量的溶磷和氨可能会抑制菌体的生长,所以玉米浆的添加量需要控制在合适的范围内。在补加适量玉米浆组分后,实现了EcNA高密度发酵,且玉米浆的添加在增产的同时并没有额外补加无机盐,说明玉米浆的添加不仅可以增加工程菌的菌体浓度还可以减少无机盐的添加,实现了降低生产成本的目的[25-26]。
由于培养基组分之间关系复杂,需做大量的实验才能考虑所有的情况对微生物生长的影响,这对实际应用来说是不合理的。但培养基组分与目的产物的产量之间必定存在联系,即不同的培养基组分组合对应不同的输出产量值。本研究以Box-Behnken设计试验数据为基础,采用BP人工神经网络建模,与传统的响应面模型对比,有更好的拟合能力和泛化能力,能够很好地反映出3个重要的培养基组分与EcNA菌体浓度的映射关系,再通过遗传算法寻找最佳培养基配比,其最高菌体浓度比响应面模型预测值提高了4.95%。因此,该优化方法有可能更好地应用于发酵培养基优化。
壳聚糖分子结构中有氨基,当pH低于6.5时带正电,可与带负电的海藻酸钠在结合过程中产生静电作用,在海藻酸钠微胶囊表面形成一层解电解质膜,酸性液体进入微胶囊内部的难度就加大,从而减少了这些酸性液体对菌体的直接伤害,菌体存活率会越高[27]。在此基础上,本研究成功地将海藻酸钠和壳聚糖作为复合壁材,制备得到耐酸性良好的EcNA微胶囊。显示出海藻酸钠和壳聚糖复配包埋广泛用于微胶囊制备过程中,为大规模工业化生产制备益生菌微胶囊提供参考。
