Listr1遗传位点影响小鼠对约氏疟原虫易感性的研究
2019-09-16张一彤祁赞梅边诗宇孙晓琦
张一彤, 韩 雪, 张 毅, 祁赞梅, 边诗宇, 孙晓琦
(中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
Listr1遗传位点是控制小鼠感染单核细胞增生性李斯特菌(Listeriamonocytogenes,LM)后生存时间的遗传位点。该遗传位点是由Boyartchuk博士采用特殊的数量性状位点分析方法确定的高质量李斯特菌感染易感位点。其与微卫星遗传标记D5Mit205紧密连锁[1]。将BALB/c鼠和C57BL/6鼠进行多次杂交与回交后,获得了在BALB/c小鼠基因背景下引入C57BL/6小鼠Listr1遗传位点的同类系小鼠,即C.B6By-Listr1小鼠。并应用该鼠对Listr1遗传位点功能进行研究显示C.B6By-Listr1小鼠对李斯特菌易感性增强,并且Listr1遗传位点可通过调节肝脏固有免疫系统的应答来影响小鼠对李斯特菌的易感性[2]。疟疾是世界上最严重的感染性疾病之一,WHO报告显示,2016年大约有2.16亿疟疾病例,比2015年增加约500万例,死亡人数达到44.5万人[3]。在人体内,疟原虫的感染可分为红外期(肝细胞内)的裂体增殖和红内期(红细胞内)的裂体增殖及配子体形成过程[4-5]。肝脏固有免疫不仅在疟疾肝内期发挥作用[6],同时也参与红内期抗疟疾免疫应答。Frank等[7]对肝脏固有免疫系统在抗红内期疟疾免疫中发挥的作用进行了总结与分析,其中包括:激活TLR受体,急性期反应、库普细胞吞噬作用、细胞因子介导的抗炎反应,激活T细胞和B细胞的免疫效应。由于疟原虫与李斯特菌均为胞内寄生病原体,二者均可在肝内进行繁殖或在肝内被清除,推测Listr1遗传位点可能通过调控肝脏固有免疫系统来影响小鼠对疟疾的易感性,目前相关研究鲜有报道。本研究建立了C.B6By-Listr1小鼠和BALB/c小鼠感染P.y17XL的模型,观察两种小鼠感染率、生存率、感染后肝脏组织病理损伤情况及感染早期肝脏分泌细胞因子的差异情况,以期探讨Listr1遗传位点影响小鼠对疟疾易感性的可能性及其初步作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及疟原虫 C.B6By-Listr1小鼠:将BALB/c鼠和C57BL/6鼠进行多次杂交与回交后得到的在BALB/c小鼠基因背景下引入C57BL/6小鼠Listr1遗传位点的同类系小鼠,由美国麻省大学医学院Victor Boyartchuk实验室惠赠。琼脂糖凝胶电泳鉴定小鼠基因型如图1。此小鼠对李斯特菌易感性增强[2]。BALB/c小鼠:购自辽宁长生生物科技有限公司(许可证号:SCXK(辽)2015-0001)。实验用鼠为6~8周雌性小鼠。致死型约氏疟原虫P.y17XL,液氮冻存,由BALB/c小鼠周期复苏传代。

图1 不同基因型小鼠的电泳形态Fig.1 Electrophoresis form of different genetype miceF:Listr1位点杂合同类系种鼠;B:C.B6By-Listr1同类系小鼠;C:BALB/c小鼠F:Listr1 locus heterozygous congenic mice;B:C.B6By-Listr1 congenic mice;C:BALB/c mice
1.1.2 主要试剂 Trizol、PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time) 、SYBR®Premix Ex TaqTMII (Tli RNaseH Plus)购自大连宝生物公司;Giemsa染液购自北京索莱宝科技有限公司。
1.1.3 主要仪器设备 光学显微镜(Eclipse E100,日本Nikon);PCR仪(S1000 Thermal Cycler,美国BIO-RAD);Realtime PCR(7500,美国Applied Biosystems);电泳仪(EPS 300,Tanon);凝胶成像系统(GelDoc-It 310,美国UVP)。
1.2 方法
1.2.1 实验动物及分组 C.B6By-Listr1实验组:6~8周龄、雌性C.B6By-Listr1小鼠经腹腔注射1×104P.y17XL感染红细胞。BALB/c对照组:6~8周龄、雌性BALA/c小鼠经腹腔注射1×104P.y17XL感染红细胞。感染后第3天开始,对小鼠尾静脉采血,制备薄血膜,Giemsa染色,显微镜检计数红细胞感染率,动态监测疟原虫血症水平、生存率。
1.2.2 HE染色法观察肝脏组织的病理损伤情况 于P.y17XL感染后第5天取小鼠脱颈处死,取肝脏组织于门静脉处进行灌流,放入4%多聚甲醛中固定,常规制备石蜡切片进行苏木素-伊红染色并对其组织损伤情况进行观察。观察内容包括:组织结构破坏的严重程度及疟色素沉积情况。
1.2.3 实时定量RT-PCR检测细胞因子mRNA水平 分别于感染后第1、2、5天处死小鼠,取少量肝脏组织,使用Trizol试剂提取总RNA,按PrimeScriptTMRT reagent Kit with gDNA Eraser 说明书进行逆转录。取100 ng RNA逆转录产物,按SYBR®Premix Ex TaqTMII试剂盒说明书配制20 μL PCR反应体系,于7500(Applied Biosystems,USA)实时定量PCR仪中进行扩增。热循环过程:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 40 s,40个循环。使用肌动蛋白(β-actin)作为内参基因,特异性引物序列见表1。

表1 所用引物
1.2.4 统计学分析 使用SPSS 19.0统计软件对数据进行处理,两组数据间比较采用配对样本t检验,P<0.05代表差异具有统计学意义。
2 结果与分析
2.1 P.y17XL 感染BALB/c和C.B6By-Listr1小鼠的原虫血症和生存率的比较
如图2所示,C.B6By-Listr1小鼠与BALB/c小鼠经腹腔感染P.y17XL 寄生的红细胞(pRBC),于感染后第3天在外周血可见疟原虫感染的红细胞,随后原虫血症逐渐升高。C.B6By-Listr1小鼠的感染率较BALB/c小鼠上升快,感染后4~8 d C.B6By-Listr1小鼠虫血症水平显著高于BALB/c小鼠(P<0.05)。C.B6By-Listr1小鼠感染率于感染后第7天达到高峰81.7% 并开始死亡,于感染后第9天全部死亡;BALB/c小鼠于感染后第8天开始出现死亡,至第9天半数的BALB/c小鼠死亡;其余的BALB/c小鼠于感染率达高峰后开始下降,在感染后第13天仍然存活。两种小鼠生存率差异具有统计学意义(P<0.01)。表明C57BL/6小鼠来源的Listr1遗传位点可以影响小鼠对P.y17XL的易感性,该位点使小鼠对P.y17XL的抗性降低。
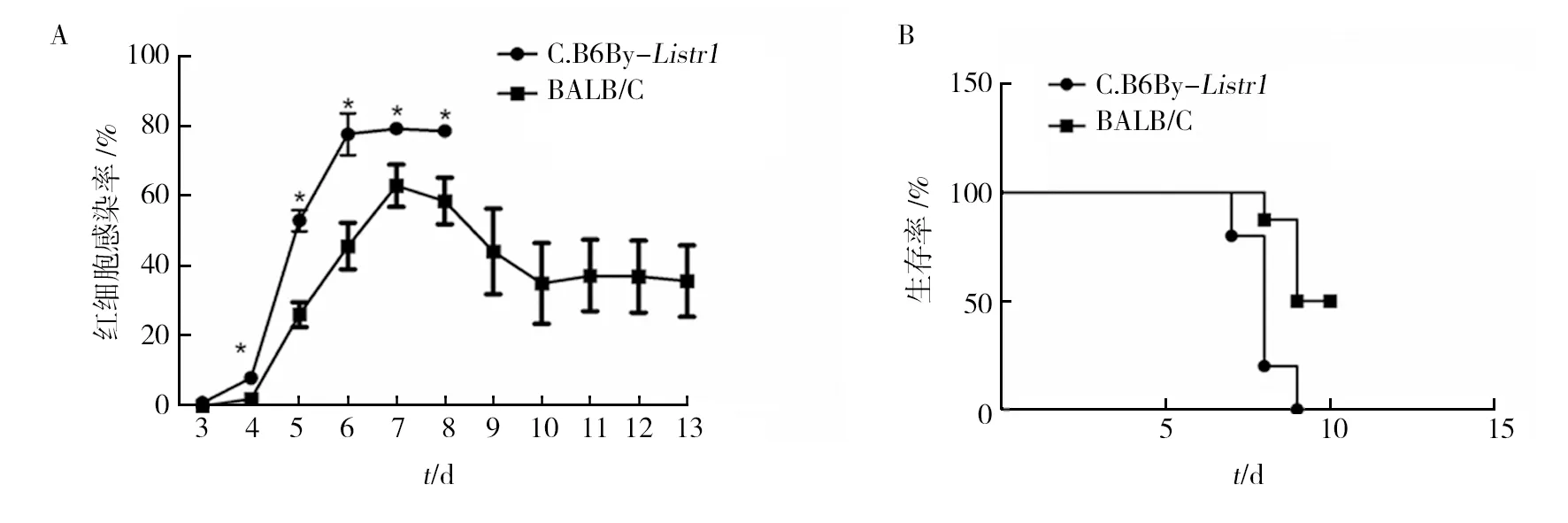
图2 P.y17XL 感染C.B6By-Listr1小鼠和BALB/c小鼠后不同时间原虫血症水平(A)及生存率(B)Fig.2 Parasitemia rate(A) and survival rate (B) of BALB/c and C.B6By-Listr1 mice infected with P.y17XL*:组间差异具有显著性,P<0.05,图4同*: indicates the significant difference between groups P<0.05,same Fig.4
2.2 P.y17XL感染BALB/c和C.B6By-Listr1小鼠后肝脏组织病理损伤情况比较
两种小鼠感染率自感染后第3天起逐渐上升,感染后第5天开始出现较大差异,故选取第5天的肝脏组织进行染色。如图3所示,HE染色可见两种小鼠肝脏组织均出现了一定程度的损伤:肝细胞排列杂乱疏松、大小不一,肝窦扩张和肿胀,肝细胞萎缩溶解。不同之处如下:C.B6By-Listr1小鼠中可见到明显的疟色素的沉积(箭头示),而BALB/c小鼠全片基本未见到。由此表明,Listr1遗传位点影响了疟原虫在肝脏内的增殖和清除过程。
2.3 P.y17XL感染C.B6By-Listr1和BALB/c小鼠肝脏组织,炎性细胞因子分泌情况的比较
分别于P.y17XL感染C.B6By-Listr1小鼠和BALB/c小鼠后第0、1、2、5天取肝脏组织,Realtime-PCR检测IL-1β、IL-6、TNF-α、IFN-γ的分泌情况,如图4所示,未感染状态下的两种小鼠IL-1β、IL-6、TNF-α、IFN-γ的分泌水平均相差不大;IFN-γ的分泌量在感染早期并未见到明显的升高,在感染后期分泌量有所增高,但未见统计学差异。TNF-α 和IL-6的分泌量早期随着时间的推移逐渐增高,感染后24 h还未见到统计学差异,48 h可见到统计学差异。BALB/c小鼠显著高于C.B6By-Listr1小鼠(P<0.05)。IL-1β的分泌量未观察到随时间变化的规律,在感染后24 h分泌量有轻微升高,48 h仍未观察到明显的升高,且未见统计学差异。由此表明,P.y17XL感染后BALB/c小鼠肝脏的炎症反应上调,即BALB/c小鼠P.y17XL感染早期肝内天然免疫的炎症反应强于C.B6By-Listr1小鼠。

图3 P.y17XL感染小鼠后第5天肝脏组织病理损伤情况(HE染色)Fig.3 Pathological damage after five days of P.y17XL infection in mouse liver(HE Staining)A: C.B6By-Listr1小鼠;B: C.B6By-Listr1小鼠;C:BALB/c小鼠;D:BALB/c小鼠A: C.B6By-Listr1 mice;B: C.B6By-Listr1 mice;C:BALB/c mice;D:BALB/c mice

图4 BALB/c 小鼠和C.B6By-Listr1小鼠感染 P.y17XL后IFN-γ(A) IL-1β(B)、IL-6(C)、TNF-α(D)的分泌情况Fig.4 The mRNA level of IFN-γ(A), IL-1β(B),IL-6(C),TNF-α(D)in the liver of BALB/c and C.B6By-Listr1 mice infected with P.y17XL
3 讨 论
本研究应用C.B6By-Listr1同类系小鼠作为实验组,BALB/c小鼠作为对照组,探讨了Listr1遗传位点影响小鼠对P.y17XL易感性的可能性及其初步作用机制。结果发现,C.B6By-Listr1同类系小鼠于感染P.y17XL后原虫血症水平高于野生型BALB/c小鼠,生存率显著降低。表明Listr1遗传位点不仅控制小鼠对李斯特菌的易感性,也控制小鼠对疟疾的易感性。同一遗传位点对不同胞内寄生菌易感性的调控此前已有报道。Boyartchuck等发现,控制小鼠对结核杆菌(mycobacteriumtuberculosis,MTB)易感性的sst1[8]遗传位点也控制小鼠对李斯特菌的易感性,并发现其作用与IFN-γ激活巨噬细胞分泌活性氧自由基的过程有关[9-10]。最终发现sst1遗传位点中的Ipr1基因通过蛋白SP110诱发巨噬细胞内质网应激和抑制抗凋亡因子的过程[11]来影响小鼠对结核分枝杆菌和李斯特菌的易感性[12-13]。
疾病的易感性与基因多态性息息相关[14-16]。Listr1遗传位点涵盖了11.4 Mb长度的基因组区域,包含了100多条注释基因,其中的10个是编码CXC家族趋化因子的[2]。我们发现Listr1遗传位点中Cxcl11等位基因处有一框移突变,该突变使得小鼠不能合成完整的趋化因子CXCL11。CXCL11可参与肝脏固有免疫系统组分稳态的调控,诱导T细胞产生干扰素,趋化白细胞的迁移[17]。疟原虫通过疟蚊传播,由血进入肝脏入侵肝细胞,并进行大量的无性增殖,随后裂殖子从肝细胞中释放,入侵红细胞在红细胞内进行无性增殖,导致周期性发热、肝脾肿大、贫血等临床症状,此红内期阶段和疟疾的发病率与死亡率直接相关[18]。而肝脏固有免疫也参与红内期抗疟疾免疫应答。Wunderlich等发现在致死性的P.chabaudi感染中,血清中IL-1β、TNF-α和IL-6产生2个波峰,第1个波峰在第1天,第2个波峰在虫血症最高的第8天。与此同时肝脏也检测到产生双时相性的编码IL-1β、TNF-α和IL-6的mRNA[19-20]。为了解C.B6By-Listr1小鼠与BALB/c小鼠感染约氏疟原虫后Listr1遗传位点对肝内免疫的调控作用,我们对两种小鼠肝内病理和炎症应答情况进行了分析。
取两种小鼠感染率开始出现较大差异即感染后第5天的肝脏组织HE染色进行观察,发现C.B6By-Listr1小鼠肝脏中有较明显的疟色素沉积,而BALB/c小鼠肝脏中几乎未见疟色素的沉积。疟色素(hemozoin,HZ)是由疟原虫在代谢宿主红细胞内血红蛋白过程中,所产生的一种亚铁血红素结合体,它可随疟原虫寄生的红细胞破裂而释放,并且很快会被吞噬细胞所吞噬沉积在组织当中[21]。疟色素在C.B6By-Listr1同类系小鼠肝内大量沉积,一方面印证了其高水平的原虫血症,另一方面反映了肝脏在清除疟原虫感染红细胞中的作用。我们的前期研究中显示BALB/c小鼠肝脏表达趋化因子CXCL11受体CXCR3、CXCR7的CD14+的细胞数量高于C.B6By-Listr1同类系小鼠。由此推测BALB/c小鼠对疟原虫感染红细胞的清除可能好于C.B6By-Listr1小鼠,从而使其原虫血症水平得到控制。同时也观察到BALB/c小鼠肝细胞肝板肿胀,空泡变多,胞质更加疏松,有轻微的脂肪变性,提示BALB/c小鼠肝内炎症反应可能强于C.B6By-Listr1小鼠。
为进一步了解BALB/c小鼠感染P.y17XL早期肝内是否存在与单核巨噬细胞活化相关的炎症反应,取P.y17XL感染后两种小鼠肝脏组织进行RT-PCR检测发现感染后48 h,IL-6、TNF-α的分泌水平均具有统计学差异(P<0.05)。TNF-α拥有广泛的生物学功能,主要由激活的巨噬细胞释放,也可由抗原刺激的T细胞、活化的NK细胞和肥大细胞分泌,是机体适应性免疫和固有免疫的重要组成部分[22]。而IL-6是可在体内发挥多种作用的细胞因子,在炎性环境下,成纤维细胞、单核细胞、巨噬细胞、T细胞、内皮细胞均可合成IL-6发挥相应的作用[23]。我们检测到IL-6、TNF-α的分泌水平BALB/c小鼠要高于C.B6By-Listr1小鼠,与此前观察到的两种小鼠肝内CD14+细胞数量差异相符,提示肝内CD14+单核/巨噬细胞可能参与肝内抗疟原虫免疫应答。另一方面,Robinson等[24]的研究显示疟疾肝内期产生的细胞因子也会在红内期产生系统性的影响。综上,在疟疾感染过程中,Listr1遗传位点发挥一定的调控作用,影响小鼠肝脏对入侵疟原虫的清除,影响肝脏虐色素的沉积和肝脏炎性细胞因子的分泌,进而对小鼠虫血症和生存情况造成影响,肝内CD14+单核/巨噬细胞可能参与此调控的过程。
疟疾至今仍是严重威胁人类健康的疾病,本研究为疟疾感染后体内产生的复杂免疫反应的调控机制提出了可能的遗传位点,有助于研究者更好地理解机体疟疾感染的抵抗机制,为进一步干预疟疾进程提供参考。同时鉴于已经发现的Listr1遗传位点对肝内天然免疫功能的影响,该位点可能不仅控制肝内抗感染免疫,还可能在其他的一些肝脏疾病如病毒性肝炎、非酒精性肝硬化、脂肪肝、肝癌也发挥重要作用。因此,深入研究Listr1遗传位点的功能及其调控的细胞学基础具有重要意义。