生物工程强化微生物电合成转化CO2的研究进展
2019-09-16金熠樵黄运红龙中儿
邹 龙, 金熠樵, 吴 贤, 黄运红, 龙中儿
(江西师范大学 生命科学学院,江西 南昌 330022)
能源短缺、环境污染和气候变化等问题已成为当今实现可持续发展所面临的重要挑战。国际能源署(International Energy Agency)发布的《World Energy Outlook 2015》指出,2013年全球能源需求总量是18 TW,其中化石能源(煤炭、石油、天然气)约占80%;随着世界人口增长和工业化程度提升,全球能源需求预计在2040年增长至24~26 TW,届时二氧化碳(CO2)排放量将从2013年的32 Gt增长至37~44 Gt。因此,发展绿色可再生新能源替代传统化石燃料受到全球格外关注。近年来,由于诸多的微生物被发现具有与外界环境交换电子的能力(即胞外电子传递过程)及相关机制研究的不断深入,微生物电化学系统作为一种新型绿色能源转换体系备受科技界青睐[1-2],可为能源短缺和环境退化问题提供新的解决思路和技术平台。
微生物电化学系统以电活性微生物作为催化剂,依赖于微生物与胞外固相电极间的电子交换,主要包括用于氧化降解有机废物并同时产生电能的微生物燃料电池(Microbial fuel cells,MFCs)[3-5]、用于生物制氢的微生物电解池(Microbial electrolysis cells,MECs)[6]和用于同化CO2生产有机化合物的微生物电合成(Microbial electrosynthesis,MES)[7-9]等。其中,作为新型电驱动微生物合成技术,MES中的微生物能够以电极为电子供体驱动胞内代谢,将CO2还原为乙酸、乙醇等有机化学制品。可见,MES既是可再生储能技术(将电能转化为化学能),又是CO2同化固定平台,具有十分重要的能源效益和生态意义。尽管MES的研究近年来取得了较为快速的发展,但是离实际应用还有以下两个关键的瓶颈需要突破:①微生物与电极间的胞外电子传递(Extracellular electron transfer,EET)速率较低,尚难以达到工业化要求;②产生的有机化合物主要以C2-化合物为主,品位较低,商业价值不高。依赖于现代分子生物学和现代工程技术的生物工程可提供解决上述两个主要问题的方案,比如优化微生物胞外电子传递链和构建高品位化合物的合成代谢途径。本文将在阐明MES阴极微生物吸收胞外电子机制的基础上,系统综述近5年生物工程在促进微生物电合成转化CO2的策略和研究进展,并就今后研究方向进行探讨。
1 微生物电合成
MES由Nevin等[10]于2010年首次提出,将其定义为微生物(作为生物催化剂)利用电能将CO2还原为多碳有机化合物的过程。不过,有学者认为利用胞外电极实现有机底物的转化或碳链延伸的微生物电化学催化过程也属于MES的范畴[7]。常见的MES系统(图1)由阳极室和阴极室组成,两室被离子交换膜分隔,阳极发生微生物氧化还原态无机/有机底物或简单电化学水解产生电子的反应,阴极室中的亲电微生物吸收阴极电子还原CO2或其他氧化态有机物,从而实现物质和能量的转化过程。可见,除了直接以温室气体CO2作为碳源这一独特优点外,MES所需的能量来源十分丰富,既可以是太阳能和风能等可再生能源所衍生的电能,也可以是生物氧化有机废物或还原态的无机物所产生的生物电能,因而兼具了生态环境修复功能。另外,MES具有很高的能源转换效率,其将电能转换为化学能(有机产物中的化学键能)的效率超过80%[10-12];将MES与光解水系统整合后,利用光能还原CO2效率可高达10%,明显超过许多农作物的光能利用率[13]。在MES中研究较多的微生物为自养型产乙酸菌,如Sporomusaovata和Clostridumljungdahlii,它们以CO2作为电子受体,通过Wood-Ljungdahl途径还原为乙酰-CoA,进而产生乙酸等有机化合物,通常具有较高的产率和电能转化效率[11,14-16]。污水、活性淤泥和沉积物等来源的混合微生物菌群也常用作MES的接种物,相比于纯培养物而言,混合接种物的MES运行不需要严格的无菌条件,但是其代谢产物专一性较差,不仅会降低某一特定产物的转化效率而且不利于后续目标产物的分离纯化[17]。虽然,由于近几年在接种物、电极材料和器件等的优化改造方面的提升,MES还原CO2生产多碳有机物的产率得到了显著提高,比如乙酸的产率可高达2.48×103M/(d·m3)[18];但是据估算,目前MES生产乙酸的能耗和成本均显著高于传统的工业制备方法即甲醇碳基化法[19-20],尚不具备商业化的条件。
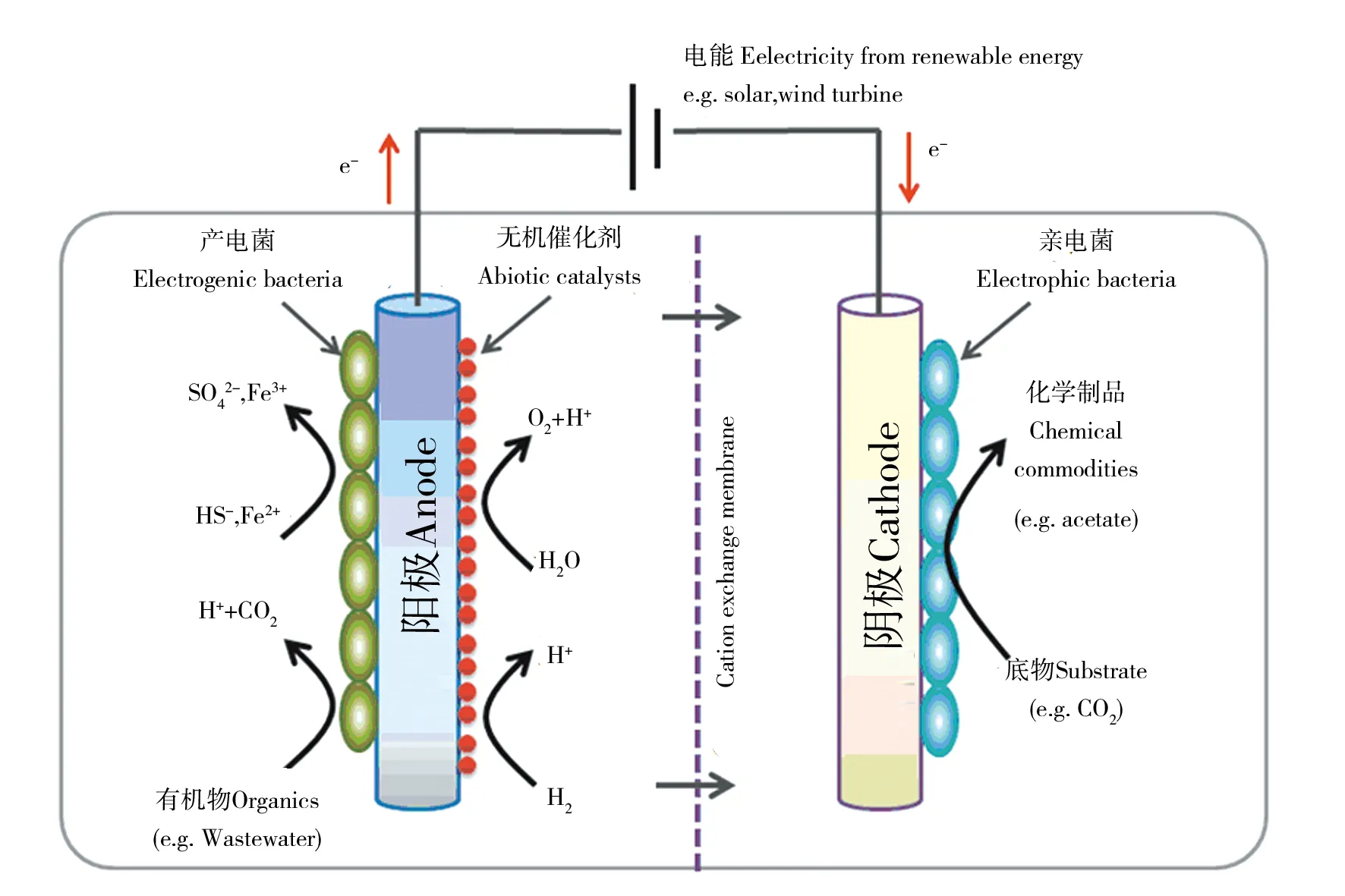
图1 微生物电合成系统示意图Fig.1 Schematic of microbial electrosynthesis system
2 阴极微生物胞外电子传递机制
阴极微生物吸收电极上的电子驱动细胞内还原(合成)代谢是MES的关键过程,EET速率是MES效率的决定性因素之一。因此,MES阴极EET机制的解析是提高阴极微生物吸收电极电子速率和实现MES高产率的基础。目前,已知的阴极电活性微生物的EET过程可分为两类[21]:基于电子介体的间接传递和基于膜结合蛋白的直接传递(图2)。
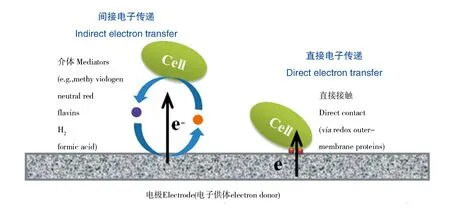
图2 阴极微生物吸收胞外电子的机制示意图Fig.2 Mechanism schematic of extracellular electron transfer in cathodic microorganisms
2.1 间接电子传递
间接EET是由外源或内源的氧化还原活性小分子物质作为可逆电子介体所实现的微生物与电极间的电子传递过程。人工合成的外源电子介体如中性红和甲基紫精已被证明可以介导阴极微生物胞外电子传递,添加甲基紫精或中性红可将接种梭状芽胞杆菌ClostridiumtyrobutyricumBAS 7的MES阴极产丁酸的产率提高1.3倍[22],中性红可显著增加MES阴极还原CO生产挥发性脂肪酸的库伦效率[23],它们的引入显著增加电子交换速率或者通过改变电子流向而调节胞内还原力(NADH水平)[22,24]。
2.2 直接电子传递
直接EET是指不需要依赖任何电子介体,附着在电极上生长的微生物可凭借细胞外膜或周质中的氧化还原蛋白与电极直接接触而实现电子交换。目前,关于阴极电活性微生物直接EET机制的研究尚较为鲜见,并且主要集中在异化金属还原菌Geobatersulfurreducens和Shewanellaoneidensis,它们是研究EET机制的模式菌株,均被证实具有双向EET特性(通常将产电微生物输出胞内电子称为正向EET,亲电微生物吸收胞外电子称为反向EET)。G.sulfurreducens电极生物膜中细胞在吸收电极电子时,其编码细胞外膜色素蛋白和鞭毛的基因表达水平要低于输出电子时的水平,但是编码周质色素蛋白PCCH的基因在吸收电子时转录水平却较高,而且缺失该基因会严重抑制电极生物膜吸收胞外电子的能力,然而对输出电子过程没有明显影响,提示G.sulfurreducens的双向EET过程可能涉及两条不同的路径[31]。与此不同的是,Mtr(CymA-MtrABC/OmcA)途径被证明同时参与S.oneidensis的双向EET过程,其吸收胞外电子的路径很可能为输出胞内电子的逆转[32]。产乙酸菌和产甲烷菌被报道可以在相对高电势(-0. 4~-0.5 V)下吸收电极电子驱动乙酸或甲烷的合成,由于该电势条件下不利于电极产生H2作为电子介体,因而推测它们也可能存在直接EET机制[33-34],但仍然存在争议,需要对其分子机制进行进一步研究。另外,产电微生物还可凭借被称为“细菌纳米线”的菌毛直接输出胞内电子并实现较长距离的电子传递[35],但是尚未见“细菌纳米线”介导反向EET过程的报道。
相比于间接电子传递,基于电极与细胞直接接触的电子传递途径通常被认为具有更快的动力学和更低的能量损耗[36],但是对于一个特定的MES而言,有限的器件和电极尺寸往往无法提供足够大的接触面积,从而限制了直接电子传递的利用率。另外,在较厚的电极生物膜中,外层微生物细胞通常比包裹在生物膜内部的细胞具有更高的代谢活力,而直接电子传递途径似乎无法保证其快速交换电子的需求。间接电子传递的速率往往依赖于电子介体的浓度,因而可通过提高MES电解液中电子介体的量,实现快速的EET,但是间接电子传递在MES实际应用中面临着“洗出”及二次环境污染的问题。通过基因改造或代谢工程手段提高MES中电活性微生物自身产生的内源性电子介体的分泌量,或者采用固定化技术将电子介体控制在电极界面周围等策略,也许既可以较大提高EET速率,又可有效解决间接电子传递在实际应用过程中所面临的困难。
3 生物工程强化MES策略与应用
阴极微生物的胞外电子吸收速率和代谢途径是决定MES产物及其转化效率的关键,理想的MES微生物催化剂不仅需要快速地吸收胞外电极电子并将其与胞内还原代谢偶联,还需要具备捕获固定CO2的代谢途径。但是,具有高EET速率的天然电活性菌(如Geobaterspp.和Shewanellaspp.)通常缺乏还原CO2合成高附加值产物的代谢途径,而大多数工业生产菌一般又不具有EET能力,所以需要通过适当的策略和手段进行调控或改造,使两者有机整合(图3)。
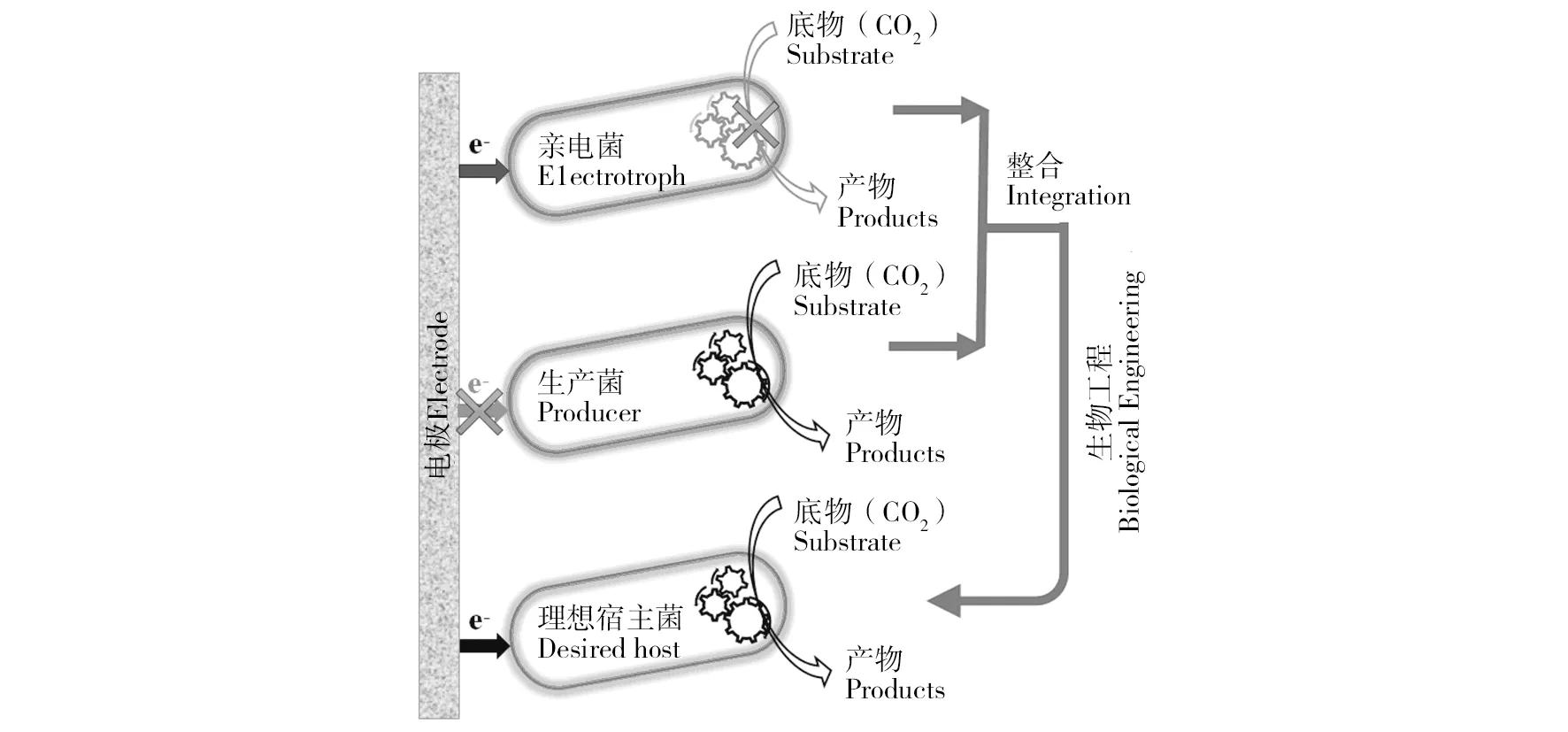
图3 MES阴极微生物特性需求Fig.3 The properties of cathodic microorganisms for MES
3.1 增强胞外电子传递能力
近年来对产电微生物EET分子机制的研究不断深入以及基因编辑工具的发展,在通过基因工程和代谢调控手段增强天然产电菌EET方面取得了一定研究进展[37]。比如,通过过表达绿脓菌素合成途径中的甲基转移酶基因phzM,增强了Pseudomonasaeruginosa分泌绿脓菌素(即电子介体)的能力,从而使得该菌株的正向EET能力得到了较大提高[38]。最近,Yang等[39]通过合成生物策略将Bacillussubtilis中编码核黄素的核心基因簇(ribADEHC)引入S.oneidensisMR-1中进行异源表达,使得其核黄素分泌量提高了25.7倍,显著增强了核黄素介导的间接电子传递,该工程菌双向胞外电子传递速率均得到了10倍以上的提高。另外,Min等[40]通过同源过表达核黄素合成基因簇(ribDCBAE)和金属还原酶基因簇(mtrCAB)也使得S.oneidensisMR-1的双向胞外电子传递速率得到了较大提升。通过基因调控改变细胞内还原当量水平(NADH/NAD+比值)从而提高正向EET速率在S.oneidensisMR-1和P.aeruginosa等产电菌中也同样得到实现[41-42]。尽管已有多种策略可用于提高S.oneidensis等天然电活性菌的正、反向EET过程,但是这些电活菌一般缺乏利用胞外电子合成高附加值产物的代谢途径。有报道称S.oneidensisMR-1可吸收电极电子实现延胡索酸还原为琥珀酸的过程[32],但是该反应不涉及CO2的同化,并非真正意义上的微生物电合成。
在工业生产菌中引入外源EET传递通路将其转变为电活性菌,可能是拓展微生物电化学技术应用和实现高效电驱动微生物合成的重要渠道。Jensen等[43]通过异源表达色素蛋白MtrCAB编码基因,在大肠埃希菌(Escherichiacoli)中重塑了S.oneidensisMR-1的部分胞外电子传递链,使得E.coli还原可溶性Fe3+离子和不溶性α-Fe2O3的速率分别提高了8倍和4倍,实现了E.coli的胞外电子传递过程。在该工程菌中继续引入外源CymA蛋白可进一步提高E.coli的正向EET速率和细胞生长量[44]。有研究表明,在E.coli中引入CymA-MtrCAB胞外电子传递链不仅将电流输出提高8倍,而且会对胞内代谢流的分布产生一定影响[45],这为代谢调控的应用提供了基础。在E.coli中成功重塑外源胞外电子传递通路为开发具有工业应用价值的电活性生产菌提供了新思路,尽管该领域的研究暂时聚焦于正向EET途径,但相信随着反向EET分子机制研究的不断深入,在工业生产菌中构建反向EET通路从而实现真正意义上的电驱动微生物合成将成为可能。
3.2 调控胞内合成代谢
亲电微生物在获得快速吸收胞外电极电子的基础上,要实现高效的微生物电合成还需具备将所吸收的电子转化为还原力驱动胞内合成代谢的能力;同时,反向EET过程所偶联的代谢途径的类型决定了最终的产物种类。模式电活性菌S.oneidensisMR-1除了被证明可利用胞外电子还原延胡索酸生成琥珀酸外,Jeon等[46]研究证实提供胞外电流还可将S.oneidensisMR-1工程菌(异源表达Ehrlich途径中2-酮异戊酸脱羧酶基因kivD和乙醇脱氢酶adh)的异丁醇产量提高近1倍,提示可通过有效的代谢调控策略将天然电活性微生物改造为产高附加值生物制品的宿主菌。产乙酸菌以CO2作为电子受体的主要产物为C2-化合物乙酸,通过基因工程手段可调控其胞内代谢流从而获得其他多碳化合物如丙酮、异丙醇和丁酸等(图4)[47-49],具有更高的应用价值。产乙酸菌能够利用Wood-Ljungdahl途径同化两个CO2分子合成一个乙酰-CoA,乙酰-CoA的代谢流向是决定MES终产物的关键。Ueki等[49]通过基因改造对C.ljungdahlii进行多重代谢调控,包括引入异源的乙酰-CoA合成丁酸途径、失活乙酰-CoA转化为乙酸和乙醇的途径等,从而使得该菌株能将约50%碳源或70%电子流用于丁酸的生产,说明可通过遗传改造产乙酸菌的Wood-Ljungdahl途径从而电化学合成比乙酸价值更高的有机化合物。
化能无机自养型细菌Cupriavidusnecator(又名Ralstoniaeutropha)具有丰富多样的代谢途径,是生物工程常用宿主菌,也已被成功改造应用于MES。Li等[51]将异源异丁醇和3-甲基-1-丁醇生物合成基因导入R.eutrophaH16菌株中,同时敲除其原有的聚羟基丁酸酯合成途径,所构建的工程菌可在以电能和CO2为唯一能源和碳源的生物电化学装置中,利用电化学还原CO2所产生的甲酸进而合成C4-和C5-醇。Grousseau等[50]通过在聚羟基丁酸酯合成能力缺失突变株C.necatorRe2133中过表达自身的β-酮硫解酶基因phaA和CoA-转移酶基因ctf以及异源表达Clostridium属来源的乙酰乙酸脱羧酶基因adc和乙醇脱氢酶基因adh,从而构建了能以果糖为唯一碳源的异丙醇生物合成途径。该工程菌株随后被应用于微生物电化学装置中,能以CO2作为碳源,同时以电化学产生的H2作为能源,合成滴度高达216 mg/L的异丙醇[52]。最近,Krieg等[53]的研究表明,在C.necator中引入外源甲戊二羟酸途径和α-蛇麻烯合成酶,可使该菌株在直接以电极电流作为电子供体和CO2作为电子受体及碳源的条件下合成α-蛇麻烯,每克细胞干重的α-蛇麻烯产量可高达17 mg,从而开辟了微生物电合成生产萜烯类物质的绿色途径。因此可以看出,通过巧妙的代谢调控可实现多种有机化合物的微生物电合成,从而解决目前微生物电合成产物(乙酸为主)品位低、商业应用价值不高的瓶颈。
3.3 构建有限的混合微生物群体
单一菌株用于MES的接种物有利于阐述电子传递机制等基础问题,但是其通常只能实现一些相对简单或单一的物质转化。另外,过度的基因改造和代谢修饰往往又会对菌株的生长速度、抗性等产生不利影响。有些菌株具有的较好电化学活性或特殊物质转化能力的,但其不清楚的遗传背景或缺乏相应的基因操作手段往往会限制其在MES中的应用潜力。虽然,活性淤泥等天然混合微生物菌群用于MES接种物可实现多种的电子传递过程和较丰富的代谢流,但是其菌群组成复杂且在MES运行过程中不稳定,所形成的副产物多,不利于体系的可控运行和后续的产物分离纯化。人为构建有限的混合微生物群体可能是一种有效的解决方案,通过不同的微生物在该体系中扮演着特定的角色以及它们间的相互关联,不仅可以利用不同的代谢途径实现生物合成产物种类的多样性,还可以提高电子流和物质流的速度和可控化进程。Marshall等[54]通过分析MES阴极微生物群体的转录活性和模拟电驱动合成代谢通路,发现不同菌株在该体系中充当不同的生态位,比如Acetobacterium是群体中主要的固碳者,Sulfurospirillum通过呼吸作用消耗溶液中少量氧气,而Desulfovibrio被认为在电极上产生氢化酶、甲酸脱氢酶和细胞色素等参与质子还原产氢的过程。
氢营养细菌可高效利用H2作为能源驱动生物合成反应,但是它们不能直接从电极吸收电子作为能源或这种能力较弱。基于此,Deutzmann等[55]将铁腐蚀菌IS4与Methanococcusmaripaludis或Acetobacteriumwoodii组成有限混合培养群体分别用于产甲烷和产乙酸,其中铁腐蚀菌IS4从阴极电极吸收电子并产生H2供给M.maripaludis或A.woodii利用,从而实现CO2的固定。Puig等[28]以Rhodobacter(作为产氢菌)和Clostridium(作为固碳菌)构建了电驱动合成有机酸和醇的有限混合培养菌群,并通过电化学手段在电极上检测到Rhodobacter的产氢蛋白,从而进一步证实了生物合成的H2在MES中的关键作用。最近,Xiang等[56]将醋酸杆菌和脱硫弧菌共同接种于MES阴极,发现在添加6 mmol/L硫酸盐的条件下乙酸产量和电子捕获量比未添加硫酸盐时分别提高了2.7倍和2.4倍。他们推测,脱硫弧菌还原硫酸根所形成的S2-(如H2S)可能具有电子介体的功能,从而提高了醋酸杆菌吸收阴极电子的能力。可见,构建有限的混合微生物群体在MES中的应用,目前主要体现在提高生产菌与电极间胞外电子传递(通过电活性菌产生可利用的电子介体),鲜见通过调控不同微生物菌株间物质代谢流的偶联从而拓展终产物种类的报道。
4 展 望
生物工程的理论和相关技术为突破MES两大瓶颈,即阴极微生物EET速率慢和产品附加值低提供了机遇,并且在增强EET速率和提高产品合成效率方面取得了一定进展,但是要达到实际应用仍然面临巨大挑战。①MES阴极EET机理尚不清晰,限制了提高电子传递效率的理性设计。尽管对于电活性模式菌株S.oneidensis和G.sulfurreducens的正向EET过程有相对清楚的理解,但是对其反向EET过程的分子机制的研究却不够深入。然而这些模式菌株并非MES宿主菌的最佳选择,对MES阴极亲电微生物(包括Sporomusa属和Clostridum属)的吸收胞外电子机理、电生理特征和能量代谢模式知之甚少,不利于MES宿主菌的遗传改造和代谢调控。②MES阴极微生物吸收胞外电子与胞内代谢的偶联机制不清楚。电合成宿主菌如何将所吸收的胞外电子与胞内能量代谢匹配关联,这是实现MES的能量和物质转化的基础,其关联模式决定了MES合成的产物种类和能量转化效率,也是实现MES全局调控的分子基础。③可用基因工具箱有限,缺乏精准、高效的定量分析手段,限制了MES宿主菌开发利用的广度和深度,难以获得高附加值产品的高效生产。
针对MES发展所面临的上述问题,建议在今后研究过程中应着重从以下几方面入手。①加快基因组工具箱的开发,深入研究MES阴极EET的分子机制。基因工具是深入研究微生物EET过程并对其进行分子改造的基础,缺乏可用的基因操作工具箱通常是限制电活性微生物研究的重要原因。②利用系统生物学综合分析MES宿主菌EET路径及其组装和调控机制、物质与能量代谢偶联机制等,挖掘代谢调控改造的靶位,实现全局调控策略。EET过程以及胞内物质能量代谢途径是相对复杂的非线性生物学网络,需要从细胞整体水平和分子水平进行综合分析,因此需要高度整合组学技术(基因组学、转录组学、蛋白质组学、代谢组学等)和各种定量定性分析技术(电化学分析、同位素示踪、质谱学、原位分析手段等)进行关联性研究,并结合数学模型进行功能预测分析,深入挖掘调控位点和重要反应途径。③研究MES宿主菌能量代谢流(所吸收的胞外电子)和物质代谢流(CO2固定途径)的耦合关系,通过相关途径的改造与调控使电子流向特定产物合成,实现能量的高效利用。④研究MES内部环境(包括电极材料)和操作条件对宿主菌能量和物质代谢的影响,为开发高性能电极材料和选择最佳操作参数奠定基础,从而实现工程化应用。
