环氧泽泻烯对2型糖尿病小鼠的降糖作用
2019-09-13张伟云王明军刘华欣陈全成
张伟云,王明军,刘华欣,王 青,陈全成
(1.厦门医学院药学系,福建 厦门 361023;2.厦门大学药学院,福建 厦门 361102)
糖尿病是一种严重危害健康的代谢性疾病[1]。糖尿病患者中90%以上属于2型糖尿病,2型糖尿病主要特征是胰岛素抵抗和高血糖[2]。糖尿病治疗的重点是降低血糖水平,因为高血糖是糖尿病并发症的主要原因[2-3]。中药泽泻[Alismaorientalis(Samuel.) Juzep.]提取物具有较好的降糖活性[4],但具体的降糖有效成分及其作用机制尚不十分明确。倍半萜类化合物是泽泻的重要药效物质基础之一,其主要代表性成分环氧泽泻烯(结构式见Fig 1)具有抗炎作用[5]。本实验为探讨环氧泽泻烯是否具有降血糖活性,应用链脲佐菌素和烟酰胺建立了2型糖尿病小鼠模型[6]。罗格列酮通过增强胰岛素敏感性,有效控制2型糖尿病患者的血糖[7],因此,本实验选用罗格列酮作为阳性对照药。在诱导3T3-L1前脂肪细胞分化为成熟脂肪细胞后,对胰岛素的敏感性增强,新的成熟脂肪细胞加快消耗外部环境中葡萄糖。因此,前脂肪细胞被广泛应用于降血糖药物的筛选[8]。本实验采用3T3-L1前脂肪细胞分化模型,探索了环氧泽泻烯对前脂肪细胞脂分化过程的影响。
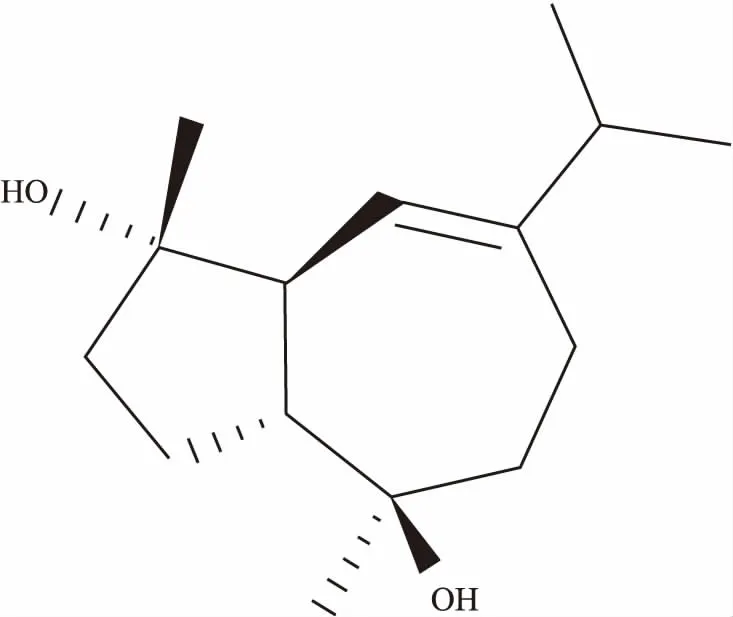
Fig 1 Chemical structure of alismoxide
1 材料
1.1 实验动物C57BL/6 ♂小鼠,5~6周龄,体质量(21~23) g,购自上海斯莱克实验动物有限公司,动物合格证号为2015000501745,适应2周后进行实验。
1.2 细胞小鼠3T3-L1前脂肪细胞,购自美国菌种保藏中心。
1.3 药物与试剂链脲佐菌素、烟酰胺、葡萄糖、胰岛素、罗格列酮、油红O和哈里斯氏苏木精染剂,购自美国Sigma-Aldrich公司;葡萄糖荧光示踪剂2-[N-(7-硝基苯-2-氧代-1,3-重氮基-4-基)氨基]-2-脱氧-D-葡萄糖(2-NBDG),购自美国Molecular Probes公司;环氧泽泻烯(纯度>98%),购自成都瑞芬思有限公司;胎牛血清、胰酶、低糖DMEM培养基,购自美国HyClone公司;其他试剂均为分析级。
1.4 仪器罗氏血糖仪(罗氏诊断产品上海有限公司); IFS-110-8型CO2恒温培养箱(新加坡ESCO公司);荧光显微镜XTZ-Y3(上海天珠光学仪器厂)。
2 方法
2.1 2型糖尿病模型的诱导参照文献方法[4],将C57BL/6 ♂小鼠禁食过夜后,腹腔注射240 mg·kg-1烟酰胺,15 min后,腹腔注射100 mg·kg-1链脲佐菌素诱导2型糖尿病模型。2 d后再次腹腔注射相同剂量的烟酰胺和链脲佐菌素。通过测试3周后小鼠空腹血糖值和d 22口服葡萄糖耐受试验期间空腹血糖值,来判断2型糖尿病模型是否诱导成功。与空白对照组相比,腹腔注射烟酰胺和链脲佐菌素的小鼠空腹血糖值均高于11.1 mmol·L-1,则提示2型糖尿病小鼠建模成功,并将成模后的小鼠随机分为糖尿病模型组、10 mg·kg-1罗格列酮组、环氧泽泻烯组(5、10、20 mg·kg-1),每组8只小鼠,用于灌胃给药和测定相应组小鼠血糖浓度、体重。每组分别按照下列方式灌胃3周。空白对照组正常小鼠和2型糖尿病模型组每日灌胃生理盐水,罗格列酮组每日灌胃罗格列酮10 mg·kg-1,环氧泽泻烯组按小鼠体重灌胃相应剂量的环氧泽泻烯。
2.2 造模期间血糖浓度测定第1次注射烟酰胺和链脲佐菌素前,采集小鼠血液20 μL,注射后的每7 d采集1次血液,即在d 0、7、14、21,分别使用血糖测试仪测量血糖浓度。d 22进行口服葡萄糖耐量试验,小鼠禁食过夜后,各组分别灌胃2.0 g·kg-1的葡萄糖溶液,然后,在灌胃葡萄糖溶液前(0 min),以及灌胃葡萄糖溶液后的第30、60、120 min,分别采集各组小鼠血液标本,测定血糖浓度。d 21空腹血糖值和d 22口服葡萄糖耐量试验中,血糖值均高于11.1 mmol·L-1的小鼠作为模型组小鼠。
2.3 口服葡萄糖耐量试验各组灌胃给药后的d 22进行口服葡萄糖耐量试验。小鼠禁食过夜后,空白对照组、糖尿病模型组均灌胃生理盐水,阳性对照组灌胃10 mg·kg-1罗格列酮,测试组分别灌胃5、10、20 mg·kg-1环氧泽泻烯,2 h后,各组分别灌胃2.0 g·kg-1的葡萄糖溶液,然后,在灌胃葡萄糖溶液前(0 min),以及灌胃葡萄糖溶液后的第30、60、120 min,分别采集各组小鼠血液标本,测定血糖浓度。
2.4 环氧泽泻烯对2型糖尿病小鼠降糖活性的测定通过测定灌胃给药前(d 0)和灌胃给药后d 7、14、21的空腹血糖水平,比较阳性对照药罗格列酮及环氧泽泻烯不同剂量对2型糖尿病小鼠血糖浓度的影响。
2.5 体重测定2型糖尿病模型建立过程中和模型建立之后灌胃给药期间,测定和记录各组动物体重。
2.6 细胞培养小鼠3T3-L1前脂肪细胞用添加10%热灭活胎牛血清的DMEM培养基,于37 ℃、5% CO2的细胞培养箱中培养。
2.7 油红O染色参照文献方法[9],3T3-L1前脂肪细胞诱导分化为脂肪细胞。首先,将3T3-L1前脂肪细胞按照4×103个细胞/孔的标准接种到96孔板,用无血清的DMEM培养24 h后,再换成含10%胎牛血清和1 μmol·L-1胰岛素的DMEM,并分别用含有环氧泽泻烯(0.5、1 μmol·L-1)、罗格列酮(0.5、1 μmol·L-1)的DMEM培养3 d。对照组细胞不需要用其他药物处理,只用1 μmol·L-1胰岛素处理。各组细胞培养12 d后,用油红O溶液染色。首先在室温条件下,用10%福尔马林溶液固定细胞1 h,然后用油红O溶液染色细胞2 h,再用苏木精-伊红染色15 min。接着用60%异丙醇溶液清洗细胞3次,以去除未结合细胞的染料。最后,将细胞置于显微镜下拍摄图像(400×)。
3 结果
3.1 建立2型糖尿病小鼠模型期间的小鼠体重变化在造模期间,分别记录各组小鼠的体重。与空白对照组相比,2型糖尿病模型组小鼠体重有所下降, 但差异并无显著性。
3.2 环氧泽泻烯对2型糖尿病小鼠血糖的影响罗格列酮10 mg·kg-1剂量组连续每天给药1次,与2型糖尿病模型组小鼠相比,d 0(给药罗格列酮之前)和给予罗格列酮的d 7、14、21的血糖明显降低。环氧泽泻烯10 mg·kg-1剂量组比5 mg·kg-1剂量组的降血糖活性稍好,但差异无显著性(P<0.05),而20 mg·kg-1剂量组降血糖活性与10 mg·kg-1剂量组相近(Fig 2)。
3.3 环氧泽泻烯对2型糖尿病小鼠口服葡萄糖耐受试验的影响为了测定环氧泽泻烯对葡萄糖耐受和胰岛素分泌的影响,对2型糖尿病模型组和药物组进行了口服葡萄糖耐受试验。与2型糖尿病模型组相比,每日给予剂量10 mg·kg-1且持续21 d的罗格列酮组于d 22的口服葡萄糖耐受试验中,第30 min和60 min明显地降低了小鼠血糖值,每日给予10、20 mg·kg-1且持续21 d的环氧泽泻烯组于d 22的口服葡萄糖耐受试验中,第30 min和60 min也体现出降低血糖的趋势。每日给予5 mg·kg-1环氧泽泻烯组在持续给药21 d后,在口服葡萄糖耐受试验中也体现出降低血糖的活性,但是与2型糖尿病模型组相比,降血糖活性并不明显(Fig 3)。
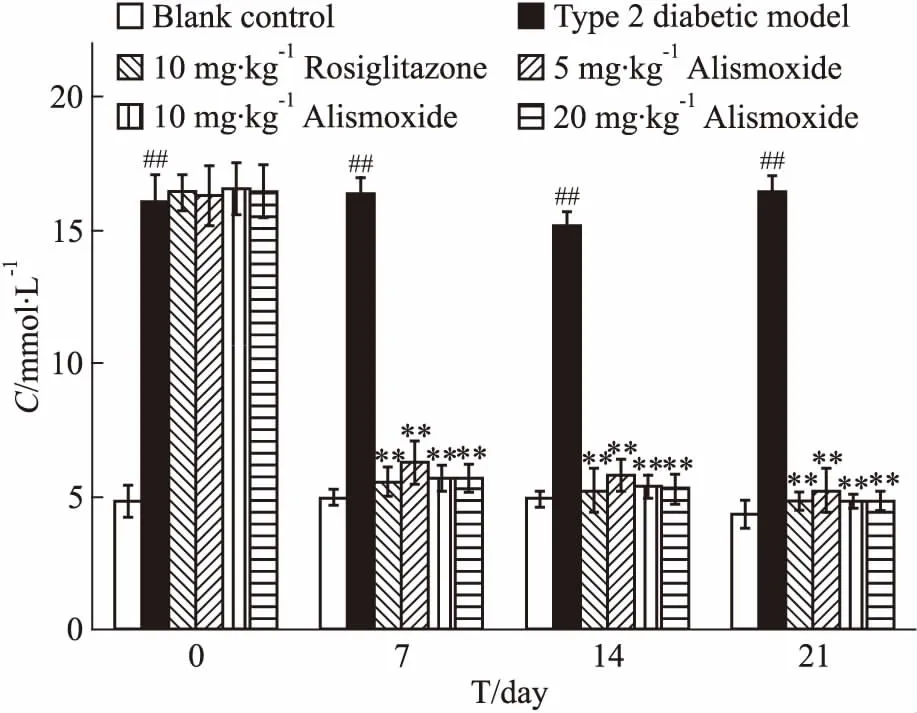
Fig 2 Influence of alismoxide on blood
##P<0.01vsblank control group;**P<0.01vstype 2 diabetic model group
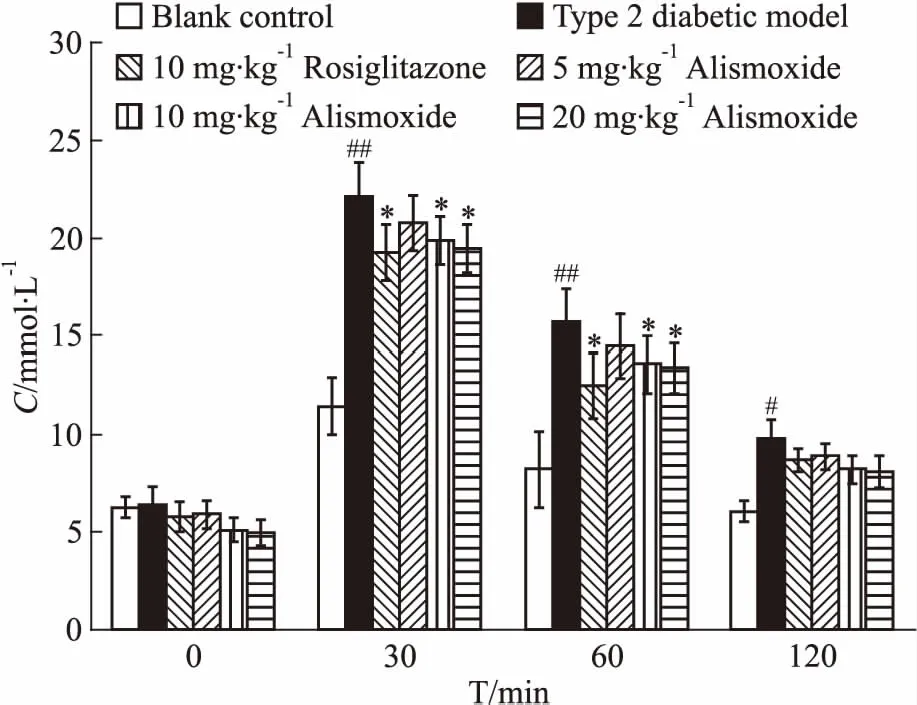
Fig 3 Influence of alismoxide on blood
#P<0.05,##P<0.01vsblank control group;*P<0.05vstype 2 diabetic model group
3.4 环氧泽泻烯对2型糖尿病小鼠体重的影响与2型糖尿病模型组比较,每天灌胃10 mg·kg-1罗格列酮或环氧泽泻烯并没有对小鼠体重产生明显的影响(Fig 4)。
Fig 4 Effect of alismoxide on body
3.5 环氧泽泻烯对3T3-L1前脂肪细胞分化的影响如Fig 5所示,与空白对照组和对照组相比,罗格列酮促进了3T3-L1前脂肪细胞分化过程,并呈现浓度依赖趋势。环氧泽泻烯(0.5、1 μmol·L-1)也加速了3T3-L1前脂肪细胞分化过程,并且展现出比罗格列酮更强的趋势。
4 讨论
目前,临床用于血糖控制的口服抗糖尿病西药均有不同程度的不良反应或副作用[10],而中药治疗2型糖尿病及其并发症具有良好的临床疗效和应用前景[11]。据报道,植物多糖、生物碱、黄酮、苷类、肽类等具有降血糖活性[12-13],但是具体的活性物质及其作用机制尚不明确。因此,从中药资源中寻找具有明确机制的、安全的活性物质用于防治2型糖尿病迫在眉睫[14]。作者前期研究结果表明,灌胃给予泽泻乙酸乙酯萃取层不仅能降低2型糖尿病小鼠空腹血糖,而且在口服葡萄糖耐量试验期间降低血糖[4],但是具体的有效活性物质还需深入探索。本实验通过2型糖尿病小鼠模型和3T3-L1前脂肪细胞模型,探索了泽泻中具有降低血糖活性的有效成分。
通过测定并对比空白对照组和2型糖尿病模型组小鼠血糖值,从而确定2型糖尿病小鼠模型是否建立成功,选择空腹血糖值高于11.1 mmol·L-1的小鼠作为2型糖尿病模型[15]。结果显示,2型糖尿病模型组小鼠在腹腔注射烟酰胺和链脲佐菌素后的d 21,空腹血糖值均高于11.1 mmol·L-1,且明显高于空白对照组小鼠血糖值。在口服葡萄糖耐受试验的0、30、60、120 min,2型糖尿病模型组小鼠血糖值均高于空白对照组,提示2型糖尿病模型组小鼠对胰岛素敏感性降低,证明成功建立2型糖尿病模型。
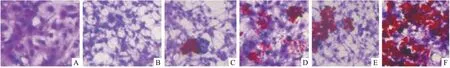
Fig 5 Effect of alismoxide on 3T3-L1 preadipocyte differentiation(×400)
Representative images of Oil Red O-stained pre-adipocytes of blank control group(A), differentiated 3T3-L1 adipocytes in control group(B), and cells treated with 0.5 μmol·L-1rosiglitazone(C), 1 μmol·L-1rosiglitazone(D), 0.5 μmol·L-1alismoxide(E), and 1 μmol·L-1alismoxide(F).
每日按照2型糖尿病小鼠体质量灌胃10 mg·kg-1罗格列酮1次,持续灌胃21 d后的血糖明显低于d 1灌胃给药前的血糖值。每日按照2型糖尿病小鼠体重灌胃1次,持续灌胃21 d后的环氧泽泻烯(5、10、20 mg·kg-1)组的小鼠血糖值均低于d 1灌胃给药前的血糖值,提示环氧泽泻烯对2型糖尿病小鼠具有降血糖活性的潜力。
为探索环氧泽泻烯对胰岛素的敏感性,在连续灌胃罗格列酮或环氧泽泻烯3周后,将小鼠禁食过夜,于d 22进行了口服葡萄糖耐受试验。在口服葡萄糖耐受试验过程中,连续21 d每日灌胃给予罗格列酮10 mg·kg-1组、环氧泽泻烯(10、20 mg·kg-1)组的2型糖尿病小鼠均呈现血糖降低的趋势,因此推断环氧泽泻烯具有类似罗格列酮降血糖的活性。脂肪细胞油红O染色结果显示,在0.5、1 μmol·L-1浓度下,环氧泽泻烯促进3T3-L1前脂肪分化,这可能有利于增强胰岛素的敏感性,但需实验进一步验证。
本实验探索了环氧泽泻烯对空腹血糖值、口服葡萄糖耐受试验过程中血糖值、3T3-L1前脂肪分化过程的影响,提示环氧泽泻烯具有降血糖的潜力,促进脂肪分化,但其具体作用机制需要深入研究。