高盐抑制胸主动脉内皮细胞一氧化氮生成及其机制
2019-09-13韩锡萍
韩锡萍,张 鹏,于 凡,冯 磊,马 鑫
(江南大学1. 药学院、2. 无锡医学院,江苏 无锡 214122)
目前研究认为,瞬时受体电位(transient receptor potential,TRP)离子通道是一类在细胞膜上分布的非选择性阳离子通道,参与内皮细胞功能稳态的调控[1]。瞬时受体电位香草素4(transient receptor potential vanilloid 4,TRPV4)通道是TRP通道家族香草素亚家族(TRPV)成员,其在内皮细胞中参与调节多种血管功能,包括应答血流剪切力、调节血管张力、机械信号传导及血管新生等[2]。高盐摄取是许多常见疾病的诱导因素,降低高盐的摄入可降低血压并改善心血管功能[3]。已有研究表明,通过喂食Wistar大鼠高盐饲料,发现当高盐饮食导致血压大幅升高时,内皮细胞中由TRPV4介导的血管舒张功能下调,甚至被全面抑制[4]。这些研究表明,TRPV4通道在高盐摄入所引起的内皮功能失调中发挥重要的作用。
一氧化氮(nitric oxide,NO)是健康的内皮细胞产生的气体递质。研究表明,在冠状动脉中,NO可以抑制其异常收缩;在血管内皮细胞中,NO可以起到松驰血管平滑肌和舒张血管的作用[5-7]。内皮细胞中的NO主要由内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)催化L-精氨酸产生,该酶活性对Ca2+浓度有依赖性[8]。Ca2+是细胞内重要的第二信使,其浓度调节主要受胞内钙库Ca2+释放和胞外Ca2+内流控制,钙库释放速度快,但维持时间短;而钙内流可以使细胞内钙持续增高,调节长期的细胞效应,如细胞内NO合成等[9-10]。这些研究表明,Ca2+通过影响eNOS的活性,对NO的生成产生重要的作用,从而调节血管内皮的功能。
TRPV4与NO均参与血管功能调节,然而,对于高盐模型下,TRPV4对NO的具体影响目前尚未完全清楚。我们猜测高盐模型下,内皮细胞中的TRPV4通道受到影响,对NO存在一定的作用,从而影响到血管的功能。因此,我们在细胞水平上诱导高盐模型,发现胸主动脉内皮细胞中TRPV4介导的Ca2+内流下降,NO的生成减弱,进而在血管内皮功能失调过程中产生影响。
1 材料与方法
1.1 材料
1.1.1实验动物 健康野生型C57BL6/J小鼠30只,♂,4~8周龄,体质量(20~25) g,购自南京模式动物研究所,许可证编号:SYXK(苏)2016-0012。小鼠饲养在江南大学无锡医学院动物中心的SPF级动物饲养屏障环境中,环境湿度维持在50%,温度保持在25 ℃左右,自由进食饮水,通过灯光控制系统,使其在每天50%光照时间与50%黑夜时间交替中生活。将30只小鼠随机均分成两组,各3笼,每笼5只。
1.1.2试剂 NaCl(10019318),购自沪试公司;甘露醇(BL-SJ-0243),购自上海博光生物科技有限公司;ECM培养基(1001),购自Lonza公司;HBSS(C0218),购自碧云天公司;胶原蛋白酶(C9891)、TRPV4激动剂GSK1016790A(G0798)、TRPV4抑制剂HC067047(4100/50),购自Sigma公司;Fluo-4(F14201)、DAF-FM DA(D23844),购自Invitrogen公司。
1.1.3仪器 低速离心机、生物安全柜、细胞培养箱(美国Thermo公司);倒置显微镜(日本Nikon公司);激光共聚焦显微镜(德国Leica公司);纯水仪(美国Millipore公司)。
1.2 方法
1.2.1原代胸主动脉内皮细胞的分离及培养 利用颈椎脱臼法使小鼠迅速死亡,分离小鼠胸主动脉血管于无菌PBS中。将胸主动脉血管于生物安全柜中剪成3 cm左右的小片段,然后将其转移至10 mL无菌离心管中,离心管中含5 mL消化液(PBS ∶胶原酶=500 ∶1)。在37 ℃震荡水浴锅中快速消化15~20 min。然后将液体转移至10 mL无菌离心管中,1 200 r·min-1离心5 min,小心吸出上清并弃之,加入1 mL ECM完全培养基重悬,将混悬液转移至6孔板中,补加1 mL ECM完全培养基,轻轻摇晃混匀,置于37 ℃、5% CO2细胞培养箱中培养。1 h后待胸主动脉内皮细胞贴壁后,用无菌PBS洗涤3~5次,并加入2 mL ECM完全培养基继续培养。
1.2.2高盐细胞模型的诱导 称取NaCl粉末溶于ECM完全培养基中,使其浓度为60 mmol·L-1,用0.22 μm的无菌滤头过滤。将6孔板中的胸主动脉血管原代内皮细胞胰酶消化,1 200 r·min-1离心5 min,用60 mmol·L-1NaCl培养基重悬于激光共聚焦小皿中培养48 h。
1.2.3Ca2+标记 将分离得到的细胞铺于共聚焦小皿中培养48 h,HBSS洗涤3遍。用HBSS配制Fluo-4(母液:625 μmol·L-1),按1 ∶200稀释,每皿加入200 μL于培养箱中避光孵育30 min,然后将工作液弃去,HBSS洗涤3遍,加入800 μL HBSS并在共聚焦显微镜下观察。配制GSK1016790A(TRPV4激动剂)为1 ∶200(工作浓度为1 μmol·L-1),待调好焦距拍摄1 min左右后,加入200 μL工作液观察荧光的变化。
1.2.4NO标记 将分离得到的细胞铺于共聚焦小皿中,用HBSS配制DAF-FM DA工作液为1 μmol·L-1,将共聚焦小皿用HBSS溶液洗涤3遍,每皿加入200 μL DAF-FM DA工作液,于培养箱中避光孵育10 min,然后将工作液弃去,HBSS洗涤3遍,加入1 mL HBSS在共聚焦显微镜下观察荧光。
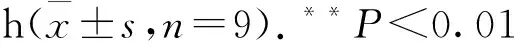
2 结果
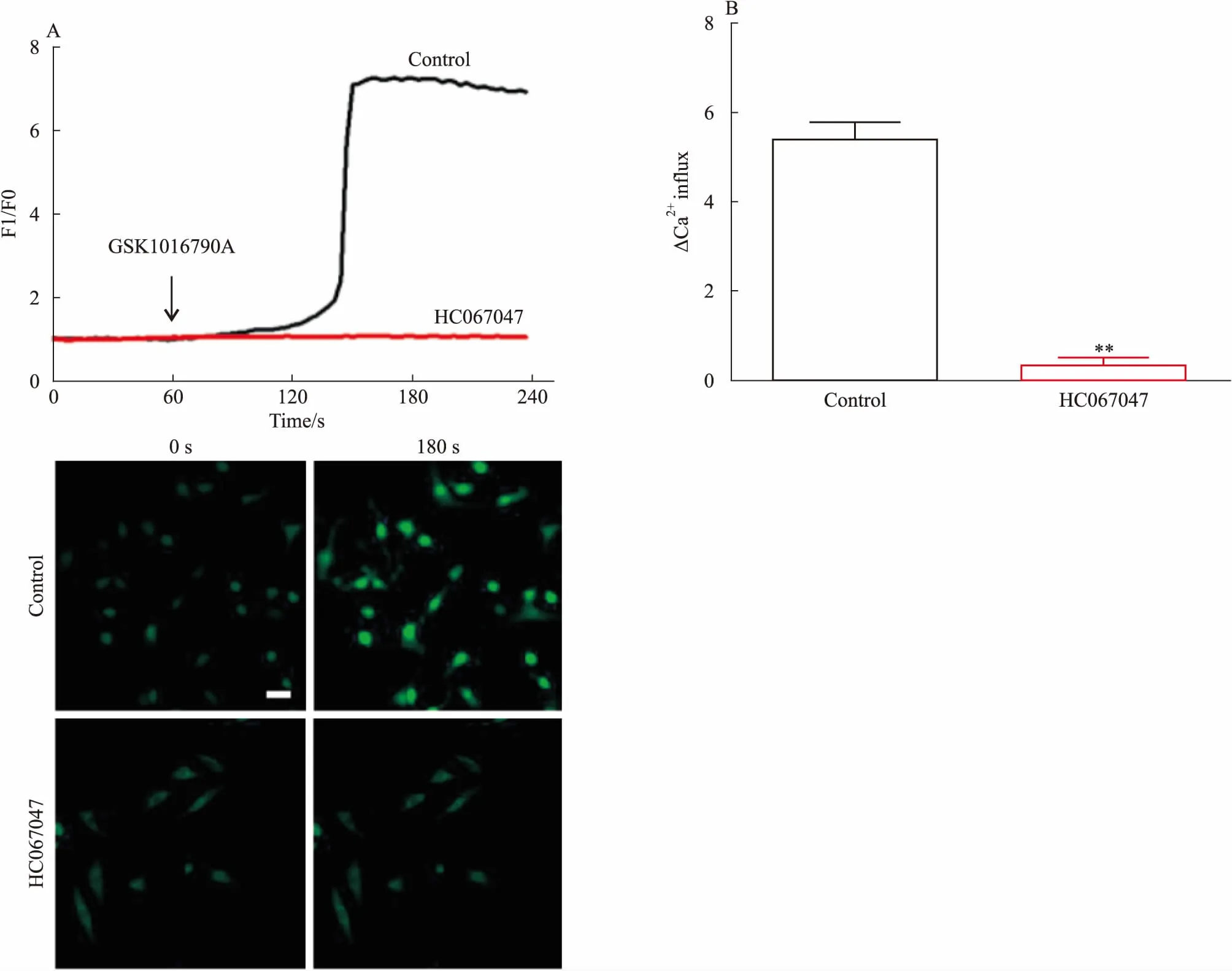
2.1 抑制TRPV4后胸主动脉内皮细胞Ca2+内流下降用TRPV4的抑制剂HC067047(10 μmol·L-1)预孵育胸主动脉内皮细胞1 h后,Fluo-4钙离子荧光探针标记30 min,于共聚焦显微镜下观察,待拍摄1 min后加入TRPV4的激动剂GSK1016790A,发现对照组钙离子浓度明显增加,180 s时对照组钙离子浓度达到最大值,而HC067047组钙离子浓度无明显变化(Fig 1A)。统计结果显示,对照组相对最大荧光值强度明显高于HC067047组,差异有统计学意义(Fig 1B)。表明抑制TRPV4后,胸主动脉内皮细胞Ca2+内流下降。
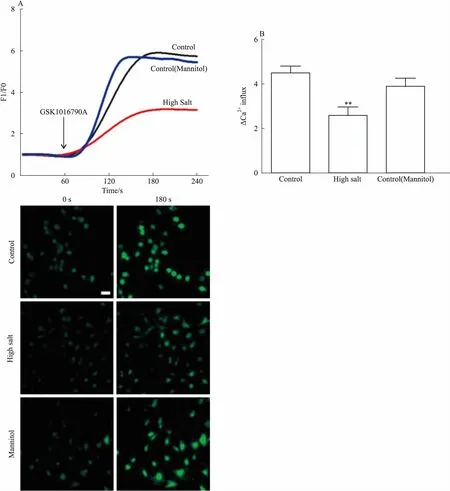
2.2 高盐抑制胸主动脉内皮细胞中TRPV4介导的Ca2+内流通过Fluo-4钙离子荧光探针对胸主动脉内皮细胞进行标记,在共聚焦显微镜下拍摄1 min后,加入TRPV4的激动剂GSK1016790A,发现180 s左右时对照组与高盐诱导组钙离子浓度均达到最大值,但高盐组上升幅度明显低于对照组(Fig 2A)。统计结果显示,高盐组的相对最大荧光值明显低于对照组,且差异有统计学意义(Fig 2B)。同渗透压甘露醇组(120 mmol·L-1)与对照组差异无统计学意义,表明高盐导致TRPV4介导的Ca2+内流减少,并且其作用与渗透压无关。
2.3 抑制TRPV4后胸主动脉内皮细胞NO的生成下降用TRPV4的抑制剂HC067047(10 μmol·L-1)预孵育胸主动脉内皮细胞1h后,DAF-FM DA一氧化氮荧光探针对胸主动脉内皮细胞标记10 min,在共聚焦显微镜下观察,控制荧光强度相同的情况下,HC067047组明显比对照组暗(Fig 3A)。结果统计显示,HC067047组的荧光值明显低于对照组,且差异具有统计学意义(Fig 3B)。表明抑制TRPV4后,胸主动脉内皮细胞NO的生成减弱。
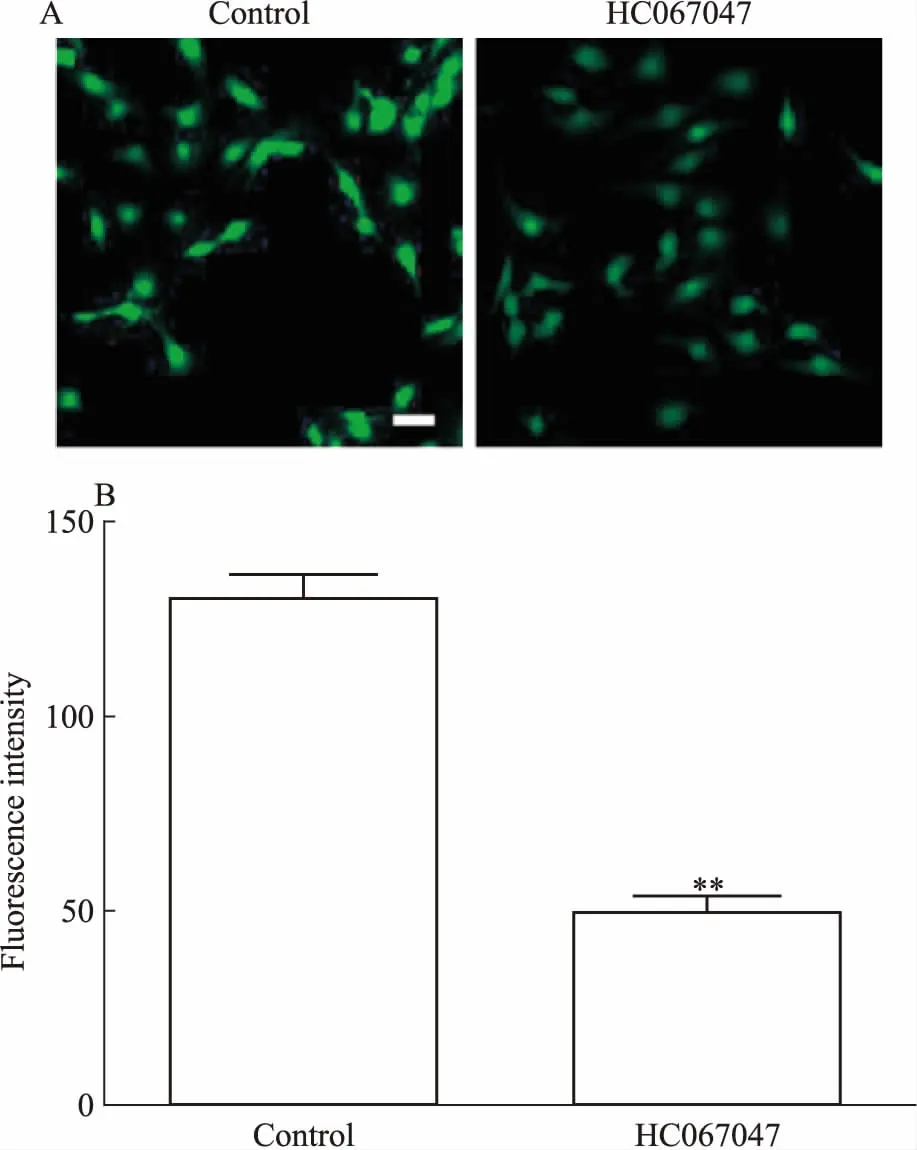
Fig 3 Decreased production of NO in thoracic aorticendothelial cells after inhibition of TRPV4
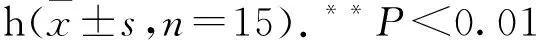
2.4 高盐抑制胸主动脉内皮细胞NO的生成通过DAF-FM DA NO荧光探针对胸主动脉内皮细胞进行标记,于共聚焦显微镜下进行观察,在相同的荧光强度下,对照组明显比高盐组亮(Fig 4A)。统计显示,高盐组的荧光值明显低于对照组,且差异具有统计学意义(Fig 4B)。同渗透压甘露醇组与对照组差异无统计学意义,表明高盐导致NO的生成减少,并且其作用与渗透压无关。
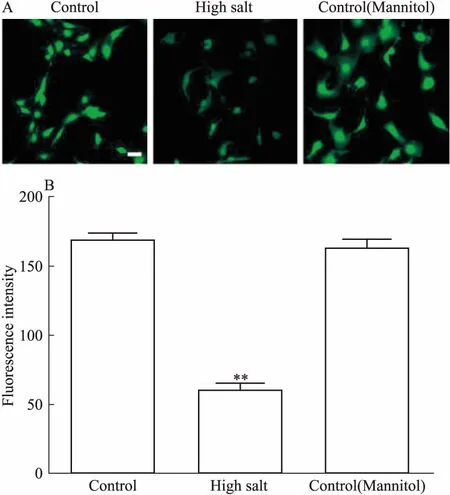
Fig 4 NO production inhibited by high saltin thoracic aortic endothelial cells

3 讨论
研究发现,在内皮细胞中,TRPV4对调节血管内皮细胞的功能稳态非常重要。TRPV4与TRPC1形成复合体是小动脉内皮细胞应答血流剪切力的关键分子[11]。NO通过cGMP/PKG负反馈调控通路,抑制TPRV4-TRPC1复合体的功能,进而维持内皮细胞的功能稳态[12]。猪冠状动脉平滑肌细胞和人内乳动脉平滑肌细胞中,TRPV4-TRPC1-KCa1.1功能复合体在维持血管功能稳态中具有重要作用[13-14]。最近的研究发现,在高血压病理状态下,内皮细胞中TPRV4-KCa2.3复合体解偶联,其调节的血管内皮舒张功能减弱是高血压发生的起始因素。NOS的活性对于NO的生成以及在血管中的作用具有巨大的影响[15]。TRPV4与NO均参与血管功能的调节,但TRPV4对NO的影响还不够详细,因此,本实验探究在高盐模型下,TRPV4对NO产生的影响。本实验研究结果表明,抑制TRPV4后,钙离子内流基本被废除,NO的生成大大降低。高盐诱导的胸主动脉内皮细胞模型中,TRPV4介导的Ca2+内流减少,从而抑制NOS的活性,进一步引起NO生成的减少。NO是一种有效的血管扩张剂以及重要的信号分子,其在血液循环中充当着重要的角色,高盐下通过抑制TRPV4通道引起的NO生成的减少,在某种程度上为揭示高血压形成原因提供了一个新的假想,为研究血管功能失衡提供了一个新的研究思路。
我们通过在ECM培养基中添加NaCl,使其浓度为60 mmol·L-1,将内皮细胞的培养基换成该含盐培养基培养48 h后,诱导形成高盐模型模拟病理状态。在该浓度下,细胞的形态与正常细胞类似,不会引起其形态的改变以及死亡。通过钙离子荧光探针Fluo-4对钙内流研究发现,加入TRPV4激动剂GSK1016790A后可以增加钙内流,但高盐组的幅度明显低于对照组,从而导致NOS活性降低,进一步导致NO的生成减少。通过DAF-FM DA对NO进行标记,发现相同荧光强度下,高盐组的荧光明显比对照组弱,进一步佐证高盐诱导会导致NO的生成减少。上述实验结果与抑制TRPV4所得到的结果一致,因此,可以推断高盐诱导抑制TRPV4的功能,从而导致内皮细胞钙内流减少,NOS活性降低,NO的生成降低。但该研究还有待于深入,此研究着眼于高盐模型下内皮细胞中的TRPV4对NO生成的影响及其机制,为血管功能稳态的失衡提供了新的研究思路及方向。
(致谢:本文实验在江南大学无锡医学院心血管研究室完成,感谢所有实验参与人员的大力帮助!)