单分子技术在G蛋白偶联受体二聚体中的应用
2019-09-13王春勇王德秀苏文霞王凤斌
蔡 欣,王春勇,王德秀,苏文霞,鲁 洪,王凤斌
(1. 潍坊医学院临床医学院生理学教研室,山东 潍坊 261053; 2. 寿光市人民医院肾内科,山东 寿光 262700)
G蛋白偶联受体(G protein-coupled receptors,GPCRs)构成最大的细胞膜受体超家族,是重要的药物靶点,其相关药物占市场上药物的40~50%。大量研究表明,GPCRs不仅能以单体的形式发挥生物学作用,也可以相互作用形成同源/异源二聚体,甚至高阶寡聚体,并具有独特的功能,如Apelin受体(putative receptor protein related to AT1,APJ)和血管紧张素1型受体(angiotensin Ⅱ type 1 receptor,AT1R)形成的异源二聚体,配体Apelin能通过该二聚体,抑制血管紧张素介导的动脉粥样硬化[1]。目前,GPCR二聚化的研究方法有很多,如免疫共沉淀、共振能量转移等,这些技术能隐藏“噪音”,平均计算GPCR二聚体的潜在差异和异常,衡量其不同物理或化学状态,但这些方法也隐藏了“噪音”中所含有的有价值信息,失去关于生物异质性的有用数据。如用于表达GPCRs的细胞,尽管培养的细胞具有遗传一致性,但本质上成分仍是异质的,这种异质性在物种进化上是非常重要的,能使生物体在波动的环境中迅速适应,给生物体带来生物优势,最终生存下来。但这些方法需要较高的受体表达水平,受体过表达可能改变生理特性,引起不依赖配体的受体激活等。相比较而言,单分子技术提供了一个直接的窗口,并能克服样品同步性的需求,通过记录受体复合物的荧光强度或追踪随着时间变化的运动轨迹,更详细和系统地研究细胞膜上GPCR二聚体的亚单位组成、轨迹均方位移、扩散系数等,从而揭示罕见的中间状态和隐藏的动力学途径[2],这些是GPCRs实现不同的新功能和多种生理功能所必需的基础,也是药物设计的重要靶点。本文将对研究GPCR二聚化的单分子技术进行简要综述。
1 GPCR二聚体在药理学方面的重大潜力
传统观点认为,GPCRs的信号通路是线性的,即正位激动剂与受体的正位作用位点结合,激活G蛋白,引起一系列下游信号转导反应,但是由于正位作用位点保守性很强,正位激动剂与其结合的亲和力较大,因此目前很难对正位激动剂进行新药开发。近几十年,研究人员将目光转向了一种新作用位点——别构位点,别构调节剂与受体的别构位点结合,使受体构象发生变化,导致与该受体相互作用的蛋白功能改变,别构位点的出现不会影响正位激动剂与正位作用位点的结合,反而会调节正位激动剂的药理学作用。研究发现,在GPCR二聚化中,一个受体被刺激后,通过别构调节,调节另一个受体的正位配体的药理学特性,从而改变下游信号传导,如AT1R-B2R异源二聚化可增加AT1R对AngⅡ的反应性,这对先兆子痫综合症的发生起关键作用[3]。在GPCRs中,结构不对称会引起空间限制,影响信号复合体的排列,并最终在变构功能中发挥作用。单粒子追踪方法显示,A1/A2AR异源二聚体以菱形排列,这种不对称结构对下游信号和功能具有重大影响。最近的一项研究发现,在Ghrelin受体和多巴胺D2受体(dopamine D2receptor,D2R)形成异源二聚体中,Ghrelin受体作为变构调节剂,而不是信号受体,明显改变D2R的信号[4],该结果可以解释异源二聚体在标准药物筛选中很难检测到的原因,其中一个受体可能只是另一个受体的变构调节剂,而不是作为信号受体传递自己的信号。
GPCR二聚体具有非常大的药物潜力,因此备受关注,其药理学作用也越来越受到重视。阿片类受体二聚体的药理学作用已被证明,研究发现,阿片受体的激动剂6′-Guanidinonaltrindole(GNTI)不能单独激活κ阿片受体(κ opioid receptor,κOR)或δOR,却能选择性地激活κOR-δOR异源二聚体,异源二聚体的组织特异性强,能够降低药物的副作用,将6′-GNTI注射到老鼠脊髓内可以观察到镇痛作用,所以κOR-δOR异源二聚体的研究有利于镇痛药的研发[5]。目前,作用于κOR-δOR异源二聚体的二价配体药物也在被研发,提供了潜在的新疗法。二价配体包含了通过间隔连接的κOR选择性拮抗剂5′-GNTI和δOR选择性拮抗剂纳曲吲哚(naltrindole)[6]。众所周知,α1肾上腺素能受体(α1adrenergic receptor,α1AR)能够调节血管功能,在临床上可以靶向控制血压。最近研究表明,CXCR4的跨膜肽TMD2能够阻断CXCR4-α1AR二聚体的形成,从而抑制α1AR对血管平滑肌收缩作用[7]。靶向GPCR二聚体的药物有望能够治疗多种疾病,虽然目前取得的成果不多,但随着GPCR二聚体知识的不断增长,会取得更多的成果。
2 GPCR二聚体的时空动态新型检测法——单分子技术
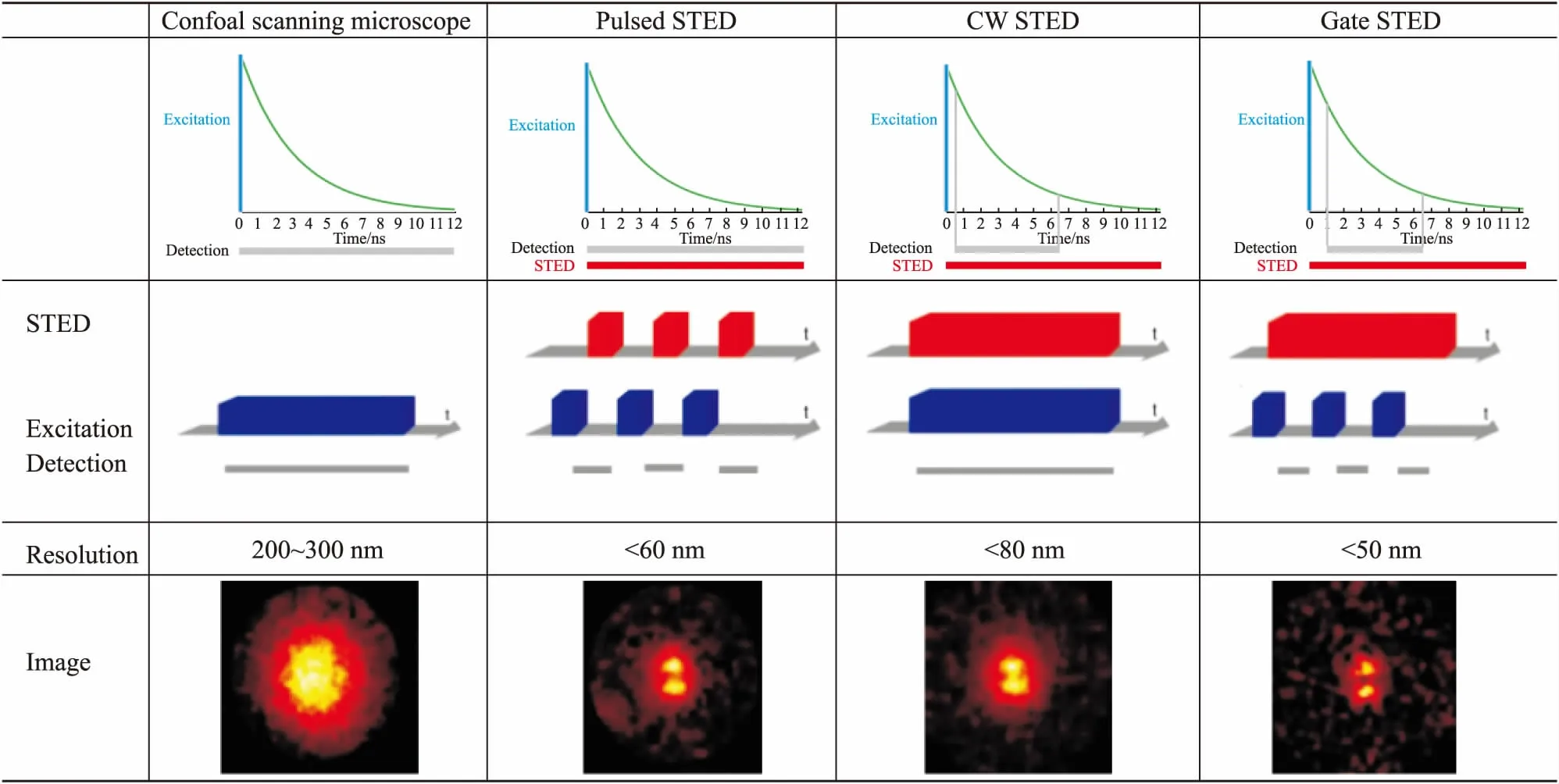
2.1 全内反射荧光显微技术(total internal reflection fluorescence microscopy,TIRFM)对于所有分子来说,必须先通过细胞膜才能进出细胞,因此,在细胞膜上或附近发生着许多生物学过程。传统的显微镜技术(如荧光显微镜和激光共聚焦显微镜等)很难对这些过程进行成像,但TIRFM能够分析活细胞膜附近一些分子的定位情况和动力学过程,如膜蛋白定位、胞吞过程等。其原理是当一束光从光密介质进入光疏介质时,根据斯涅耳定律,一部分光会发生折射,而一部分光会发生反射,当入射角不断增大,折射角也会不断增大,当折射角刚好达到90度时,就发生了全反射现象。全反射发生后,光波不会被反射回第一介质,由于光的波粒二相性,其中一部分能量会进入折射率较小的介质,沿着折射面传播,这部分光我们称为隐失波,其能量在Z轴上呈指数衰减(Fig 1A)。因此,隐失波在照明样品时,仅激发样本表面薄层范围内的荧光基团,同时减弱来自胞内区域的荧光,使显微成像在Z轴上的空间分辨率得到明显改善,Z轴分辨率可达40~150 nm,大大提高了图像的信噪比[8]。
TIRFM能够提供纳米级的分辨率和极快速的成像,用于微小结构和单分子成像,如细胞膜上单个蛋白质动力学研究、细胞结构成像等。目前,应用TIRFM从单分子层次对GPCR二聚体的结构与功能进行研究,发现N-甲酰肽受体(N-formyl peptide receptor,FPR)同源二聚体的解离和2D结合速率分别为11.0 s-1和3.1[copies/μm2]s-1,在1 s内,FPR就能完成单体和二聚体相互转化的过程[9]。TIRFM与SNAP-tags技术联合使用,发现β-AR二聚体(20.5 ℃)寿命约为4 s,比FPR二聚体(37 ℃)长约40倍,比毒蕈碱M1受体二聚体(23 ℃)长约6倍[10]。由于膜蛋白的连续和随机运动,蛋白分子之间会发生随机碰撞,因此要控制分子的表达水平。本课题组利用TIRFM发现APJ能以单体、同源二聚体和寡聚体的形式存在,且在颗粒密度小于0.3颗粒/μm2的情况下,单体、二聚体和寡聚体分别占有不同比例。另外,单个APJ之间存在瞬时相互作用,不断形成和分解新的受体复合物[11](Fig 1B、1C)。
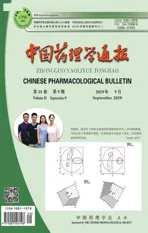
2.2 受激发射损耗(stimulated emission depletion, STED)显微技术虽然传统显微镜(如荧光显微镜和激光共聚焦显微镜等)和TIRFM能够解决生命科学领域的很多问题,但是衍射现象限制了他们的空间分辨率,衍射极限可用Abbe′s law量化[12],公式如下:dx,y=λ/2NA;dz=2λ/NA2。dx,y指的是横向分辨率,dz指的是纵向分辨率,λ为激发光波长,NA为显微镜物镜的数值孔径。根据公式,能够清晰地计算出最高横向分辨率为180 nm,最高纵向分辨率为500 nm。Hell等在1994年提出STED概念,于2014年获得诺贝尔奖[13]。该技术能够突破这种衍射极限,Z轴分辨率可达40~150 nm,具有很大的发展潜力。其原理是样品被两束激光以高强度脉冲形式照射,第1束激光(Exc beam)用于激发荧光分子,第2束激光(STED beam)用于损耗荧光分子,将荧光分子的周围从受激状态返回到基态。损耗激光的光路产生1个呈圆环型的能量分布,即圆环型的STED光,从而大大缩小有效的荧光检测区域,使样品发射荧光的体积限制在非常小的范围内,只能检测没有完全损耗的荧光分子的中心,从而提高分辨率。这一技术可用于活细胞和固定样品的成像,在一些生物学和医学研究中发挥了重要作用,如细胞膜上和泡囊中蛋白质的分布与动态过程等。Van Laar等[14]利用STED,研究轴突内线粒体与内质网接触部位处线粒体DNA的复制,发现在帕金森相关应激条件下,线粒体生物发生会根据解剖分区的方式不同而改变,有助于神经退行性疾病的治疗。STED具有多种类型,如多色STED、脉冲STED、连续波[continuous-wave(CW)]STED和Gate STED等[15]。多色STED通过添加多个Exc beam和利用同一STED beam进行,激光束具有不同的激发光谱,但是具有相似的发射尾。脉冲STED使用脉冲式的激发光和损耗光,在短时间内发出大量的激发光,从而有效地将荧光分子周围的荧光淬灭,提高空间分辨率。一般来说,激发光的脉冲比损耗光的脉冲要短,损耗光的脉冲比荧光分子的振动驰豫的时间要长,但是比荧光分子的寿命要短。脉冲STED的优点是损耗时只需相对较低的平均功率;而且,由于较低重复频率的使用,荧光在被激发之前,在三重态驰豫中就能发出荧光,从而减少了光漂白[16]。另外,由于一些荧光的自发光能够忽略掉脉冲激光,所以连续的激光仍在被使用,CW STED用连续激光(可见光和近红外光)代替脉冲激光,降低了系统的复杂性(不需要脉冲光)和费用,增加系统的用途。CW STED中,荧光在激发状态呆的时间越长,损耗光将该荧光从受激状态返回到基态的可能性就越大,但是由于连续激光的峰强度较低,所以分辨率比脉冲STED的分辨率较低。为了解决这个问题,Gate STED应运而生,该技术将CW STED与时间门控检测联系起来,CW STED中,荧光分子被激活后,延迟一段时间后再收集荧光,那么淬灭荧光的相对概率将升高,原因是损耗光对荧光的耗损依赖于在激发态下荧光团暴露的光子数量,荧光光子在荧光团激发之后被收集,这就确保所收集的荧光源已经处于激发态至少一段时间。而时间门控可以忽略掉早期荧光的发射光子,激发荧光和收集荧光之间延迟的时间越长,越可以确保记录的主要是荧光中心的荧光团,有效空间分辨率越高(Tab 1)。
Fig1AssessmentofGPCRdimerwithTIRFMA:Principle of TIRFM. n1(refractive index of the sample) is less than n2(refractive index of the cover slip). The excitation beam enters from the left at incidence angle(θ), which is greater than the critical angle c(θc). The excitation beam is reflected off the cover-slip-sample interface and an evanescent field is generated on the opposite side of the interface in the sample. Only fluorophores in the evanescent field are excited, as indicated by the green particles; B: TIRFM image of cells expressing APJ-GFP; C: Single-molecule co-tracking of APJ homodimers by TIRFM.
2.3 单分子定位显微技术单分子定位显微技术,如基态耗尽显微术(ground state depletion,GSD)、光敏定位显微术(photoactivatable localization microscopy,PALM) 和随机光学重建显微术(stochastic optical reconstruction microscopy,STORM),能连续激活和定位荧光,从而避免光的衍射极限,主要原理是荧光信号以单分子的形式被激活,通过函数拟合,计算出单分子荧光光斑的中央位点,经过上万次循环的依次激活和计算,从而得出完整的超高分辨率图像,分辨率高达10~75 nm。该类技术缺点是需要对批量图片进行后处理算法,因而有可能产生假象。GSD通过减少同时发射荧光团的数目来克服衍射极限,成像速度为2~10 min/幅,高能激光激发荧光团标记的样品,光子轰击电子,增加“自旋翻转”的概率,使荧光团由激发态进入三重态或“暗态”,在三重态中,荧光团不发射光子,样品显得更暗,有效地耗尽了基态,因此命名为“GSD”[17]。这些荧光团可以随机地返回到基态,并且可以在返回到三重态之前,经历激发到基态跃迁的多个光子发射,在任何给定时间内,单个荧光团发射的光子在空间和时间上与相邻的荧光团不同。光子的爆发可以与高斯函数拟合,计算的质心对应于荧光团的位置,定位精度取决于透镜的数值孔径、激发光的波长和每个荧光团发射的光子数量[3]。GSD在任何时间只有一组荧光团主动发射,所以必须几分钟内收集数以千计的图像,从而建立一个完整的定位图,由于较长的采集时间与高功率激光,GSD更适合于固定的而不是活的样品。
PALM与STORM的成像速度相同,均为5~20 min/幅,二者之间的主要差异是荧光激活和成像的顺序,在PALM中,荧光被随机激活,然后成像,再激活和成像,如此进行多个循环,直到检测到目标分子的所有位置。而在STORM中,荧光激活和成像同时进行,能够明显提高数据收集的速度。PALM可用于单分子追踪,在给定时间内激发一个或极少数的荧光团,使衍射极限区域不重叠,重复激发循环直到检测到目标分子的所有位置,然后将其组装到最终图像中。目前,利用PALM发现,促黄体激素受体能预先形成同源二聚体和具有不同空间构型的寡聚体,改变寡聚体的不对称性将调节信号的敏感性和强度[18]。
Tab1DifferencesbetweenSTEDandconfocalscanningmicroscope
2.4 结构照明显微技术(structured illumination microscopy,SIM)SIM在乳腺癌细胞中检测到雌激素受体(estrogen receptor,ER)能形成同源/异源二聚体,且占有比例不同,如ERα/α同源二聚体占有23.0%、 ERα/β2异源二聚体18.1%[19]。SIM以一系列具有高空间频率的正弦条纹激光为光源,对样品进行扫描,这种光源是激光穿过可移动光栅,并通过物镜投射到样品上产生的,显微镜光路中的栅格与衍射极限下的样品结构图像叠加会产生摩尔纹,当栅格处于不同相位和角度时,摩尔纹图案也会发生变化,通过多张摩尔纹图像的计算,把低频信号转变为高频信号,重建成一个具有两倍宽场分辨率的高分辨率图像,横向分辨率提高至100~130 nm,纵向分辨率提高至280~350 nm[20]。由于受限于多次栅格旋转平移所需时间和曝光时间,SIM的成像速度小于1幅/s。
与其他超高分辨率技术相比,SIM有两个突出优势:首先,纵向分辨率的提高能明显改善焦点失调问题,提高信噪比;其次,适用染料为常规荧光蛋白,没有特定的性能要求,因此适用多色成像。在细胞生物学应用中,SIM的一个重要特征是可以使用标准染料和染色方法,通过光学切片在三个维度中同时成像多个细胞结构。但是SIM图像为多幅图片计算实现,很容易产生假象并容易引起光漂白,另外对球面像差敏感,在球面像差存在的条件下,照明图像退化,因此,在较高频率下获得的信息量减少。在玻璃、透镜浸没介质和生物样品之间折射率失配导致的球面像差中,很难观察离盖玻片较远的区域。
2.5 单分子荧光共振能量转移(single-molecule fluorescent resonance energy transfer,smFRET)FRET采用非放射方法,在供体和受体相互靠得很近(<10 nm)时,通过双偶极反应,将光子从一个受激发的荧光团(供体)转移到另一个荧光团(受体)。供体的放射光谱必须将受体的激发光谱重叠起来,适合FRET实验的常用荧光团对为CFP/YFP、GFP/罗丹明和FITC/Cy3等。采用FRET可以解决光学显微镜分辨率限制的分子相对邻近度问题,来显示蛋白质间的相互作用、一个分子内部的结构变化等。当两个染料发射波长相差很大时,采用敏化发射(sensitized emission,SE)FRET,要获得FRET图像,首先要先确定系数A和系数B,系数A主要指的是受体对FRET信号的干扰,系数B主要指的是供体对FRET信号的干扰。公式如下:Corrected FRET=RawFRET-(A×Acceptor)-(B×Donor)。本课题组利用SE FRET检测到APJ-神经降压素1型受体(neurotensin receptor type 1,NTSR1)异源二聚体的存在(Fig 2),该二聚体能通过Gαq介导,增加ERK1/2磷酸化,促进细胞增殖[21]。当两个染料发射波长相差很小,容易引起串色时,采用特定渗透FRET,公式如下:Corrected FRET=RawFRET-[(Acceptor-(Donor in Acceptor×Donor))×(Acceptor in FRET)]-[(Donor-(Acceptor in Donor×Acceptor) )-(Donor in FRET)]。
目前,在FRET基础上又延伸出其他方法,如时间分辨FRET、光漂白FRET等,但是这些技术对GPCR二聚体的研究也是按总体平均水平进行的。smFRET可通过测量供体、受体荧光光强以及二者间的共振能量转移效率,揭示标记位点间的距离[22],常用荧光团对为Cy3/Cy5、Cy3B/ATTO 647N。激光激发目的蛋白上的供体荧光分子(Cy3),供体荧光分子转移部分能量到受体荧光分子(Cy5),两者发出的荧光经分光光路,分成中心波长在568 nm和675 nm的平行两束,后被EM-CCD收集。供体与受体荧光点的信号分别成像于CCD视野的左右半区,实验后,根据其坐标对应关系将来自同一被标记物上的供体与受体荧光点匹配。Dijkman等[23]利用smFRET发现,NTSR1能形成同源二聚体,且存在浓度依赖的瞬时相互作用,具有多个亚稳态交界面。
3 总结
目前观察到的一些研究和临床现象很难确定是否为受体二聚化的作用结果,但受体二聚化是能够解释这些现象的因素之一,如一些抗帕金森和抗精神病的药物,被认为对GPCR单体具有特异性作用,但很可能对GPCR二聚体也具有特异性作用,所谓的“不纯药物”的脱靶效应可能是由于他们结合GPCR二聚体引起的。单分子技术为GPCR二聚体的研究提供了新的研究和药物研发方向,结合不断增长的GPCR二聚体结构方面的知识,将会获取更多的成果。目前有将技术结合用于研究GPCR二聚体,如本课题组将TIRFM和BiFC结合起来,检测到APJ能够形成同源二聚体。多种技术的结合在GPCRs二聚体研究中发挥了重要作用,能从“时间、空间、动态、连续”检测更多GPCRs之间的相互作用,这对于疾病发病机制的研究及新型药物靶点的发现具有深远意义[24]。
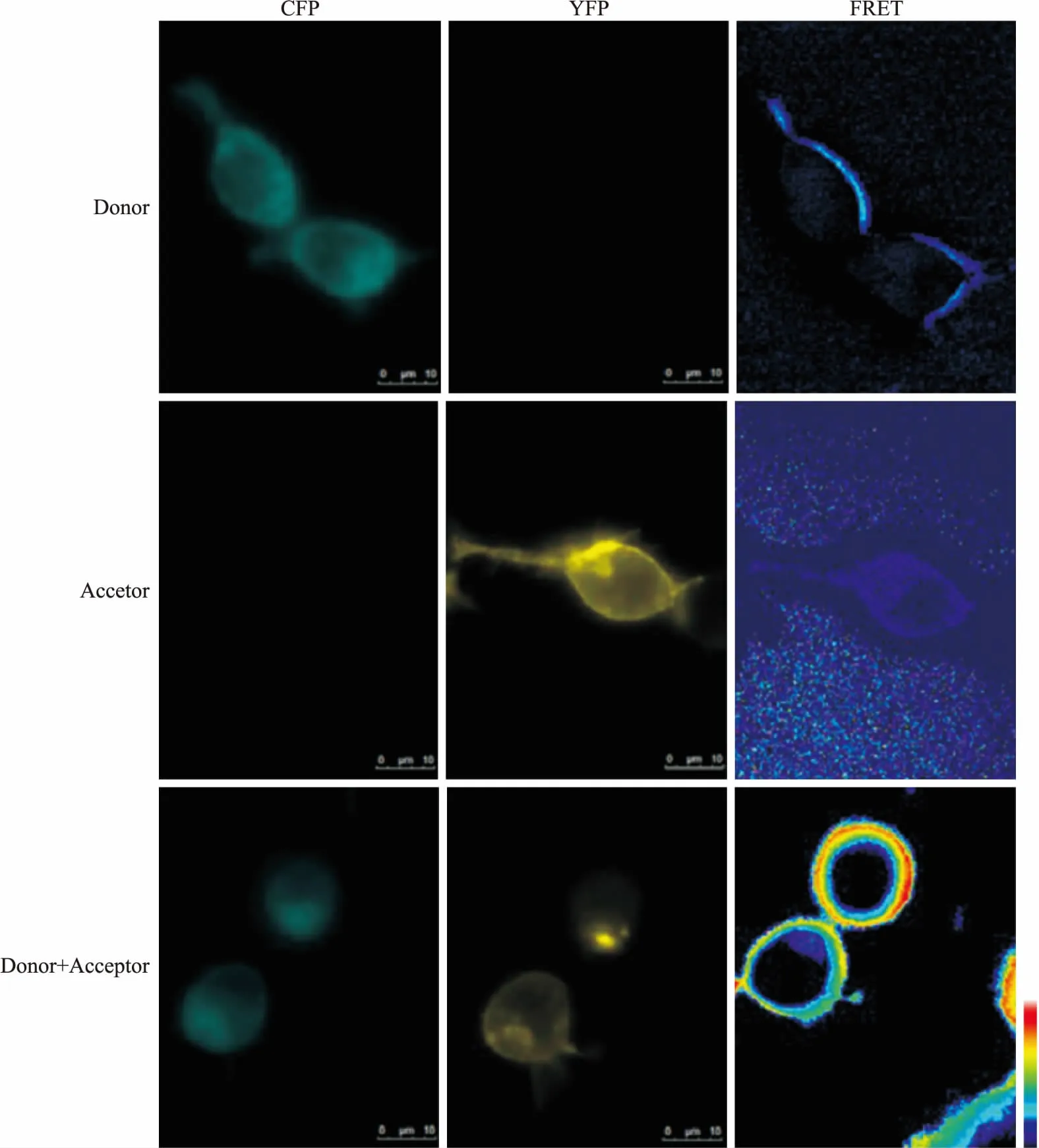
Fig 2 Assessment of APJ-NTSR1 heterodimer with SE FRET
HEK293 cells were cotransfected with pCFP-NTSR1 and/or pYFP-APJ. 24 h after transfection, and fluorescent images were acquired using MetaFluor 7.0 Software.