过氧化物酶体增殖物激活受体γ激动剂对食管鳞癌化疗敏感性影响的研究
2020-04-06何宏博刘东雷
吴 恺,何宏博,张 澎,曾 诚,刘东雷,赵 松
(郑州大学第一附属医院胸外科,河南 郑州 450052)
据2018年全球癌症统计报道,在世界范围内食管癌发病率高居恶性肿瘤第7位,死亡率高居第6位[1]。其中食管鳞癌是食管癌的主要病理类型[2]。目前,以顺铂为基础的联合化疗仍是食管鳞癌患者最为常见的化疗方案,但对顺铂化疗的不敏感是食管鳞癌患者治疗失败的主要原因,严重威胁患者的生命健康,影响预后[3-4]。因此,提高食管鳞癌的顺铂化疗敏感性,可提高提高食管鳞癌的临床治疗效果,改善预后。
过氧化物酶体增殖物激活受体γ (peroxisome proliferator activated receptor γ,PPAR-γ)是Ⅱ型核激素受体超家族的一类由配体激活的核转录因子[5]。通常与视黄素X受体形成异二聚体并招募共抑制蛋白复合物与之结合,进而抑制靶基因的转录;此外,也可与配体结合激活,释放共抑制蛋白并结合辅激活蛋白,与所调节基因的启动子上游因子结合从而对靶基因的转录进行调控,发挥生物学功能[6]。研究[7]报道,PPAR-γ可通过调控脂肪和糖代谢、能量平衡、炎症反应等抗肝纤维化、抗动脉粥样硬化、改善心衰、抗肿瘤等。
据研究[8]报道,在多种肿瘤细胞中均存在PPAR-γ的表达,经配体激活后,PPAR-γ可抑制结肠癌、乳腺癌、胃癌、胰腺癌等多种肿瘤细胞的生长。有研究[9]报道PPAR-γ在食管癌和肺癌中的表达显著降低,经配体激活后可通过多种途径诱导肿瘤细胞凋亡。此外,还有研究[10-11]发现PPAR-γ激动剂可显著增强5-Fu对人结肠癌化疗的敏感性。这些研究结果均提示PPAR-γ在不同肿瘤中的功能具有多样性。但目前有关PPAR-γ在食管鳞癌化疗敏感性中的作用仍无报道。基于此,阐明PPAR-γ在顺铂耐药的食管鳞癌中的生物特性、对顺铂化疗敏感性的影响,可为其作为靶点应用于食管鳞癌的综合治疗奠定理论基础。
1 材料与方法
1.1 材料与试剂食管鳞癌EC109细胞购自上海生物科学院细胞库;顺铂、罗格列酮购自美国Sigma公司;RPMI-1640培养基、胎牛血清购自美国Gibco公司;MTT试剂盒均购自美国Thermo公司;DMEM高糖培养基购自美国Gibco公司。
1.2 细胞系及培养采用体积分数10%胎牛血清、质量分数1%双抗(青霉素/链霉素)的RPMI-1640完全培养基培养EC109细胞,在37 ℃恒温、体积分数5% CO2培养箱中培养,取对数期状态良好的细胞用于实验。
1.3 MTT法检测细胞增殖取生长良好的处于对数期的EC109细胞接种于96孔细胞培养板中,每孔100 μL(约1×104个细胞)。另设对照组、罗格列酮组(5、10、20、40 μmol/L)、顺铂组(10 μmol/L)、罗格列酮联用顺铂组,分别于24、48、72 h后收集细胞,每孔加入15 μL MTT溶液[用磷酸盐缓冲液(PBS)配成5 g/L]避光培养4 h,弃去96孔板中培养基,每孔加150 μL二甲亚砜,振荡10 min,37 ℃环境中放置30 min,酶标仪测定570 nm处每孔吸光度值。计算细胞存活率,实验重复3次。
1.4 细胞周期分布检测细胞经处理48 h后,收集细胞并用PBS洗涤1次,沉淀用预冷的体积分数70%乙醇固定过夜。离心去除固定液并用PBS洗涤1次,调整细胞密度为1×106个/mL,加入核糖核酸酶(0.25 g/L),37 ℃水浴30 min,加入碘化丙啶染色液至终浓度为20 mg/L,室温避光染色10 min,用流式细胞仪检测细胞周期变化。
1.5 荷瘤裸小鼠模型的建立及分组BALB/c,nu/nu裸小鼠,雌性,4~5周龄,体质量18~20 g,购自北京维通利华有限公司,SPF级条件下进行适应性饲养1周。将处于对数生长期的EC109细胞经胰蛋白酶消化后,离心去上清洗涤,再用培养基洗涤,制备成细胞悬液(1×107个/mL),于裸小鼠后背右侧皮下进行肿瘤细胞接种(200 μL,2×105个细胞)。
接种完食管鳞癌细胞约12 d后即可形成肿瘤。将24只EC109细胞移植瘤荷瘤裸小鼠随机分为4组:对照组、罗格列酮组(3 mg/kg)、顺铂组(6 mg/kg)、罗格列酮(3 mg/kg)联合顺铂(6 mg/kg)组。采用灌胃给药,连续每天给药2周,给药量约0.2 mL,对照组给予相同体积的生理盐水。
1.6 荷瘤裸小鼠肿瘤结节生长的测定分别于治疗后的第0、4、8、12和16天精密测量肿瘤结节的最长径(a)和最短径(b),根据公式计算肿瘤体积V=1/6 π(ab2),取得均值绘制肿瘤生长曲线。于第18天处死裸鼠,精密称量肿瘤质量,计算肿瘤生长抑制率。肿瘤生长抑制率=(对照组肿瘤平均瘤质量-实验组肿瘤平均瘤质量)/对照组肿瘤平均瘤质量×100%。

2 结果
2.1 罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞的抑制作用罗格列酮可显著增强顺铂对EC109细胞的抑制作用,并呈现时间和剂量依赖性。见图1。
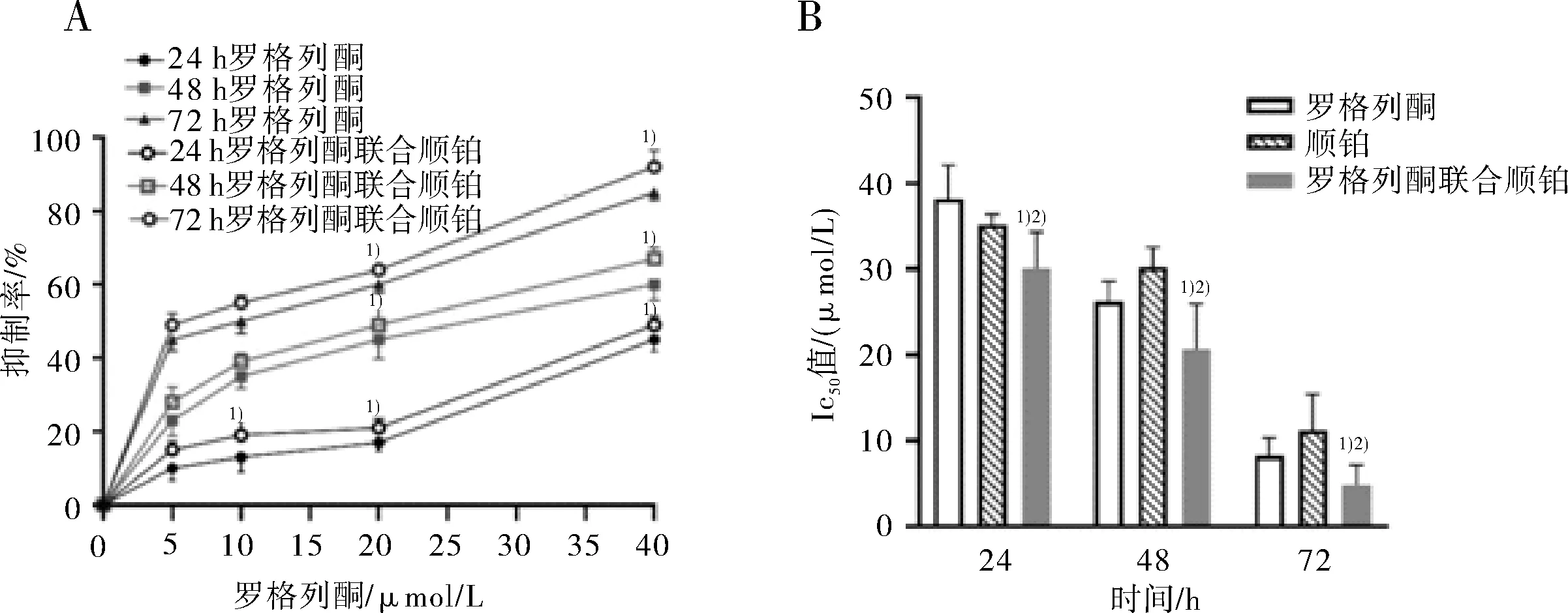
图1 罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞的抑制作用
2.2 罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞细胞周期的影响细胞周期分布分析结果显示罗格列酮联合顺铂使EC109细胞S期细胞显著增多。见表1。

表1 罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞细胞周期的影响 %
2.3 罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞移植瘤荷瘤裸小鼠肿瘤的影响罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞裸鼠移植瘤的抑制率分别为40.21%、52.84%、75.22%。罗格列酮联合顺铂组小鼠肿瘤体积显著减小。见图2、表2。
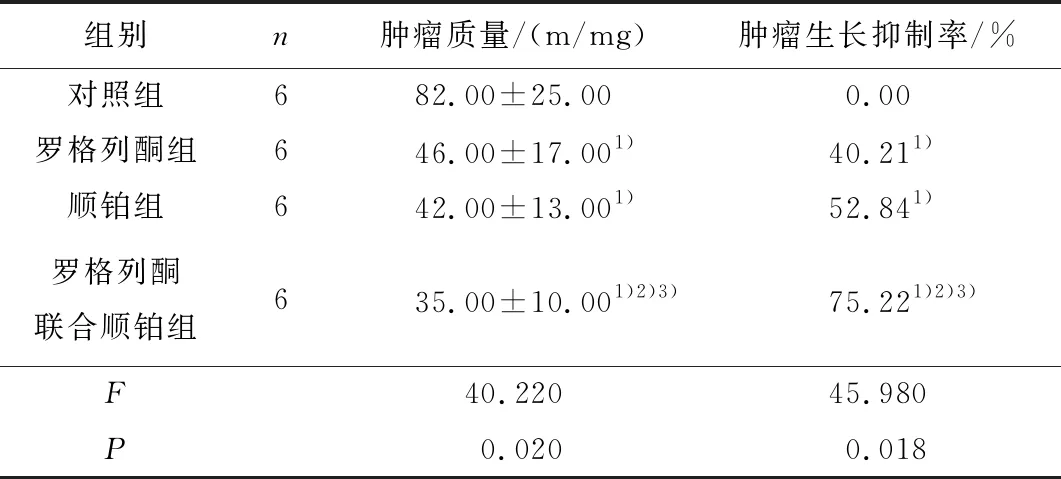
表2 罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞移植瘤荷瘤裸小鼠肿瘤质量和生长抑制率的影响
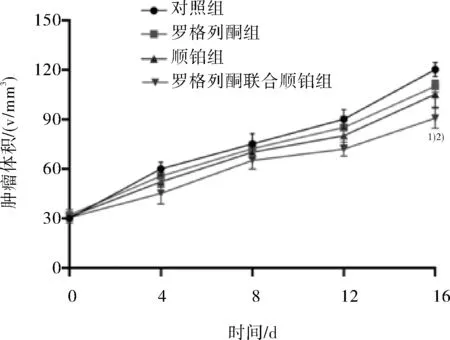
图2 罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞移植瘤荷瘤裸小鼠肿瘤生长曲线的影响
3 讨论
化疗是食管癌的重要基础治疗手段,顺铂目前是临床治疗食管鳞癌的常规一线化疗药物[2]。但许多患者在应用以顺铂为基础的传统化疗方案后对顺铂不敏感,复发率高,易产生耐药性,进一步造成食管鳞癌患者的化疗失败和死亡[3]。研究[4]报道,食管癌患者对顺铂的不敏感是一个多因素、多机制参与的复杂过程,主要与多药耐药转运蛋白、微管蛋白、热休克蛋白等密切相关。但食管鳞癌耐药的机制仍未完全阐释清楚。而将不同作用机制的化疗药物联合应用可能能提高食管鳞癌的化疗效果,增加其对顺铂的敏感性。
PPAR-γ作为PPARs家族的一种核转录因子,与相应配体结合后可诱导或抑制靶基因的表达[12]。据研究[13]报道,在结肠癌、乳腺癌、肺癌及多种消化道肿瘤中PPAR-γ均有表达。PPAR-γ可通过阻滞细胞周期、诱导肿瘤细胞分化或凋亡等抑制其生长。Liang等[14]研究报道乳腺癌患者中,高表达PPAR-γ者疾病无进展生存期更长。而在非小细胞肺癌细胞系中,PPAR-γ活化可致肿瘤细胞分化并诱导其凋亡[15]。此外,Ogino等[16]报道PPAR-γ的表达水平与结肠癌患者的临床预后呈正相关,PPAR-γ可作为结肠癌治疗效果的靶点。上述研究提示,PPAR-γ下调可能为肿瘤细胞耐药的机制之一。但PPAR-γ在食管癌化疗敏感性中的作用报道极少。
本研究分别从细胞水平、动物水平探讨过PPAR-γ激动剂罗格列酮对食管癌化疗敏感性的影响。结果表明:罗格列酮可显著增强顺铂对EC109细胞的抑制作用,并呈现时间和剂量依赖性。细胞周期分布分析结果显示罗格列酮联合顺铂可使EC109细胞S期细胞显著增多。罗格列酮、顺铂、罗格列酮联合顺铂对EC109细胞裸鼠移植瘤的抑制率分别为40.21%、52.84%、75.22%罗格列酮联合顺铂组小鼠肿瘤体积显著减小。以上结果表明罗格列酮联合顺铂可显著提高食管癌化疗敏感性。
综上所述,PPAR-γ激动剂罗格列酮能够显著增强顺铂对食管癌的化疗敏感性,其机制主要与S期细胞周期阻滞有关。本研究结果可为提高食管癌的临床治疗效果奠定理论和实验基础。
