基于层次分析法的红色毛癣菌感染豚鼠模型评价
2019-09-13吴紫君杨超燕张锦红古炽明唐春萍邹国发陈艳芬
吴紫君,杨超燕,张锦红,古炽明,唐春萍,江 炜,邹国发,黄 娟,陈艳芬,4
(1. 广东药科大学中药学院,2. 广东药科大学实验动物中心,3. 广东省中医院外二科, 4. 广州市新药筛选模型体系构建与应用重点实验室,广东 广州 510006)
皮肤癣菌感染在人群中发病率高,近年来,由于广泛应用抗生素、免疫抑制剂以及放疗、化疗等原因,发病率更呈不断上升趋势。红色毛癣菌(Trichophytonrubrum)是临床引起皮肤癣菌病最常见的真菌之一,其所致癣菌病病程长、难治愈、易复发[1-2],世界各地均有散在的致病报道,但主要集中在北非和东南亚。随着真菌感染率的不断升高和现有抗真菌药物耐药性的日趋严重,临床上对高效低毒的新型抗真菌药物的需求日益迫切,而稳定可靠的动物模型是新药研发中必不可少的条件。我们近年研究发现,红色毛癣菌皮肤感染动物模型造模方法不一致,成功率低,而且缺乏模型的综合评价指标体系,各种造模方法相互之间可比性较差[3-8]。因此,急需建立一个科学的、量化的真菌感染动物模型评价指标体系,系统进行方法学评价。
层次分析法(analytic hierarchy process,AHP)是一种实用的多准则决策法,适合用于评价目标值难于定量描述、指标分层交错的目标系统的决策问题,它把定性分析与定量分析有机地结合起来,把多目标、多准则、难定量的决策问题转化为多层次、单目标、可量化的问题,最后通过简单的计算,获得简明的结果[9]。本研究首先采用AHP建立红色毛癣菌皮肤感染动物模型评价指标体系,再以此体系综合考察评价一种动物模型需要考虑的多方面特征,包括科学性、可靠性、重复性、经济性、易操作性等,由此优选出理想的动物模型,为真菌皮肤感染机制研究及抗真菌感染新药药效学评价提供参考依据。
1 材料
1.1 试剂红色毛癣菌标准株CMCC(F)T1d,购自中国医学科学院皮肤病研究所(南京);曲安奈德注射液(昆明积大制药股份有限公司,批号:170616);地塞米松磷酸钠注射液(湖北天药药业股份有限公司,批号:51705222);马铃薯葡萄糖琼脂(potato dextrose agar,PDA)(海博生物技术有限公司,批号:20171128);豚鼠免疫球蛋白M(IgM)酶联免疫吸附测定试剂盒(上海将来实业股份有限公司,批号:Mar 2018);屈臣氏丝滑柔和脱毛膏(广州市花安堂生物科技有限公司,批号:G0405G1)。
1.2 仪器SW-CJ-1F洁净工作台(苏州安泰空气技术有限公司);SW-CJ-1F电热恒温培养箱(上海一恒科学仪器有限公司);CKX41倒置显微镜(Olympus公司);H1850R医用离心机(湖南湘仪实验室仪器开发有限公司);ELX800全自动酶标仪(Biotek Instruments);QC5130电推剪(Lassie’s Trading Company Ltd)。
1.3 实验动物普通级Hartley豚鼠,体质量(220~300) g,♀♂各半,购自广东省医学实验动物中心,许可证号:SCXK(粤)2014-0035,动物饲养于广东药科大学实验动物中心。
2 方法
2.1 建立综合评价指标体系按照AHP的基本原理和建模步骤[9],首先通过文献调研和专家咨询,搜集红色毛癣菌感染豚鼠模型的评价指标并设计评价指标调查表,考察各个指标的科学性、必要性和重要性,确立红色毛癣菌感染豚鼠模型的树状指标体系。采用德尔菲法,邀请5位专家对树状指标体系各层各指标相对重要性进行评分,建立判断矩阵,采用和积法计算出各指标权重并检验矩阵一致性,综合专家们的评分得出平均指标权重;进一步根据专家对各个详细指标评分项的评价,汇总得出模型评价指标赋分标准,结合指标权重和赋分准则,最终建立红色毛癣菌感染豚鼠模型的综合评价指标体系。
2.2 构建动物模型
2.2.1制备菌悬液 参考实验室前期基础,将红色毛癣菌菌株接种于PDA培养基,置恒温培养箱(28 ℃)培养14 d至对数生长期,用接种环轻轻刮取表面菌落移至研磨器,加入适量无菌生理盐水,研磨成均匀的混悬液后用血球计数板计数,用生理盐水调整浓度至1×1011cfu·L-1备用。
2.2.2动物分组造模 普通级Hartley豚鼠按体质量随机分成7组,每组12只,♀♂各半。1组空白对照组:不给予任何特殊处理,接种或注射时给予等体积的生理盐水;2组:接菌前后注射生理盐水,背部皮肤接种上述菌悬液1 d(400 μL)[3,8],d 2接种等体积的生理盐水;3组:接菌前后注射生理盐水,背部皮肤接种上述菌悬液2 d(200 μL·d-1);4组:接菌前注射曲安奈德(20 mg·kg-1·d-1)3 d,接菌1 d(400 μL),d 2接种等体积的生理盐水,接菌后隔天注射地塞米松(7.5 mg·kg-1·d-1),共4次[4,6];5组:接菌前注射曲安奈德(20 mg·kg-1·d-1)3 d,接菌2 d(200 μL·d-1),接菌后隔天注射地塞米松(7.5 mg·kg-1·d-1),共4次;6组:接菌前注射地塞米松(7.5 mg·kg-1·d-1)3 d,接菌1 d(400 μL),d 2接种等体积的生理盐水,接菌后每天注射地塞米松(7.5 mg·kg-1·d-1),连续4 d;7组:接菌前注射地塞米松(7.5 mg·kg-1·d-1)3 d,接菌2 d(200 μL·d-1),接菌后每天注射地塞米松(7.5 mg·kg-1·d-1),连续4 d。其中,曲安奈德注射液为肌肉注射,地塞米松磷酸钠注射液为腹腔注射。见Tab 1。
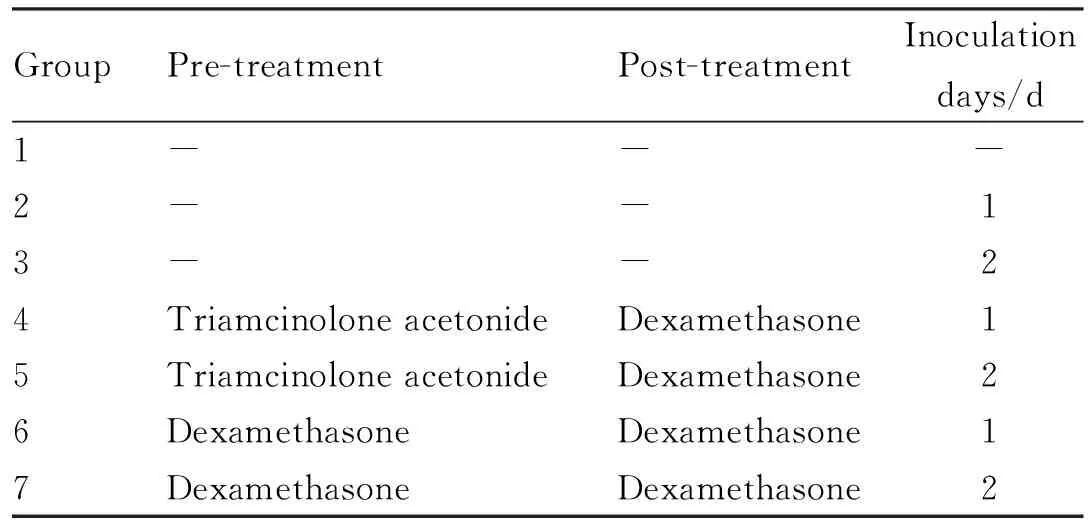
Tab 1 Animal grouping
豚鼠按分组预处理,接菌前24 h用电推剪剃去豚鼠背部毛发,再用脱毛膏清除毛根得到裸露光滑的背部皮肤。接菌前,脱毛部位用酒精消毒,待酒精挥干后,用无菌粗砂纸磨损皮肤至点状渗血,在3 cm×3 cm的破损皮肤上均匀涂抹菌悬液,待菌液完全吸收后放回鼠笼,分组处理。接菌后,每天观察和记录各组的体征和实验区域皮肤的红斑、鳞屑和毛发的外观变化,d 4开始,隔天拔取豚鼠少量毛发或皮屑,10% KOH直接镜检以检查真菌阳性率。结束免疫抑制剂处理后,豚鼠眼眶前眦采血,采用ELISA法测定血清中IgM含量。d 14拔取豚鼠的毛发和鳞屑,接种于PDA培养基进行逆培养,以检查真菌阳性率。根据各组的病程发展,各组在病程的前期、中期和后期随机挑选2~3只,取其病变部位皮肤进行PAS染色和HE染色。实验结束当天,解剖取脾脏与胸腺,称量并计算其脏器指数。以上评价指标按照模型评价指标赋分标准进行评分,按权重计算出综合得分。

3 结果
3.1 综合评价指标体系综合文献调研和专家评分,按照AHP建立了评价目标树(Fig 1),通过计算获得各指标权重(Tab 2)。
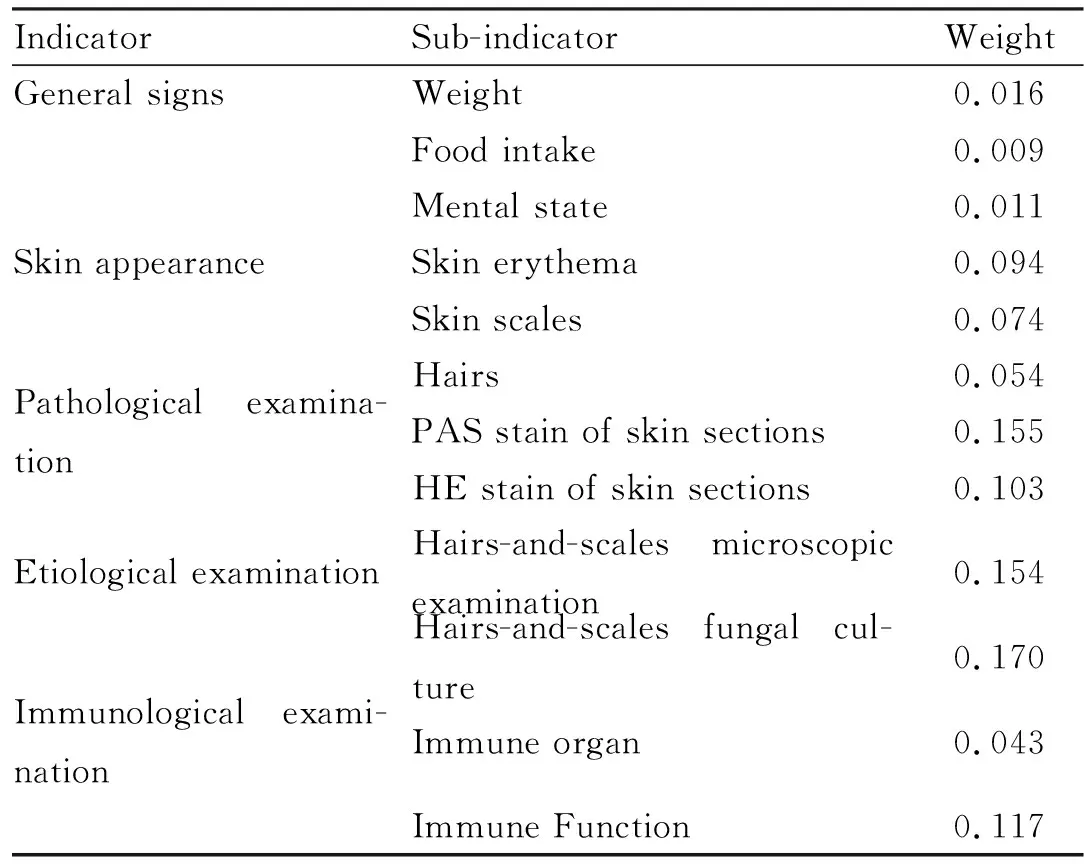
Tab 2 Evaluation index weight of guinea pigskininfection model of Trichophyton rubrum
3.2 体征变化各组豚鼠体质量均呈平稳上升趋势,体质量增长无明显差异;免疫抑制剂处理前后与接菌前后,豚鼠进食量无明显变化,活动状况及精神状态均正常。
3.3 外观变化各组豚鼠约d 7结痂脱落,1组空白组毛发正常生长,无异常;其余实验组约d 9开始出现红斑和鳞屑,d 14左右病情发展到高峰;2组外观症状轻,约d 21基本恢复正常;3、4组外观症状稍重,约d 28基本恢复正常;5~7组外观症状明显,5组约d 40基本恢复正常,6、7组d 35基本恢复正常。病程初期红斑较鳞屑早出现,鳞屑薄且透明、易脱落;随后鳞屑逐渐变厚、变黄、难脱落;自愈过程中,红斑逐渐褪去,鳞屑慢慢脱落,红斑较鳞屑早褪去,皮肤逐渐变光滑,毛发受限生长区域缩小。见Fig 2。
3.4 病理学观察如Fig 3所示,PAS染色显微镜下可观察到菌丝和孢子被染成紫红色,1组豚鼠皮肤实验全过程均未见真菌侵染,2组实验中期、3组各时期角质层可见少量菌丝,4~7组各时期角质层均可见大量菌丝,5~7组随着病情发展真菌逐渐侵染到毛囊毛根部。
Fig 4的HE染色显示,1组豚鼠皮肤实验前期受到磨损,有少量炎症细胞散在真皮浅层,其余各时期未见炎症细胞聚集,2~7组各时期均有少量炎症细胞散布在真皮浅层,3组后期角质层有少量炎症细胞,4组中期表皮下层有大量炎症细胞聚集,5、6、7组在角质层、结痂或鳞屑处有大量炎症细胞聚集。
3.5 病原学检查
3.5.1直接镜检 除空白组外,各实验组d 4开始可在显微镜下明显观察到菌丝,毛发皮屑中菌丝数量随时间逐渐减少,d 20开始菌丝不明显,偶可观察到散在的分生孢子。见Fig 5、Tab 3。
3.5.2逆培养 Tab 3结果显示,除空白组外,各实验组接种7 d后培养基开始有菌落生长,且与接种菌株形态相同。5、6组阳性率最高,7组次之,2组阳性率最低。
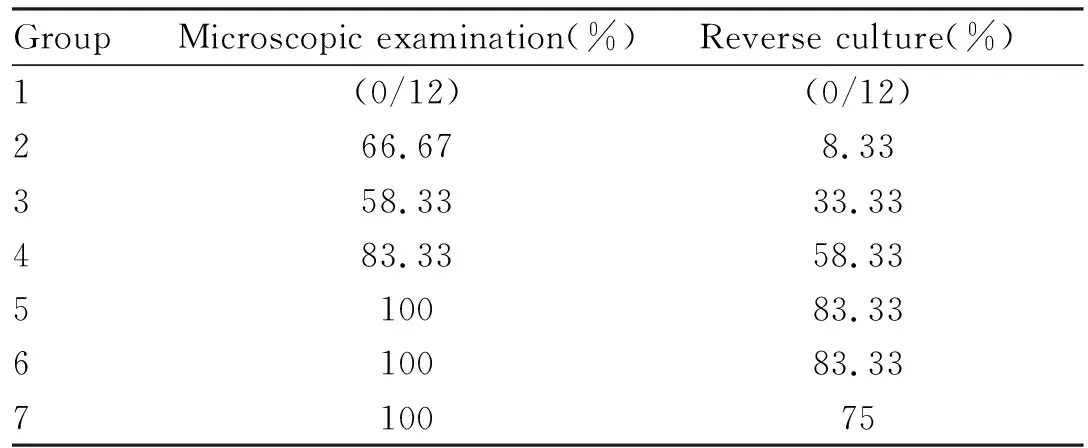
Tab 3 Positive rate of hairs and scalemicroscopic examination and fungal culture(n=12)
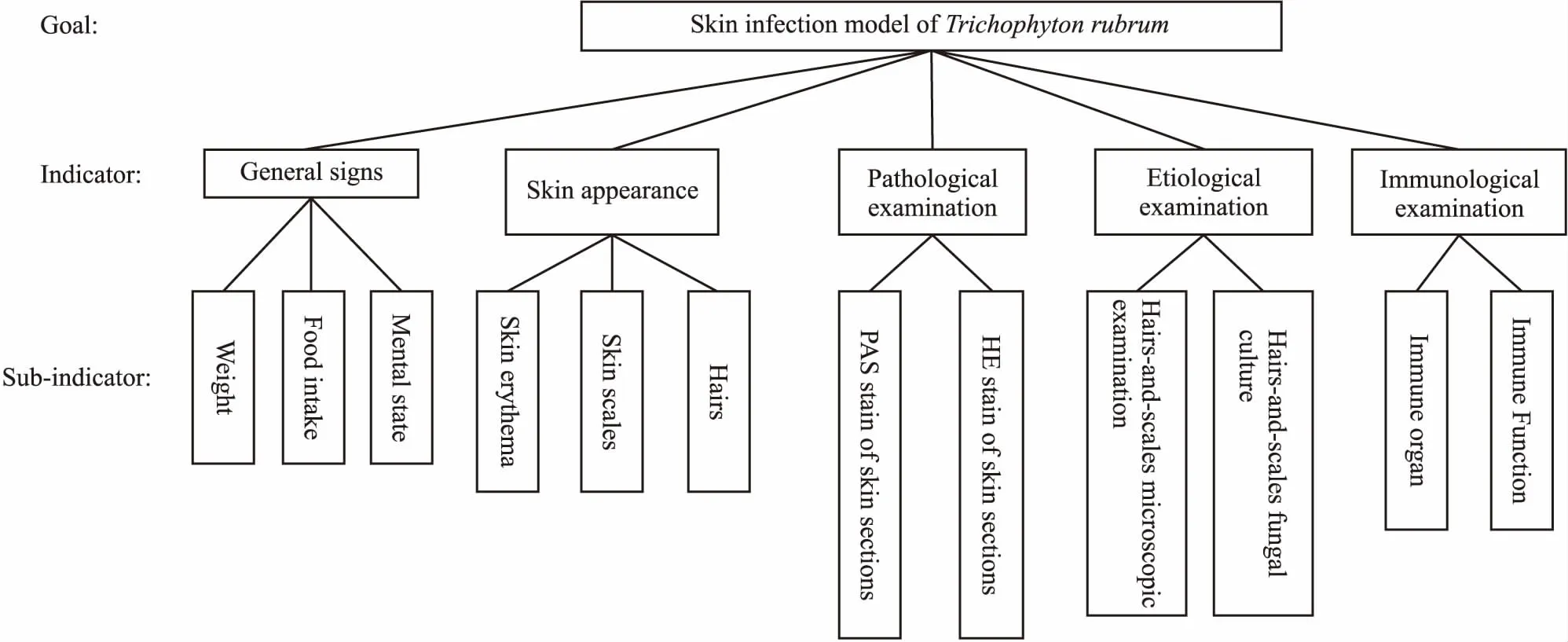
Fig 1 Evaluation index system of skin infection animal model of Trichophyton rubrum
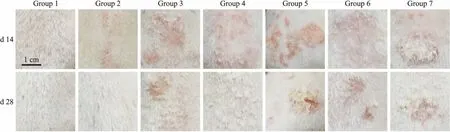
Fig 2 Changes in appearance of guinea pig skin
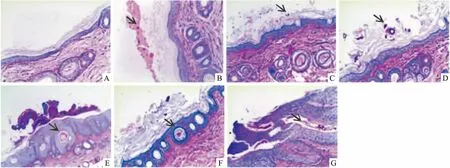
Fig3Skinsections(PAS staining×100) A~G: Group 1~7.The arrowheads refer to hyphae or spores.
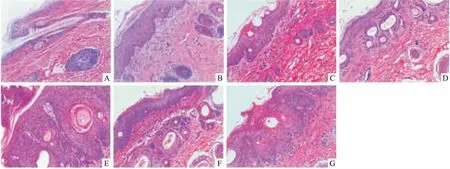
Fig4Skinsections(HE staining×100) A~G:Group 1~7.

Fig 5 Microscopic examination in 10% KOH(×100)
A: Day 4; B: Day 14; C: Day 20; D: Day 26.The arrowhead refers to hyphae.
3.6 免疫学检查
3.6.1免疫器官 与1组相比,4、5、6、7组豚鼠的脾脏和胸腺的脏器指数有所下降,但无统计学差异(Tab 4)。
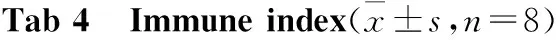
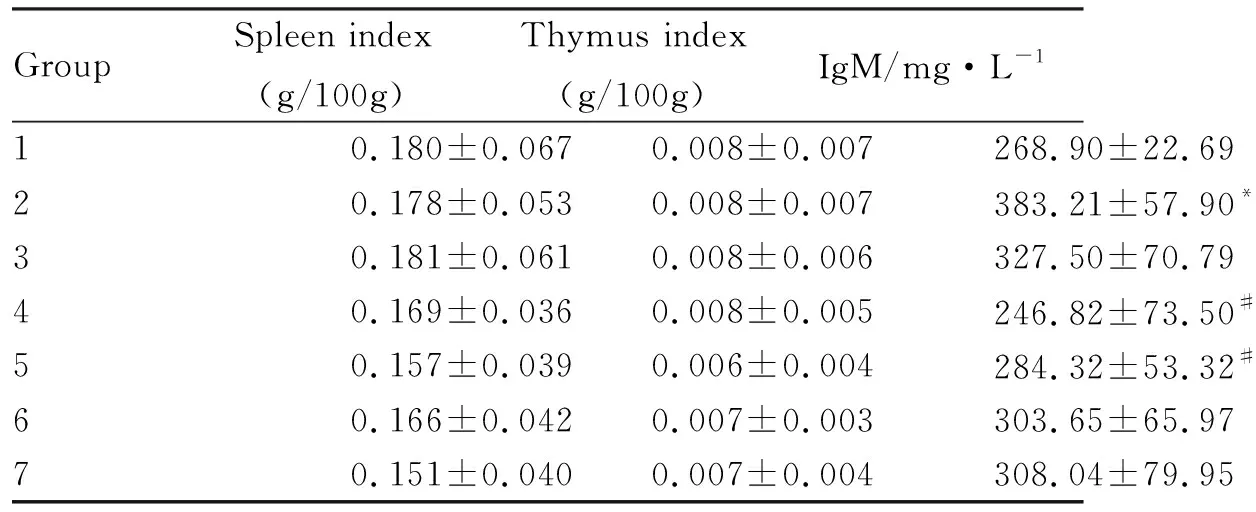
GroupSpleen index(g/100g)Thymus index(g/100g)IgM/mg·L-110.180±0.0670.008±0.007268.90±22.6920.178±0.0530.008±0.007383.21±57.90*30.181±0.0610.008±0.006327.50±70.7940.169±0.0360.008±0.005246.82±73.50#50.157±0.0390.006±0.004284.32±53.32#60.166±0.0420.007±0.003303.65±65.9770.151±0.0400.007±0.004308.04±79.95
*P<0.05vsgroup 1;#P<0.05vsgroup 2
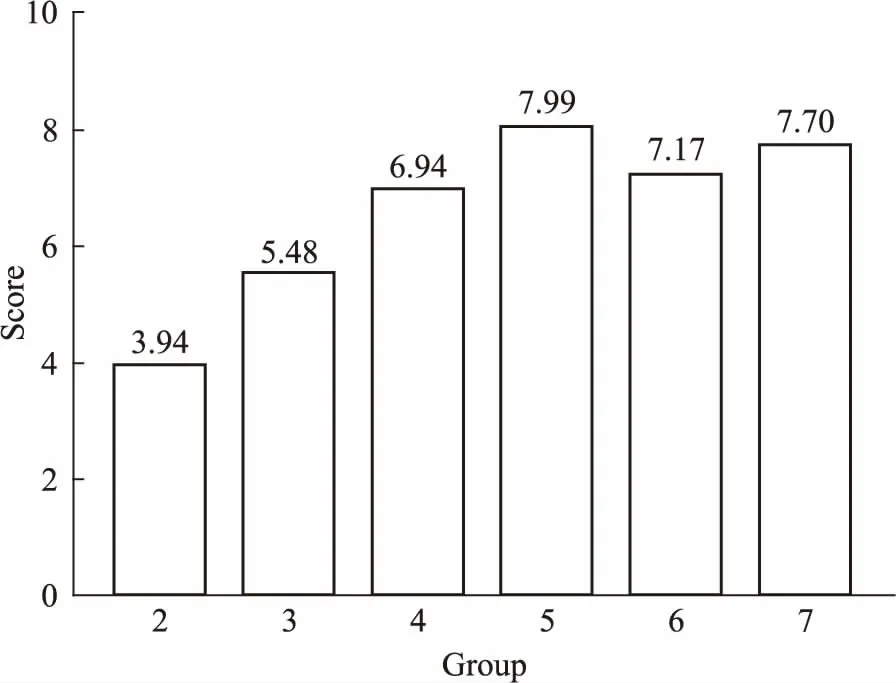
Fig 6 Comprehensive score chart of each group
3.6.2免疫功能 IgM出现在感染初期,豚鼠与红色毛癣菌接触后会产生免疫反应自身清除真菌[4,10]。Tab 4结果表明,与1组相比,其余各实验组的血清IgM含量都有所升高,其中2组有差异有显著性(P<0.05);而与2组相比,4、5、6、7组IgM下降,尤以4、5组比较明显(P<0.05),提示长时间使用免疫抑制剂干预能明显降低豚鼠感染后的自身清除能力。
3.7 模型综合评价结合外观病变、直接镜检、毛发皮屑逆培养和皮肤PAS染色阳性,模型构建成功确定。综合各指标得出,2组模型成功率小于10%,3组成功率30%,4组58%,而5、6、7组均大于75%。取d 14的体征变化和外观变化结合其他指标,按照模型评价指标赋分标准进行各项评分,按权重计算获得各组综合评分,按得分高低排序如下:5组>7组>6组>4组>3组>2组,见Tab 5,Fig 6。
4 讨论
动物模型评价指标是一个多层次、多指标的系统,部分评价指标较难以定量。本研究通过实例证明,采用AHP构建的评价体系能较直观地量化评价模型质量,从而更好地解决造模方法和评判标准不统一的问题,全面、科学、可靠地评价动物模型。红色毛癣菌具有亲人性,而不具有亲动物性,因而,尽管其在流行病学调查中为导致皮肤癣菌感染中的优势菌种,但难以在动物上成模。动物皮肤磨损感染是文献中常见的造模方法,本实验模拟人体皮肤磨损后的真菌感染,同样对豚鼠皮肤进行磨损接菌,观察各组红色毛癣菌感染发展的全过程。在设置考察因素时,我们结合文献方法和自身的研究[4],主要考察重复感染是否能提高模型成功率,因此,分别进行了接菌1 d与接菌2 d的造模研究;考察接受免疫抑制剂处理是否能促进红色毛癣菌感染,以及如何使用免疫抑制剂,因此,比较了不接受免疫抑制剂处理、接受免疫抑制剂处理(曲安奈德、地塞米松联用,或单用地塞米松)的差别。结果表明,正常情况下,不作任何免疫处理的豚鼠感染模型成功率极低,感染后皮肤外观病征不明显、自愈速度快、表皮内没有孢子潜伏;而接受免疫抑制剂处理的豚鼠感染模型成功率大大提高,外观病征明显,外观病征褪去后表皮内有孢子潜伏;于接菌前后单用地塞米松处理7 d的豚鼠病情发展和自愈速度相对较快,联合两种激素处理的豚鼠(由于接菌后隔天注射,前后共10 d)病情发展和自愈速度较平稳,但二者之间差异不是很明显;接菌2 d的豚鼠比接菌1 d的真菌(两种方法的总接菌量一样)感染率更高,模型质量更好。
豚鼠对红色毛癣菌的自我清除能力强,难以自然感染,降低豚鼠自身的免疫力和重复接菌可增加易感性[10-11]。本研究中曲安奈德与地塞米松联合处理+接菌2 d的模型(5组)综合得分最高,可认为是实验中筛选出的最佳红色毛癣菌感染豚鼠模型。但为了提高模型的可操作性,我们简化了处理方法,自行设计并研究了单用地塞米松处理的模型(7组),该模型和5组比较接近;两种模型的外观病征都比较明显[12],孢子潜伏于表皮、毛囊内与临床病程反复情况相似[13],病情发展和自愈速度适合多数抗真菌药物体内药效评价的给药疗程[4,7,14],有望推广应用于抗真菌药的药效学评价。
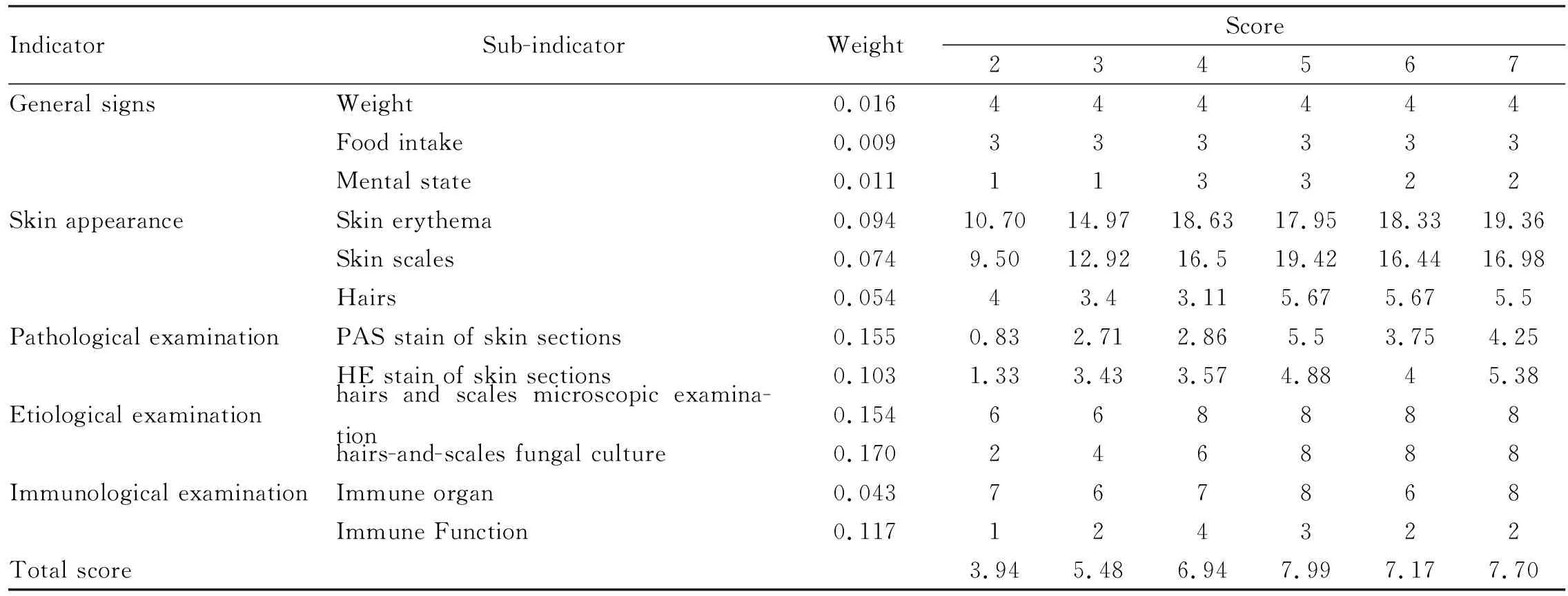
Tab 5 Comprehensive score of each group
综上所述,本研究采用AHP建立的评价指标体系清晰、简便,优选的红色毛癣菌皮肤感染动物模型,为临床真菌皮肤感染及新型抗真菌药研究提供了基础条件。
