miR-338-3p在恶性肿瘤中的表达异常及其表观遗传组蛋白的修饰位点
2019-09-10王文静王晓霏刘利英童东东
王文静,王晓霏,刘利英,童东东,李 茜,倪 磊,郭 波
(1. 西安交通大学第一附属医院肝胆外科,陕西西安 710061;2 西安交通大学医学部细胞生物学与遗传学系,陕西西安 710061;3. 西安交通大学医学部环境与疾病相关基因教育部重点实验室,陕西西安 710061)
微小RNA(microRNA, miRNA)是一类长约21~25个核苷酸的非编码RNA小分子,其在进化上高度保守,广泛存在于真核生物中,大部分经由基因的内含子部位剪切产生[1]。目前,已经鉴定的miRNA约有上万种,其中人类成熟的miRNA有1 900余种,调控着人类基因组中20%~30%的基因[2]。miRNA主要通过抑制mRNA翻译或促进其降解调控基因表达,通过影响细胞周期、增殖、凋亡、侵袭或迁移能力,参与肿瘤的发生、发展的各个环节。Let-7家族在肺癌、肝癌及结肠癌等肿瘤中表达下调,提示其是一种抑癌基因[3]。研究发现Let-7可以通过靶向下调HMGA2(high mobility group A2)的表达而促进核苷酸切除性修复,抑制肿瘤的发生[4]。因此,miRNA与肿瘤发生的关系也一直是肿瘤研究领域的焦点[5-7]。
经典的表观遗传(epigenetics)修饰包括DNA甲基化、组蛋白修饰和染色质重塑等方面,通过调控基因表达在包括肿瘤细胞在内的细胞生物学行为等方面发挥了重要作用[8]。miRNA作为肿瘤细胞中一类重要的基因表达调控小分子,其在肿瘤中的差异表达和对靶基因特异性的调节机制都已被广泛报道。既然miRNA由宿主基因剪切而来,那么其应该也能像其他基因产物一样,能够受到表观修饰的调节,如前面提到的DNA甲基化和组蛋白修饰等。因此,miRNA的表观遗传学调控机制也成为近来研究的热点内容。本研究通过生物信息大数据库分析了miR-338-3p在多种肿瘤中的表达谱,并以胃癌为研究对象,利用染色质免疫共沉淀(ChIP)结合PCR(ChIP-PCR)的方法探究了组蛋白修饰在miRNA表达异常中的作用,为后续对其调控机制的进一步研究提供了新的思路。
1 材料与方法
1.1 主要试剂与器材ChIP级抗体Anti-IgG、Anti-H3K27ac、Anti-H3K4m2、Anti-H3K9m2与Anti-H3K4m3均购自英国Abcam公司;Dynabeads®G蛋白与DynaMagTM旋转磁力架购自美国Life Technologies公司;蛋白酶抑制剂与蛋白酶K购自美国Roche公司。
1.2 生物信息学数据库miR-338-3p在胃癌等16种不同种类肿瘤组织中表达谱分析数据来自TCGA(The Cancer Genome Atlas)Pan-Cancer database(https://cancergenome.nih.gov);miR-338-3p序列等信息来自miRbase(http://www.mirbase.org);为探讨miR-338-3p在胃癌中异常表达的原因,利用CRCH37(Genome Reference Consortium, http://www.ensembl.org/index.html)数据库预测其上游启动子区序列与组蛋白修饰位点。
1.3 细胞培养人胃癌BGC-823细胞培养于含双抗(PS)和胎牛血清(FBS)(Gibco公司)的DMEM(PAA公司)培养基中,置于37 ℃的CO2孵育箱中,2~3 d换液,取对数生长期细胞进行实验。
1.4 ChIP-PCR实验及电泳验证用10 cm2平皿培养的胃癌BGC-823细胞经预冷PBS水平摇床上轻柔洗涤3遍;270 μL甲醛室温孵育15 min;600 μL甘氨酸轻柔混合室温放置30 min;PBS清洗2次后弃液体,收集细胞于1.5 mL离心管,离心并弃上清;1 mL Mg-NI重悬细胞,离心并弃上清,1 mL Mg-NI-NP-40,冰上孵育10 min;12 000 r/min离心1 min,加0.5 mL Ca-NI重悬细胞后加4 μL EGTA,冰上孵育30 min;13 000 r/min离心1 min,以500 μL lysis buffer重悬(含蛋白酶抑制剂);超声破碎后,最高速4 ℃离心5 min,收集上清,每组留取100 μL样品为Input组,其余样品加抗体为实验组;每100~200 μL液体中加入1 μL相应抗体,DNA混合仪旋转4 ℃孵育过夜;加40 μL Protein G Agarose,4 ℃混匀2 h,DynaMagTM旋转磁力架磁性固定后弃上清;依次用SB140、SB500、LiCl、TE清洗沉淀复合物2遍;加入100 μL Elution Buffer,65 ℃,10 min;离心后移上清于一新的EP管,加150 μL TE,65 ℃,10 min;加入100 μL EB和150 μL TE,65 ℃,6~8 h,解交联;加蛋白酶K,55 ℃,30 min;加入RNaseA,37 ℃孵育1 h;酚-氯仿法抽提DNA至新EP管中,加1/10体积NaAc溶液,2倍体积无水乙醇,冰上放置30 min;12 000 r/min离心15 min,弃上清后乙醇洗涤,离心后弃上清风干,30~50 μL TE溶解。PCR扩增各组DNA中miR-338-3p启动子片段,ChIP-PCR引物序列见表1。将PCR反应后产物与5×Loading Buffer(TaKaRa公司)以4∶1体积比混匀,移液枪加入加样槽中,同时预留一孔加入3~5 μL DNA Marker,电泳,结束后将胶板置于凝胶成像系统下观察拍照。
表1 染色质免疫共沉淀PCR(ChIP-PCR)引物
Tab.1 Primers for chromatin immune coprecipitation-PCR

引物名称序列ChIP-338-Forward5′-TCCCCTAACTCCCAGTGTCT-3′ChIP-338-Reverse5′-CTTGCCTTGGCAGATTTGGG-3′ChIP-GAPDH-Forward5′-TACTAGCGGTTTTACGGGCG-3′ChIP-GAPDH-Reverse5′-TCGAACAGGAGGAGCAGAGAGCGA-3′
1.5 统计学分析miR-338-3p的表达谱来源于TCGA数据库中测序结果,正常组织与肿瘤组织间比较采用非配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各种肿瘤中miR-338-3p的表达谱分析生物信息学大数据库(TCGA Pan-Cancer)分析显示,miR-338-3p在多个不同种类肿瘤中均有表达异常(图1),相对于正常对照,miR-338-3p表达升高的有结肠腺癌(COAD,P<0.05)、肾透明细胞癌(KIRC,P<0.05)和肝细胞肝癌(LIHC,P<0.05);表达下调的有食道癌(ESCA,P<0.05)、头颈部鳞状细胞癌(HNSC,P<0.05)、肾嫌色细胞癌(KICH,P<0.05)、肾乳头状肾细胞癌(KIRP,P<0.05)、肺鳞癌(LUSC,P<0.05)和甲状腺癌(THCA,P<0.05)。

图1 TCGA数据库提示miR-338-3p在多种肿瘤中的表达异常
Fig.1 The dysregulation of miR-338-3p among various cancer types obtained from TCGA database
2.2 miR-338-3p在胃癌中表达下调在TCGA数据库中对非配对的45例正常胃组织和366例胃癌组织数据分析显示,miR-338-3p在胃癌组织中的表达普遍低于正常组织(图2)。结果分析虽无统计学差异,其原因可能与两组样本量差异大及个体差异性有关。
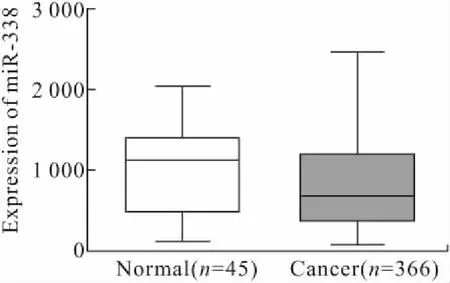
图2 正常胃组织与胃癌组织中miR-338-3p的表达
Fig.2 The expression of miR-338-3p in normal gastric and gastric cancer tissues
2.3 miR-338-3p启动子区组蛋白修饰位点预测在CRCH37数据库中,对miR-338-3p启动子区潜在的组蛋白修饰位点的分析结果显示,H3K27ac可能是涉及到调控miR-338-3p表达的重要位点(图3)。
2.4 miR-338-3p表达下调的组蛋白修饰位点ChIP-PCR实验同时获得了包括H3K27ac等多个组蛋白修饰位点结合的DNA片段,设计引物扩增miR-338-3p启动子区的基因片段,结果发现,H3K9m2和H3K4m3是调控miR-338-3p表达的表观遗传修饰因素中两个潜在的组蛋白修饰位点(图4)。

图3 CRCH37中miR-338-3p启动子区组蛋白修饰位点的预测
Fig.3 The predication of the histone modification sites in miR-338-3p promoter region

图4 H3K9m2和H3K4m3是调控miR-338-3p表达的潜在修饰位点
Fig.4 H3K9m2 and H3K4m3 were two potential sites of histone modification
3 讨 论
目前大量研究表明miRNA在肿瘤中异常表达,能够诱发肿瘤的发生及进展。由于其具有组织、肿瘤或病理的特异性以及较强的物种保守性,miRNA也常常被认为能作为一种新型的靶点,用以早期筛查或为靶向治疗提供新的研究策略。例如研究发现miR-17~92家族在血液系统肿瘤中表达上调,已被确认为原癌性miRNA[9];miR-106b则在多种肿瘤中表达升高,外源性miR-106b可上调Myc抑制肿瘤细胞的凋亡[10];而新近报道的昼夜节律调节基因CLOCK是miR-141的靶基因之一,通过抑制miR-141可上调CLOCK蛋白在胆管癌中的表达,从而抑制肿瘤细胞增殖[11]。另一方面,证实miRNA具有抑癌作用,如miR-143与miR-145在结直肠癌、肺癌及胃癌中表达均下调,提示其可能在腺癌中低表达,有抑癌基因作用[12-13]。因此,在肿瘤中寻找敏感性和保守性都较高的miRNA分子对肿瘤的早期发现、分化、发展及复发的监测和治疗反应评价都有非常重要的意义。本研究通过对多个生物信息学大数据库分析,在数十种肿瘤上千个组织样本中对miR-338-3p的表达谱进行了分析,发现其在结肠腺癌和肾透明细胞癌等肿瘤中表达显著上调,而在食道癌和头颈部鳞状细胞癌等肿瘤中的表达受到了明显抑制。证实了虽然miRNA在不同物种间高度保守,但由于组织特异性或不同的遗传背景等因素,同一个miRNA在不同肿瘤组织间甚至不同细胞类型的同一个肿瘤间的表达都不尽相同,提示在后续研究中选择研究对象与平台时,必须要充分考虑其遗传背景与表达谱差异情况。
已有文献报道,miRNA的表达水平受DNA甲基化、组蛋白修饰等表观遗传层面修饰的影响,通过与表观遗传修饰间的相互作用共同参与调控肿瘤的发生发展[14]。在对人卵巢癌中表达下调的miRNA进行的研究发现,其中只有15%的miRNA是由于DNA拷贝缺失导致表达降低,另外还有约36%的miRNA是由于表观遗传修饰的原因而导致表达下调[15]。因此,表观遗传调控是miRNA表达水平异常的重要原因之一。作为表观遗传修饰的一个主要方面,组蛋白修饰也在调节miRNA表达过程中有重要作用。利用HDAC的抑制剂LAQ824诱导处理乳腺癌SK-BR-3细胞,结果发现5个miRNAs表达上调,22个miRNAs表达下调,提示miRNA的表达与组蛋白乙酰化水平相关[16]。通过质谱方法也证实了人胚胎干细胞中H3K56存在乙酰化修饰,H3K56ac能够与维持干细胞多能性的关键转录因子一起结合到3个干细胞特异性的miRNAs(miR-302,miR-371和miR-498)启动子区,激活这些分子的表达[17]。有研究发现miR-200a可以靶向结合并抑制HDAC4的表达,而HDAC4又能通过调节组蛋白H3的乙酰化水平反而抑制miR-200a的表达,因此,形成了miR-200a可以自身激活的一个环路[18]。
组蛋白修饰的检测方法目前主要有两种:一方面,对于未知的组蛋白修饰位点,其分子量在经过共价修饰之后可发生改变,通过质谱可以鉴定出组蛋白氨基酸上发生了什么样的共价修饰,这是检测新的组蛋白修饰位点的标准方法;另一方面,对于已知的组蛋白修饰位点,首先可以利用针对该修饰位点的抗体,通过ChIP实验获得与之结合的DNA片段,接下来既可通过ChIP-on-chip检测,也可通过设计基因特异性PCR引物,来验证特定基因片段是否发生了已知修饰。因此,本研究利用ChIP实验同时获得了多个组蛋白修饰位点结合的DNA片段,设计引物扩增miR-338-3p启动子区的基因片段,结果发现H3K9m2和H3K4m3是调控miR-338-3p表达的表观遗传修饰因素中两个潜在的组蛋白修饰位点,而其中涉及的具体修饰机制将在后续研究中做进一步探讨。
目前,对与miRNA的作用及机制研究都已相当成熟,而miRNA上游调控机制的研究难度则要大于下游机制的研究。但由于大多数肿瘤的发生都与表观遗传调控有关,且表观遗传修饰具有可逆性,因此,非常有必要寻求一个在多种肿瘤间表达都相对保守的miRNA并了解表观遗传调控机制,为以表观遗传修饰为治疗靶点的肿瘤特异性治疗研究奠定理论基础。
