肾康丸与依那西普对2型糖尿病大鼠肾脏保护的作用机制*
2019-09-09方婉刘雅诗刘龙辉张子鑫刘小玲李燕霞杨爱成
方婉, 刘雅诗, 刘龙辉, 张子鑫, 刘小玲, 李燕霞, 杨爱成△
1湖南中医药大学研究生院(湖南长沙 410000); 2暨南大学附属江门市中医院肾病科(广东江门 529000)
糖尿病(diabetes mellitus, DM)常见而且较严重的并发症之一就是糖尿病肾病(diabetic nephropathy, DN)。DN起病隐匿,早期常无明显临床症状,病情逐渐进展出现高血压、尿蛋白阳性即DN蛋白尿期,最终发展至终末期肾功能衰竭,这是最重要的糖尿病导致死亡的原因之一[1]。肾康丸(Shenkangwan)是魏连波教授通过多年的临床观察有效治疗DN的经验方剂,方药中各单味药均具有或兼具免疫调节作用。前期,笔者从临床研究[2]发现,肾康丸通过减少DN患者炎症因子的产生,从而产生肾保护作用。依那西普(etanercept)是重组人Ⅱ型受体-抗体融合蛋白,是肿瘤坏死因子(tumor necrosis factor-α,TNF-α)拮抗剂,故可以抑制TNF-α,从而有控制炎症、阻断病情进展的作用,它属抗风湿药物(DMARD),是抗风湿病的生物制剂,对肾脏保护作用。我们于2014年6月至2018年6月开展本研究,通过肾康丸及依那西普作用于T2DM,观察其对于T2DM大鼠肾脏肿瘤坏死因子相关凋亡诱导配体(TRAIL)系统表达的影响,为防治DN寻找新的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 选取2月龄,体重170~200 g的清洁级近交系Wistar雄性大鼠60只,购买于南方医科大学实验动物中心,许可证号:SCXK(粤)2006-0015。
1.1.2 受试药品 依那西普(注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白;英文名称:Recombinant Human Tumor Necrosis Factor-Receptor),12.5 mg/支。肾康丸(组成:黄芪、芡实、金樱子、玉米须等),6 g/包。
1.1.3 主要试剂 链脲佐菌素(STZ);柠檬酸缓冲液;10%水合氯醛;10%甲醛;血清尿微量清蛋白(UmAlb) ELISA及尿α1-微球蛋白(Uα1-MG)试剂盒;普通PCR试剂,重组鼠白血病病毒逆转录酶(MMLV-RT)、Trizol,Q-RT-PCR试剂。
1.2 动物模型制备 根据文献,制作T2DM大鼠模型。所有大鼠均自由进水,适应性喂养7 d后随机将其分为两组:正常对照组(C组) 12只,模型组(D组)48只,分别给予标准饲料及高脂高糖饲料(标准饲料∶蔗糖∶炼猪油∶奶粉∶鸡蛋=63.5%∶20%∶10%∶4%∶2.5%)喂养。4周后,在大鼠空腹状态下(所有大鼠禁食12 h),C组注射柠檬酸缓冲液(30 mg/kg),D组大鼠腹腔注射等量的STZ,注射72 h后尾静脉采血测血糖,连续2次空腹血糖(FBG)≥13.5 mmol/L者即为T2DM大鼠模型成功。
1.3 动物分组 从造模成功的D组大鼠中选择36只符合DM诊断标准的大鼠,随机分配将其分为3组:DM模型组(DM组)12只,依那西普治疗组(DE组)12只,肾康丸治疗组(DS组)12只。DE组大鼠给予腹部皮下注射依那西普(剂量2 mg/kg,1周2次);DS组大鼠予肾康丸(350 mg/d,相当于成人18 g/d)灌胃。C组和DM组大鼠灌服相应体积的生理盐水。实验期间C组大鼠、D组所有大鼠继续分别予标准饲料喂养、高脂高糖饲料喂养。实验室室温保持在20~24℃,相对湿度维持在40%。
1.4 标本收集、处理 给予药物第4周时,从每组大鼠中随机选6只大鼠留取尿液;于处死前1 d对此6只大鼠禁食12 h后并称体重,选取腹主动脉采血(10%水合氯醛300 mg/kg腹腔注射麻醉动物),分离血清,-20℃保存。处死大鼠选取左侧肾脏,称得肾脏重量,沿正中矢状面剖开,用PBS冲洗干净,去包膜,10%甲醛中性缓冲液固定以做HE染色,取右肾放入液氮保存,用于Q-RT-PCR检测。给予药物第8周时,每组另外6只大鼠按上述方法处理。
1.5 检测指标
1.5.1 血清生化指标 全自动生化分析仪检测大鼠血肌酐(Scr)、尿素(BUN)、FBG。
1.5.2 尿液标本 ELISA试剂检测Uα1-MG和24 h UmAlb。
1.5.3 Q-RT-PCR检测TNF-α、TRAILT、DR4、DcR2在各大鼠肾组织的表达 采用Sybrgreen染料法,以β-actin为内参基因,对于观察指标在肾组织的表达量进行检测。首先设计并合成Q-RT-PCR引物,序列如下:β-actin(EF-156276):β-actin-F 5′-CCAAC-CGTGAAAAGATGACCC-3′,长度21 bp,扩增长度113 bp;β-actin-R 5′-AATGCCAGTGGTACGACCAGAG-3′,长度22 bp。DcR2(NM-003840):DcR2-F 5′-ATCTGCTCAGGTGGTGGA-3′,长度18 bp,扩增长度118 bp ;DcR2-R 5′-TACTCAGGGTCTCGTTGC-3′,长度18 bp。DR4(NM-0038 44):DR4-F 5′-TGTTGCATCGG-CTCAGGTTG-3′,长度20 bp,扩增长度132 bp;DR4-R 5′-CGAGTCTGCGTTGCTCAGAA-3′,长度20 bp。TRAIL(NM-14 5681):TRAIL-F 5′-GAAGAGTGCCAGA AATAGC-3′,长度19 bp,扩增长度140 bp;TRAIL-R 5′-GGTCCAGGTCCATCAAAT-3′,长度18 bp。然后行总RNA抽提,再经过逆转录反应、普通PCR反应后,进行实时荧光定量PCR检测。制作标准曲线,用PCR仪检测,根据标准曲线公式计算样本拷贝数。
1.5.4 大鼠肾脏病理学 HE染色法在显微镜下观察拍照(取甲醛中性缓冲液中保存的左肾石蜡包埋,经脱水、浸蜡包埋、组织切片、染色)。

2 结果
2.1 治疗后各组大鼠血生化变化 给药第4周,D组大鼠BUN均升高,与C组比较其差异均有统计学意义(P<0.01);DM组BUN与DS组、DE组比较差异均有统计学意义(P<0.05),而DS组与DE组比较差异无统计学意义(P>0.05)。给药第8周后,D组与C组对比差异均有统计学意义(P<0.05);DM组与其他各组比较差异有统计学意义 (P<0.01);DS组BUN较DE组降低,其差异有统计学意义(P<0.01)。
给药后第4周,D组大鼠Scr均升高,C组与DM组、DS组比较差异有统计学意义(P<0.01);DE组与C组比较差异无统计学意义(P>0.05),与DM组、DS组比较差异有统计学意义(P<0.01);DS组与DM组比较差异无统计学意义(P>0.05)。给药后第8周,DM组Scr进一步升高,与其他3组比较差异均有统计学意义(P<0.01);DS组与C组、DE组比较差异无统计学意义(P>0.05)。
给药后第4周、第8周,相比于C组,D组大鼠FBG明显升高,差异有统计学意义(P<0.01);第4周相比于DM组,DS组、DE组大鼠FBG降低,第8周时更明显,但差异无统计学意义(P>0.05)。见表1。
表1 治疗后各组大鼠BUN、Scr、FBG变化

表1 治疗后各组大鼠BUN、Scr、FBG变化
组别nBUN(mmol/L)Scr(μmol/L)FBG(mmol/L)4周8周4周8周4周8周C组65.53±1.155.20±0.7349.18±4.7450.35±5.165.23±0.525.18±0.41DM组612.38±1.68∗∗15.76±2.45∗75.43±11.07∗∗▲81.57±10.01∗∗22.65±3.35∗∗22.99±2.15∗∗DS组610.25±1.36∗∗△7.74±1.58∗△△69.27±8.60∗∗▲55.68±9.97△△20.02±1.63∗∗18.92±2.53∗∗DE组610.07±2.37∗∗△9.88±1.81∗△△50.67±6.0651.50±3.39△△20.78±5.85∗∗16.68±6.77∗∗
与C组比较*P<0.05,**P<0.01;与DM组比较△P<0.05,△△P<0.01;▲与DE组比较P<0.01
2.2 治疗后各组大鼠Uα1-MG、UmAlb变化 治疗后第4、8周,D组大鼠Uα1-MG明显升高,与C组比较差异有统计学意义(P<0.01);DM组与DS组、DE组对比,差异有统计学意义(P<0.01,P<0.01)。DS组与DE组比较差异无统计学意义(P>0.05)。
治疗后第4、8周,D组大鼠UmAlb升高,DM组升高最显著,与各组比较差异有统计学意义(P<0.01);C组与DS组、DE组比较差异无统计学意义(P>0.05);DS组与DE组比较差异无统计学意义(P>0.05)。见表2。
表2 治疗后各组大鼠Uα1-MG、UmAlb比较
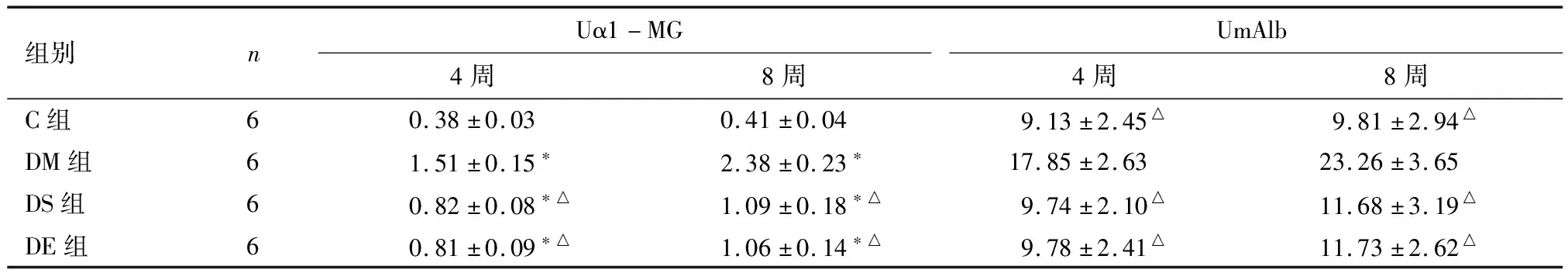
表2 治疗后各组大鼠Uα1-MG、UmAlb比较
组别nUα1-MGUmAlb4周8周4周8周C组60.38±0.030.41±0.049.13±2.45△9.81±2.94△DM组61.51±0.15∗2.38±0.23∗17.85±2.6323.26±3.65DS组60.82±0.08∗△1.09±0.18∗△9.74±2.10△11.68±3.19△DE组60.81±0.09∗△1.06±0.14∗△9.78±2.41△11.73±2.62△
*与C组比较P<0.01;△与DM组比较P<0.01
2.3 治疗后各组大鼠肿瘤坏死因子相关凋亡诱导配体变化 治疗后第4、8周,DM组TNF-α mRNA表达明显升高,与其余3组相比差异有统计学意义(P<0.01);C组与DS组比差异有统计学意义(P<0.05),与DE比较差异无统计学意义(P>0.05)。见表3。
第4、8周时,实验中的C组TRAIL mRNA表达明显较其他组别高,与DM组、DS组、DE组比差异均有统计学意义(P<0.01);DM组与DS组比差异有统计学意义(P<0.01),与DE组比较差异无统计学意义(P>0.05);DE组与DS组比差异有统计学意义(P<0.01)。见表4。
表3 各组大鼠治疗后TNF-α mRNA变化比较
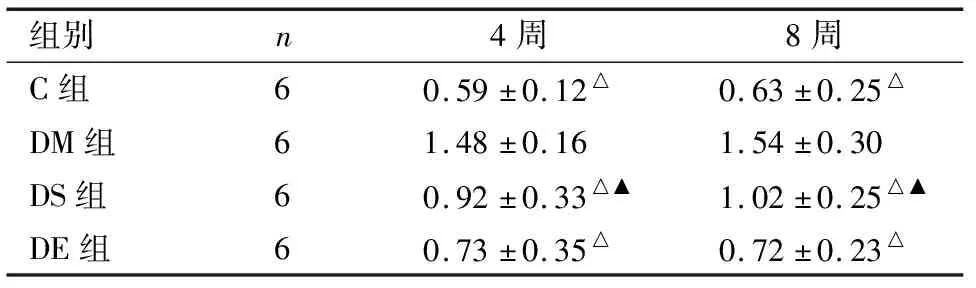
表3 各组大鼠治疗后TNF-α mRNA变化比较
组别n4周8周C组60.59±0.12△0.63±0.25△DM组61.48±0.161.54±0.30DS组60.92±0.33△▲1.02±0.25△▲DE组60.73±0.35△0.72±0.23△
△与DM组比较P<0.01;▲与C组比较P<0.05
第4、8周时,实验中C组DR4 mRNA表达明显升高,与DM组、DS组、DE组比差异均有统计学意义(P<0.01);DM组与DS组比差异有统计学意义(P<0.01),与DE组比较差异无统计学意义(P>0.05);DE组与DS组比差异有统计学意义(P<0.05)。见表4。
第4、8周时,实验中C组DcR2 mRNA呈低表达,与DM组、DS组、DE组比差异均有统计学意义(P<0.01);DM组呈高表达,与DS组、DE组比差异有统计学意义(P<0.01);相对比DS组,DE组差异无统计学意义(P>0.05)。见表4。
表4 TRAIL mRNA、DR4 mRNA、DcR2 mRNA在各组大鼠肾组织的表达

表4 TRAIL mRNA、DR4 mRNA、DcR2 mRNA在各组大鼠肾组织的表达
组别nTRAILmRNADR4mRNADcR2mRNA4周8周4周8周4周8周C组62.33±0.272.35±0.331.96±0.201.99±0.410.69±0.080.71±0.11DM组60.56±0.13∗0.71±0.18∗0.53±0.07∗0.71±0.26∗1.77±0.28∗1.95±0.29∗DS组61.16±0.23∗△1.25±0.23∗△1.06±0.40∗△1.16±0.29∗△1.18±0.24∗△0.96±0.20∗△DE组60.67±0.14∗∗0.74±0.15∗▲0.64±0.38∗▲▲0.67±0.27∗▲▲1.19±0.34∗△1.35±0.19∗△
*与C组比较P<0.01;△与DM组比较P<0.01;与DS组比较▲P<0.05,▲▲P<0.01
2.4 各组大鼠肾脏光镜下病理表现 光镜下见正常对照C组大鼠肾小球结构清晰,未见增生及萎缩,球囊壁光滑,细胞外基质与系膜细胞分布正常,毛细血管腔清晰。第4周时光镜下见DM组大鼠肾小球明显增大,肾小球肿胀、空泡变性,部分肾小球GBM增厚、肾小球系膜增宽;第8周时,上述改变更加明显。经药物治疗后大鼠肾脏病变较DM组减轻,其中DS组最明显,DE组次之,表现为肾小球肥大减轻,肾小球GBM增厚、肾小球系膜增宽有所改善。见图1。
3 讨论
糖尿病患者中有25%~40%最终出现DN[3]。DN是糖尿病最常见的微血管并发症之一,是引起终末期肾病(end-stage renal disease, ESRD)的主要原因,是1型糖尿病的主要死因,是严重威胁患者生命健康的首要原因[4-5]。DN在古代祖国医学尚未统一名字,中医的“肾消”、“水肿”、“肾劳”、“关格”等病的症状与DN相似,《素问奇病论》首次出现消渴之名,汉代张仲景《金匮要略》首见消渴肾病:“男子消渴,小便反多,以饮一斗,小便一斗,肾气丸主之”。现代医家吕仁及任继学、南征等研究了大量文献,结合临床实际和现代医学的有关知识,提出将本病定名为:“消渴肾病”[6]。
DN本虚标实,肾康丸方含有黄芪益气健脾,芡实、金樱子滋阴补肾兼固涩,滋而不腻,以益气养阴固肾;蝉蜕、玉米须利尿泻热以祛湿热毒;水蛭、益母草、山楂活血通络祛瘀,全方标本同治,在固护肾阴虚同时解血瘀热毒之标。其中黄芪、金樱子等已经被证实具有降血糖的功效,对糖尿病患者有肾保护作用。
目前大多数人认为[7-8]UmAlb增加是肾脏损伤的重要标志,是反映肾小球受损的敏感指标,肾小管损害的程度可通过Uα1-MG即DN早期诊断的敏感指标来准确地判断, 故本实验以Uα1-MG及UmAlb作为早期DN的检测指标。本研究结果显示,DM组大鼠尿mAlb和尿α1-MG呈持续升高趋势,DS组第4周即显示其可以减少DM大鼠尿mAlb和α1-MG的作用,在第8周更加明显,DE组与之有相近的作用。肾康丸及依那西普能改善T2DM2大鼠早期一般状况,降低大鼠血糖,减少尿微量蛋白、尿α1-MG的排泄,改善大鼠肾功能,具有肾脏保护作用。通过治疗,可减轻肾脏病理损害(图1),表现为肾小球肥大减轻,肾小球GBM增厚、肾小球系膜增宽有所改善,系膜细胞增生减轻;肾小管肥大、肾间质水肿减轻。
DM的发生、发展与TRAIL系统密切相关,TRAIL系统是TNF超家族新成员,通过介导受体表达参与细胞凋亡信号转导调控。TRAIL诱导细胞的凋亡是通过与细胞表面的死亡受体(Death Recepter, DR)中的DR4、DR5与TRAIL与高度特异性结合,通过受体的胞内死亡结构域启动细胞凋亡途径,但其抑制细胞凋亡是通过与诱骗受体(decoy receptor, DcR)中的DcR1、DcR2结合。有实验研究提示[9],DM大鼠肾脏细胞凋亡明显增加,主要发生在肾小管细胞,且TRAIL、DR4、DR5可能参与DM大鼠肾脏细胞凋亡的发生。在正常肾组织中DcR1没有表达[10],DR4和DR5在功能上非常相近,且DR4与TRAIL在肾组织表达情况相似,故本研究通过检测DR4 mRNA、DcR2 mRNA、TRAIL mRNA以了解TRAIL系统对细胞凋亡的调控。本研究中,各治疗组大鼠TNF-α mRNA在肾组织表达均减少,而依那西普在第4周即出现对TNF-α表达的明显抑制作用,并且持续到第8周。干预治疗后,DS组TRAIL和DR4在第4周、第8周均较治疗前及DM组明显增加;同时,DcR2的表达也发生了下调。DE组TRAIL和DR4的表达增加不明显,与DM组大鼠比较无统计学差异,其表达量显著低于DS组;DcR2的表达有类似的现象。由此可证明,肾康丸与依那西普对肾脏保护的作用机制并不一致,肾康丸可减少TNF-α在早期DN肾脏的表达,上调TRAIL及其受体DR4的表达,抑制DcR2的表达,对肾脏有保护性作用。有研究称[11],高糖环境下,肾小球内皮细胞极易受损,炎症因子激活,可诱导TNF-α等表达增加,直接破坏肾小球滤过屏障,导致直接的肾损害,在DM的发生、发展中起关键作用。依那西普是一种TNF-α拮抗剂[12],可减少TNF-α mRNA的表达,阻断关键性炎症因子TNF-α与其受体结合,减少多转导途径引起炎症因子(IL-6、CRP等)升高,从而减轻炎症反应,血管平滑肌细胞增殖得到抑制,肾脏血管病变减轻,本研究证实了其对肾组织TNF-α特异性的阻断作用,从而对肾脏的保护作用。
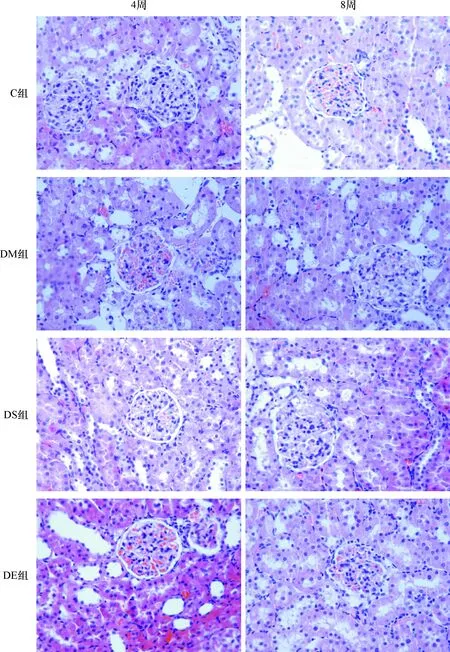
图1 各组大鼠肾脏(HE,×200)
综上所述,肾康丸与依那西普对T2DM大鼠肾脏组织均有保护作用,其作用机制并不一致。同时TRAIL在糖尿病大鼠肾脏中的表达也说明肾脏局部的免疫系统参与了DN的发生、发展,但其在DN中作用不清楚,其受体在DN的发病机制也需进一步探索。
