潮州市妊娠妇女甲状腺激素参考范围的探讨
2019-09-09刘小翠陈伟忠
刘小翠, 陈伟忠
潮州市人民医院内分秘科(广东潮州 521000)
甲状腺疾病是一个常见的临床问题,发病以女性居多,而女性在怀孕后生理发生各种变化,包括甲状腺激素的变化,因此妊娠期甲状腺疾病也成为孕期最常见的疾病。孕期甲状腺激素的紊乱可同时影响母体及胎儿,对母体可导致各种妊娠并发症;对于胎儿,最大影响是神经发育迟缓,导致其出生后智力低下[1-3]。因此孕期早期诊断及治疗甲状腺疾病至关重要。有研究发现[4],妊娠妇女甲状腺疾病的诊断如使用一般人群的参考范围,将造成甲状腺疾病的漏诊或者过度诊断,因此美国国家临床生化学院(The National Academy of Clinical Biochemistry,NACB)建议: 妊娠期妇女甲状腺激素水平应根据孕期使用特异性参考值范围[5],同时我国也在2012年颁布了《妊娠和产后甲状腺疾病诊治指南》,建议制定符合本地区妊娠妇女的特异性甲状腺激素参考范围[6]。潮州市尚未建立本地区的妊娠妇女的特异性甲状腺激素参考范围,本研究主要是通过对本市妊娠各期孕妇的血清甲状腺激素水平进行检测,建立潮州地区妊娠妇女特异性甲状腺激素的参考值范围,为临床诊断提供参考依据。
1 资料与方法
1.1 一般资料 选取 2018年1—12月在我院门诊产检的534例妊娠妇女作为观察组,按孕期分为3组:孕早期 (孕1~12周)178例、孕中期 (孕13~27周)178例、孕晚期 (孕 28~40周)178例。各组年龄分别为(29.64±4.13)岁、(28.90±4.27)岁、(28.93±4.26)岁。同时选取在本院行健康体检的非妊娠期妇女 178例为对照组,年龄 (29.13±4.59)岁,4组研究对象的年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准 参考NACB推荐的标准[5-6],纳入标准:(1)年龄20~40周岁;(2)生长并长期居住潮州本地区;(3)正常单胎妊娠;(4)不使用影响甲状腺激素水平的药物。排除标准:(1)双胎妊娠或体外受精后怀孕的妇女;(2)有甲状腺疾病的个人史及家族史;(3)有自身免疫疾病史;(4)可触及甲状腺肿大;(5)甲状腺自身抗体(甲状腺过氧化物酶抗体、甲状腺球蛋白抗体)阳性。
1.3 方法 所有研究对象均抽取清晨空腹静脉血3 mL,以 3 000 r/min离心 15 min,置于-80℃冰箱中保存待检,采用电化学发光法检测血清游离三碘甲状腺原氨酸 (freetriiodothyronine,FT3)、游离甲状腺素 (freethyroxine,FT4)及促甲状腺素 (thyroidstimulatinghormone,TSH)。仪器:雅培i2000全自动化学发光免疫分析仪。试剂:甲状腺素检测试剂(美国雅培公司),参考范围:FT3:2.63~5.7 pmol/L,FT4:9.01~19.05 pmol/L,TSH:0.35~4.94 mIU/L。

2 结果
2.1 4组甲状腺激素检测结果的比较 4组血清FT3、FT4及TSH的比较差异有统计学意义(P<0.01),见表1。

表1 4组血清FT3、FT4及TSH检测结果的比较 M(P2.5,P97.5)
*与对照组比较P<0.01;△与孕中期组比较P<0.01;▲与孕晚期组比较P<0.01
2.2 4组血清FT3、FT4及TSH的参考值范围 FT3和 FT4在孕早期最高,随着孕周的增加而下降,至孕晚期降至最低水平;TSH在孕早期较低,随孕周的增加而逐渐上升,至孕晚期达最高。对照组的参考范围与本实验室原有的参考范围相同,见表2。
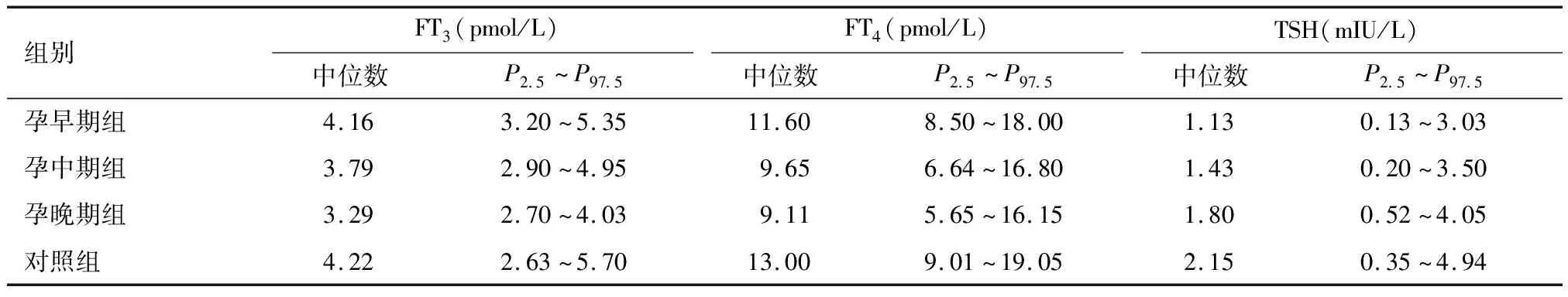
表2 4组血清FT3、FT4及TSH的参考范围
2.3 各参考值范围诊断妊娠期亚临床甲状腺功能减退症(甲减)的结果 分别使用ATA参考值及本研究参考值对观察组进行亚临床甲减的诊断,患病率孕早期分别为 8.43% 和 2.25%,孕中期分别为11.24%和1.06%,孕晚期分别 为15.73%和 3.93%,差异均有统计学意义(P<0.01),亚临床甲减的患病率使用特异性参考范围明显低于ATA标准,见表3。

表3 参考值范围诊断妊娠期亚临床甲减结果 例(%)
3 讨论
妊娠后母体的甲状腺激素发生各种变化,原因包括:(1)甲状腺激素结合球蛋白(TBG)增加:妊娠期间发生的血清总T4和总T3的增加是由于血清TBG浓度的增加所致。TBG早期发生改变,在妊娠16~20周,TBG浓度增加了1倍[7],血清TBG显著增加的原因可能是多因素的,其中重要原因是妊娠后雌激素的刺激作用,还有一个原因是蛋白质清除能力的降低[8]。结合型甲状腺激素的增高使游离的甲状腺激素减低,反馈刺激TSH的增高[9]。(2)人绒毛膜促性腺激素(HCG)升高:HCG和TSH之间的结构同源性已经表明HCG可通过其自然功能的重叠而充当促甲状腺素激动剂。人HCG具有固有的的促甲状腺活性,甚至可能具有直接的促甲状腺激素分泌的活性[10]。在正常妊娠期间,HCG对甲状腺细胞的直接刺激效应在妊娠前3个月结束时诱导小的和瞬时的FT4水平增加,进而导致部分TSH抑制[10-11]。(3)脱碘酶活性增加:在妊娠中后期,由于胎盘脱碘酶(Ⅱ型和Ⅲ型)活性均增强,甲状腺激素分解增加[12]。(4)碘代谢:妊娠早期肾血流量和肾小球滤过量增加,导致血浆碘清除率增加,这导致血浆碘浓度下降,到妊娠中晚期,胎儿合成甲状腺素需经胎盘转运,导致母体碘进一步丢失,相应的对碘的需求也进一步增加[11,13]。以上变化导致妊娠期妇女甲状腺激素与正常人的差异,因此建立妊娠期甲状腺激素参考范围十分必要。
妊娠期甲状腺激素水平的变化与其生理变化是一致的。Sun 等[14]研究浙江省孕妇甲状腺激素水平发现,TSH水平在妊娠前3个月下降,然后随着妊娠的进展而升高,而FT3在孕早期升高,然后逐渐下降。Yu等[15]研究北京地区孕妇甲状腺激素水平发现,妊娠期血清FT4、FT3随孕周逐渐降低,TSH则逐渐升高。本研究结果提示TSH在孕早期最低,孕中晚期逐渐增高,而FT3和 FT4在孕早期最高,孕中晚期逐渐降低,妊娠期甲状腺激素水平及正常人比较差异有统计学意义(P<0.01),结果与各研究报道一致。
我国2012年《妊娠和产后甲状腺疾病诊治指南》也列出了国内不同单位不同试剂监测甲状腺激素的参考范围[16],本研究采用雅培试剂,TSH参考范围早中晚期分别为0.13~3.03、0.20~3.50、0.52~4.05 mIU/L,FT4早中晚期分别为8.50~18.00、6.64~16.8、5.65~16.15 pmol/L,FT3早中晚期分别为3.20~5.35、2.90~4.95、2.70~4.03 pmol/L,与指南雅培试剂制定参考范围不同,整体水平稍偏低,同时与国内不同地区制定的甲状腺激素水平范围也略有不同,周意园等[17]使用雅培试剂盒检测,建立贵阳地区妊娠妇女甲状腺激素参考值范围,妊娠早中晚期的TSH分别是 0.11~4.26、0.55~4.67、0.58~4.95 mIU/L;FT3分别是3.68~5.47、3.54~4.65、3.17~4.64 pmol/L;FT4分别是 12.11~19.48、11.37~19.46、9.75~17.27 pmol/L,与本实验参考范围也略有不同。而同为广东省的广州市花都地区的黄翌等[18]研究,采用罗氏试剂盒监测,制定该地区的参考范围也与本研究结果不同,各地区差异可能与地区性的碘营养水平、人群差别、检测试剂等相关。
2011美国ATA年颁布的《妊娠期及产后甲状腺疾病诊治指南》中推荐的妊娠早中晚期TSH的特异性参考值范围分别为 0.1~2.5、0.2~3.0、0.3~3.0 mIU/L[19]。本研究制定TSH参考范围早中晚期分别为0.13~3.03、0.20~3.50、0.52~4.05 mIU/L,用两种不同参考范围对妊娠妇女进行亚临床甲减的诊断,患病率孕早期分别为 8.43% 和 2.25%,孕中期分别为11.24%和1.06%,孕晚期分别 为15.73%和 3.93%,差异均有统计学意义(P<0.01),采用本研究参考值范围诊断亚临床甲减的患病率较ATA标准低,总检出率为3.18%,国外Brian等[20]研究提示妊娠亚临床甲减患病率为2%~4%,国内腾卫平等[21]通过对国内10个不同城市的妊娠妇女的研究发现亚临床甲减的患病率5.23%,使用ATA提供参考范围诊断甲状腺疾病将造成误诊率增加,造成不必要的过度检查及治疗。
综上所述,本研究首次建立了潮州地区妊娠期甲状腺激素水平的特异性参考值范围,为本地区妊娠期甲状腺疾病的诊断提供了可靠依据,不足之处是本研究样本量仍偏少,今后可进一步扩大样本量,得出更为准确的妊娠期甲状腺激素水平参考值范围。
