右美托咪定调控Nrf2/HO-1信号通路对气腹大鼠肺脏氧化应激损伤的保护作用*
2019-09-09闫焱佘守章
闫焱, 佘守章
广州市第一人民医院麻醉科(广东广州 510180)
腹腔镜手术具有创伤小、住院时间短、并发症少、康复快等优点,手术过程中常用的气腹压力是10~15 mmHg,气腹时发生缺血再灌注,导致氧化和抗氧化之间失衡,即氧化应激反应,是气腹致器官损伤的重要机制。与其他器官相比,肺脏处于较高氧浓度下,对于氧化应激反应尤其敏感,肺脏形成了许多抗氧化防御机制以减少氧化物和维持肺脏的氧化平衡。核转录因子E2相关因子2(Nrf2)可促进抗氧化基因如血红素加氧酶-1(HO-1)的转录,激活的HO-1催化血红素分解释放胆绿素,进一步降解为具有强大抗氧化能力的胆红素[1],因此Nrf2/HO-1在抗氧化应激中发挥重要作用。右美托咪定(dexmedetomidine,Dex)作为肾上腺素能受体激动剂,对α2受体具有高选择性,用于临床镇静、镇痛及全麻辅助用药,可抑制全身炎症反应和氧化应激,对炎症和氧化应激相关的疾病起到保护作用[2]。2018年3—11月,本研究建立CO2气腹大鼠模型,探讨Dex可否通过调控Nrf2/ HO-1信号传导通路,改善气腹对大鼠肺脏氧化应激的损伤。
1 材料与方法
1.1 药品与试剂 盐酸右美托咪定注射液由江苏恒瑞医药公司生产;大鼠组织MDA和8-iso PGF2α ELISA检测试剂盒购自美国Cayman公司;兔抗鼠Nrf2抗体、HO-1抗体、β-actin购自美国 Santa Cruz公司,山羊抗兔二抗购自美国Cell Signaling公司;引物由大连TaKaRa公司合成。
1.2 实验动物 由广东省医学实验动物中心提供SD雄性大鼠60只,选取3~4周龄大鼠,体重250~280 g。遵循实验动物伦理学,实验动物统一饲养在动物实验中心,课题研究通过医院实验动物伦理委员会审查批准。将动物置于安静,自然光的环境饲养48 h以上,保持动物在恒温(23℃±3℃),相对湿度(50±10)%,12 h~12 h昼夜节律,自然饮水、进食。
1.3 气腹模型建立与分组 大鼠随机分为3组(n=20):对照组(C组)、气腹组(P组)、右美托咪定组(D组)。参照文献[3]建立大鼠气腹模型,经大鼠腹腔注射Ketamine 80 mg/kg实施麻醉,根据需要追加腹腔内用药。大鼠麻醉后,仰卧于手术台,由脐下向腹腔内插入20号套管针,C组不充入CO2气体;P组和D组通过气腹导管连接气腹机(Stryker),以12 mmHg压力充入CO2气体2 h。D组于气腹前30 min腹腔内注射Dex 100 μg/kg,C组和P组注射相同容量的0.9%生理盐水。实验结束后,气腹放气,将大鼠送返笼中,笼子底部铺有软锯屑,在安静的环境中自由喂养。
1.4 实验样本获取与处理 分别在气腹2 h(T1)、放气2 h(T2)、放气6 h(T3)、放气12 h(T4)各组随机选取5只大鼠,分离暴露双侧肺脏及气管,取右肺组织用冰生理盐水漂洗、称重,置研磨器中,加入1 mL PBS研磨至10%匀浆,离心机4℃,3 000 r/min离心10 min,取上清分装,-20℃保存待测。取左肺组织,液氮冷冻,-80℃保存备用。
1.5 肺组织MDA、8-iso PGF2α水平测定 酶联免疫吸附法(ELISA)检测肺组织MDA、8-iso PGF2α水平。取步骤1.4制备的10%肺组织匀浆,按照试剂说明步骤测定肺组织MDA和8-iso PGF2α含量。
1.6 Western blot检测肺组织Nrf2和HO-1蛋白表达 分离左肺部分肺组织提取蛋白,BCA法检测蛋白浓度,SDS-PAGE胶分离蛋白,电转移至PVDF膜,封闭膜1 h后加入Nrf2(1∶1 500)、HO-1(1∶1 000)、β-actin抗体(1∶3 000),4℃过夜。第2天洗膜后用二抗生物素标记山羊抗兔IgG杂交(1∶5 000)。
1.7 RT-PCR检测Nrf2和HO-1 mRNA表达 取已制备匀浆,用Trizol一步法提取肺脏组织总RNA,逆转录合成cDNA,作为Real-time PCR扩增模板。以β-肌动蛋白(β-actin)作为内参照,Nrf2和HO-1为待测基因。利用Primer 5.0软件设计特异引物,序列及扩增片段长度[3](表1),所得靶基因相对定量=2-ΔΔCt。

表1 RT-PCR引物序列
1.8 统计学方法 采用SPSS 17.0统计软件,应用完全随机设计的单因素方差分析。使用重复测量数据多重比较配对的t检验法(Bonferroni法),对组间和组内不同观测时间点进行两两比较;使用多元方差分析法,对各时点进行组间两两比较。实验数据以均数±标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 Dex降低气腹大鼠肺组织氧化应激指标MDA和8-iso PGF2α水平的升高 T1时MDA和8-iso PGF2α P组和D组明显高于C组,且P组高于D组(P<0.01)。T2时测得P组和D组开始下降,P组明显低于T1,但高于D组和C组(P<0.01);D组明显下降,仍高于C组(P<0.01)。至T3,P组和D组呈持续下降趋势,低于T2时点,D组已接近C组水平,P组仍高于D组和C组(P<0.01)。T4测得的MDA(F=1.335,P=0.3)和8-iso PGF2α(F=2.111,P=0.164)水平3组间差异无统计学意义(P>0.05)。见表2。
2.2 Dex上调Nrf2和HO-1蛋白表达 T1时,P组和D组Nrf2和HO-1的蛋白高于C组,且D组高于P组(P=0.001);在T2时P组和D组Nrf2和HO-1的蛋白表达持续增高,T3表达有所下降,但是D组仍高于P组和C组(P=0.001),至T4,D组和P组Nrf2和HO-1蛋白表达接近C组,3组组间比较差异无统计学意义(Nrf2:F=0.589,P=0.57;HO-1:F=0.322,P=0.731)。见图1、表3。
表2 3组各时点MDA、8-iso PGF2α水平比较

表2 3组各时点MDA、8-iso PGF2α水平比较
项目组别T1T2T3T4MDAC组327.1±3.2328.9±4.3327.2±3.1329.5±4.4P组513.2±10.1∗421.7±12.7∗#352.9±6.5∗#▲332.1±4.4#▲D组426.8±18.1∗△369.0±4.7∗△#332.5±3.8∗△#▲327.8±2.8#▲8-isoPGF2αC组83.9±1.982.9±3.683.2±1.781.6±1.8P组178.2±5.2∗107.1±5.2∗#91.8±2.2∗#▲83.9±1.1#▲D组118.3±3.3∗△90.8±3.2∗△#85.7±2.0∗△#83.1±2.1#▲
*与C组同时点比较P<0.01;△与P组同时点比较P<0.01;#组内与T1时点比较P<0.01;▲组内与T2时点比较P<0.01

A、B:3组Nrf2蛋白表达;C、D:3组HO-1蛋白表达
2.3 Dex激活Nrf2/HO-1信号通路 以C组肺组织Nrf2 mRNA 为对照样品,其相对表达量为1,计算各组肺组织Nrf2 mRNA 的相对表达量。结果显示P组和D组Nrf2的mRNA表达在T1增加,高于C组(P=0.001);Dex可引起表达进一步增强,D组明显高于P组(P=0.001)。在T2、T3时,D组Nrf2 mRNA表达明显高于P组和C组,T4时已逐渐回复,3组间差异无统计学意义(F=2.6,P=0.115)。HO-1 mRNA表达趋势与Nrf2基本是一致的,在气腹T1、T2和T3,D组HO-1 mRNA表达明显高于P组和C组,T4时,3组间差异无统计学意义(F=3.0,P=0.088)。见图2、表4。
表3 3组各时点Nrf2和HO-1蛋白相对表达量的比较(n=5)

表3 3组各时点Nrf2和HO-1蛋白相对表达量的比较(n=5)
项目组别T1T2T3T4Nrf2C组0.528±0.0310.526±0.0290.536±0.0360.534±0.023P组0.751±0.027∗0.882±0.019∗0.974±0.027∗0.549±0.032D组1.084±0.048∗△1.232±0.033∗△1.464±0.038∗△0.551±0.053HO-1C组0.644±0.0260.650±0.0390.643±0.0200.634±0.023P组1.062±0.027∗1.591±0.029∗1.886±0.054∗0.648±0.025D组1.408±0.05∗△2.218±0.065∗△2.831±0.08∗△0.651±0.034
*与C组同时点比较P<0.01;△与P组同时点比较P<0.01
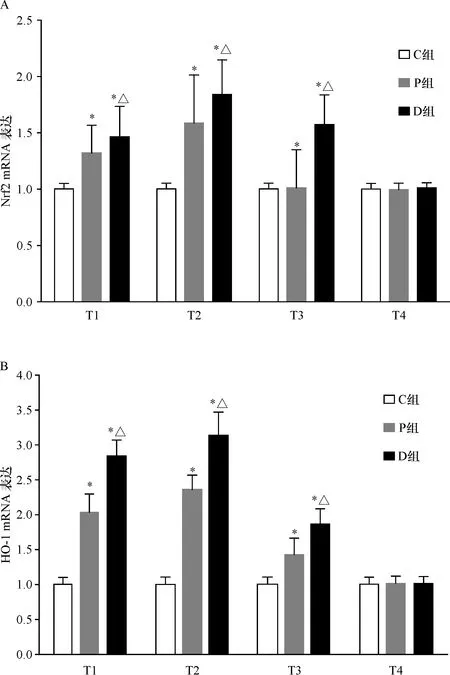
A:3组Nrf2 mRNA表达;B:3组HO-1 mRNA表达
表4 3组各时点Nrf2和HO-1 mRNA相对表达量的比较(n=5)

表4 3组各时点Nrf2和HO-1 mRNA相对表达量的比较(n=5)
项目组别T1T2T3T4Nrf2C组1111P组1.322±0.24∗1.586±0.42∗1.01±0.34∗1.00±0.05D组 1.461±0.27∗△ 1.834±0.31∗△ 1.564±0.27∗△1.01±0.05HO-1C组1111P组2.03±0.25∗2.35±0.21∗1.43±0.23∗1.01±0.10D组 2.83±0.23∗△ 3.13±0.33∗△ 1.87±0.21∗△1.01±0.11
*与C组同时点比较P<0.01; △与P组同时点比较P<0.01
3 讨论
腹腔镜手术时,CO2气腹导致缺血-再灌注可使机体产生多种自由基,损害细胞功能,从而发生氧化应激反应。再灌注过程中活性氧(ROS)及其毒性产物大量释放导致DNA损伤、脂质过氧化、线粒体膜和细胞损害,在生理状态下,肺脏的骨髓过氧化物酶、黄嘌呤氧化酶等途径都可以产生ROS,因此维持细胞内外氧化和抗氧化平衡是保证肺脏稳态的关键。
Dex在药物研究领域广泛用于从肺损伤到肺癌等肺脏疾病的治疗[4-5],可减轻缺血再灌注引起的肺脏损伤[6],降低氧化应激反应发挥肺保护作用,目前日益得到临床关注和认可[7]。有研究[8]发现Dex通过抑制ROS的释放减轻氧化应激引起的肺泡上皮细胞凋亡,Dex预处理可降低单肺通气中MDA水平,增强抗氧化酶活性[9]。本研究建立CO2气腹大鼠模型,检测到P组和D组肺组织中氧化应激标记物MDA和8-iso PGF2α水平明显高于C组,而D组的水平明显低于P组,证明Dex在降低CO2气腹引起的肺脏氧化应激损伤中起到重要的作用。我们推断Dex调节超氧化与抗氧化间的平衡,从而保护气腹所致肺损伤。
Nrf2是细胞内重要的转录因子,对氧化还原反应敏感,调控多种抗氧化蛋白在肺脏的表达,其调控的抗氧化物及抗氧化物酶大多位于支气管和肺泡上皮细胞、肺泡巨噬细胞和细胞外环境[10],保护肺脏免受氧化物损伤。氧化应激损伤时,Nrf2发生核移位,与抗氧化反应元件(ARE)结合,激活包括应激蛋白——HO-1等抗氧化物酶的转录。HO-1是Nrf2调控的下游基因,被认为是最强的抗氧化蛋白,Nrf2上调HO-1表达,HO-1及其产物通过保护氧化损伤、调节细胞凋亡和炎症反应等发挥保护作用[11],Nrf2和HO-1被认为是抗氧化防御机制中关键的调控因子[12]。在单肺通气中,Dex能够增高HO-1表达,降低氧化应激反应[9]。而在脂多糖诱发肺损伤的大鼠,Dex预处理可通过激活Nrf2减轻肺脏损伤[13]。本研究结果,CO2气腹刺激肺脏Nrf2和HO-1蛋白及mRNA表达明显增高,反映肺脏氧化应激的发生,Dex预处理进一步增加气腹引起的肺脏Nrf2和HO-1表达增高。因此,Dex在CO2气腹引起的肺损伤中的抗氧化应激作用可通过Nrf2/HO-1信号通路的激活来实现。
综上所述,Dex可降低CO2气腹大鼠肺脏氧化应激指标MDA和8-iso PGF2α水平,增强肺组织Nrf2、HO-1 mRNA和蛋白的表达。证明CO2气腹所致肺脏氧化应激损伤,Nrf2及其调控基因HO-1表达上调,Dex通过激活Nrf2/HO-1信号通路,抑制氧化应激反应,对CO2气腹大鼠产生肺保护作用。
