内蒙古呼伦贝尔地区羊源多杀性巴氏杆菌荚膜血清群分子流行病学调查
2019-09-09乌云塔娜格根塔娜刘连发田宗民苏日古格贾长生王冠玉赵忠武
王 巍,乌云塔娜,格根塔娜,刘连发,田宗民,邱 凯,苏日古格,贾长生,王冠玉,赵忠武
(1. 内蒙古呼伦贝尔市兽医科学研究所,内蒙古海拉尔 021000;
2. 新巴尔虎右旗动物疫病预防控制中心,内蒙古新巴尔虎右旗 021300;
3. 海拉尔区动物疫病预防控制中心,内蒙古海拉尔 021000)
巴氏杆菌属(Pasteurellaceae)是发现较早的一类细菌,已报道有多种。根据《伯杰氏鉴定细菌手册》,本属细菌主要有多杀性巴氏杆菌、溶血性巴氏杆菌、侵肺巴氏杆菌、产气巴氏杆菌、鸡巴氏杆菌等。它们在形态上颇为相似,但在致病性、生化特性和抗原性上不尽相同。多杀性巴氏杆菌(Pasteurella multocida)是本属中最重要的致病菌,巴氏杆菌病主要由其引起。该菌具有异质性特征,可导致猪肺疫、禽霍乱以及牛、羊、兔出血性败血症等危害严重的畜禽传染病。巴氏杆菌病潜伏期短,传播速度快,死亡率高,可呈暴发性流行,常对养殖业造成巨大经济损失,属我国规定的二类动物疫病[1-2]。
因多杀性巴氏杆菌的荚膜抗原具有不相同的性质,按照Carter 等[3]提出的血清学标准分型方法以及间接血凝试验数据,将其分为 A、B、D、E、F 5 个荚膜血清群,其中A 群菌株的荚膜主要为透明质酸,B 群和E 群的是酸性多糖[4]。据报道,在我国畜禽中流行的多杀性巴氏杆菌荚膜血清群主要是A、B、D 3 个群。荚膜血清群虽然决定了巴氏杆菌的免疫原性,但各血清群之间多数无交叉免疫原性,比如免疫了B 群多杀性巴氏杆菌,却无法保护畜禽抵御A 群的攻击,因此利用分子生物学手段鉴定多杀性巴氏杆菌以及对该菌进行荚膜分型就显得尤为重要[5]。
呼伦贝尔市近年来牛、羊多杀性巴氏杆菌病时有发生。目前对牛使用的疫苗株为B 型,而对羊尚无疫苗可用,且全市羊源巴氏杆菌荚膜血清群的流行状况呈空白状态。本研究通过建立多杀性巴氏杆菌分子生物学诊断方法,利用多重PCR 技术,对呼伦贝尔市羊源多杀性巴氏杆菌进行检测,以掌握该市羊源多杀性巴氏杆菌荚膜血清群流行情况,同时进行药物敏感性试验,找到针对本地区流行株的敏感药物,为多杀性巴氏杆菌病的流行病学监测、防控和诊断治疗提供依据。
1 材料与方法
1.1 病料来源
2017 年1 月至2018 年10 月,本实验室共收集呼伦贝尔市35 份疑似巴氏杆菌感染病羊肺组织病料。大部分病羊主要表现为,体温升高、精神沉郁、食欲废绝、咳嗽、腹泻、眼结膜潮红,有的颈部发生水肿,病程为2~5 d;个别羊突然发病,全身寒战、虚弱、呼吸困难并伴有抽搐等症状,数小时内死亡。大部分病死羊剖检可见,胸腔内有黄色积液,肺淤血、充血、水肿,有小出血点和肝变,脾脏肿大且边缘不齐,胃肠道有出血性炎症,心脏苍白、质地柔软。少数病死羊组织器官病变不明显,仅肺部有病变。
1.2 试验材料
酵母提取粉、胰蛋白胨:均购自广东环凯微生物科技有限公司;革兰氏染色液、瑞士染色液:购自南京建成科技有限公司;DL 2 000 bp DNA Marker、Hot Master Tag DNA Polymerase 聚合酶、细菌基因组 DNA 提取试剂盒:均购自天根生化科技(北京)有限公司;抗菌药敏纸片:购自杭州微生物试剂有限公司。
1.3 实验室镜检
将35 份肺组织取新鲜部位进行涂片、干燥、固定,用革兰氏染色法和瑞士染色法染色镜检,观察形态特征。
1.4 细菌培养
将35 份肺组织分别取新鲜部位划线接种于LB 血琼脂平板固体培养基,37 ℃培养24 h,观察菌落生长情况,并将疑似菌落进行染色镜检。同时取新鲜无菌病料,划线接种于普通LB 琼脂培养基及麦康凯培养基。
1.5 细菌DNA 提取
挑取不同肺组织LB 血琼脂平板上单个菌落,接种于含5% 胎牛血清的LB 液体培养基中,37 ℃200 r/min,震荡孵育18~24 h;分别取2 mL 培养菌液 2 500 g 离心10 min,弃上清;采用天根生化科技(北京)有限公司细菌DNA 提取试剂盒进行DNA 提取。
1.6 双重PCR 鉴定
参考Townsend 等[6]研究合成的多杀性巴氏杆菌特异性KMT1 基因引物以及A、B、D、E、F 群的荚膜血清群特异性基因引物(表1),引物由北京华大基因生物技术服务有限公司合成。将上述1.5 步骤提取的基因组DNA 作为PCR 扩增模板,先用鉴定巴氏杆菌KMT1 基因的引物扩增待检样品,然后利用鉴定荚膜血清群capA、capB、capD、capE、capF 基因的引物进行双重PCR 扩增目标序列。两轮PCR 反应体系及条件一样,采用50 μL 反应体系:上下游引物各2 μL,10×PCR Buffer 5 μL,dNTP Mixture(2.5 mmol/L)4 μL,ddH2O 34.5 μL,Taq DNA Polymerase(5 U/μL,含MgCl2)0.5 μL,DNA 模板2 μL。反应条件:95 ℃5 min 预变性;94 ℃ 30 s 变性,55 ℃ 30 s 退火,72 ℃ 45 s 延伸,30 个循环;72 ℃ 5 min 后延伸。
1.7 序列测定和进化树分析
将扩增出的阳性样品送吉林库美生物技术有限公司测序鉴定,将结果与Genbank 发表的多杀性巴氏杆菌序列进行比对分析。搜索Genbank 中已提交的多杀性巴氏杆菌序列,应用BioEdit 软件,与测序阳性样品进行序列比对,用MEGA 7.0 软件,绘制进化树进行同源性分析。

表1 多杀性巴氏杆菌特异引物序列
1.8 药敏试验
药敏试验参照国家检验操作规程,采用K-B纸片琼脂扩散法[7],对分离鉴定株进行9 种抗菌药的耐药性检测,包括青霉素、链霉素、克林霉素、复方新诺明、诺氟沙星、环丙沙星、卡那霉素、氯霉素、四环素。具体步骤:将待检菌落划线接种至含5% 胎牛血清的LB 液体培养基中,37 ℃200 r/min,震荡孵育18~24 h;次日,用生理盐水调整菌液浓度至108CFU/mL,取100 μL 菌液至LB 鲜血固体琼脂平板上,并涂抹均匀。在保持纸片间适当距离的基础上,用无菌镊子把各药敏片按顺序平铺于培养基表面,室温放置吸收5 min 后,倒置于37 ℃温箱内恒温培养24 h。药物选择参照呼伦贝尔市羊病常用药物及相关文献[2,8-11],判定方法参照杭州微生物试剂有限公司药敏纸片判断标准,抑菌圈直径≥15 mm 判定为敏感,10~15 mm判定为中度敏感(中介),<10 mm 判定为耐药。
2 结果
2.1 菌株形态特征和生长特性
35 份病料中,经革兰氏染色镜检,有21 份可见两端钝圆、两极着色的阴性短杆菌;瑞士染色发现无鞭毛及芽孢,荚膜显著。将35 份病料接种于LB 血琼脂固体培养基,发现上述21 份镜检阳性病料的分离菌株在血平板上生长良好,呈清亮、淡灰白色露珠状,且湿润黏稠,菌落周围不溶血,而在普通LB 琼脂培养基上生长贫瘠,几乎不生长,在麦康凯琼脂培养基上不生长。上述镜检阴性的14份病料在3 种培养基上均无菌落生长(图1)。
2.2 双重PCR 鉴定
21 份培养的阳性菌株用多杀线巴氏杆菌特异性KMT1 基因引物均扩增出460 bp 的片段,用特异性 KMT1 基因引物,分别与A、B、D、E、F 群的荚膜血清群特异性引物进行双重PCR 扩增,发现其中12 份样品KMT1 和B 群引物扩增出近460 bp和760 bp 两条特异性条带,9 份样品KMT1 和D群引物扩增出近460 bp和648 bp两条特异性条带,21 份样品中KMT1 和A 群、KMT1 和E 群、KMT1和F群都只扩增出一条460 bp的特异性条带(图2)。
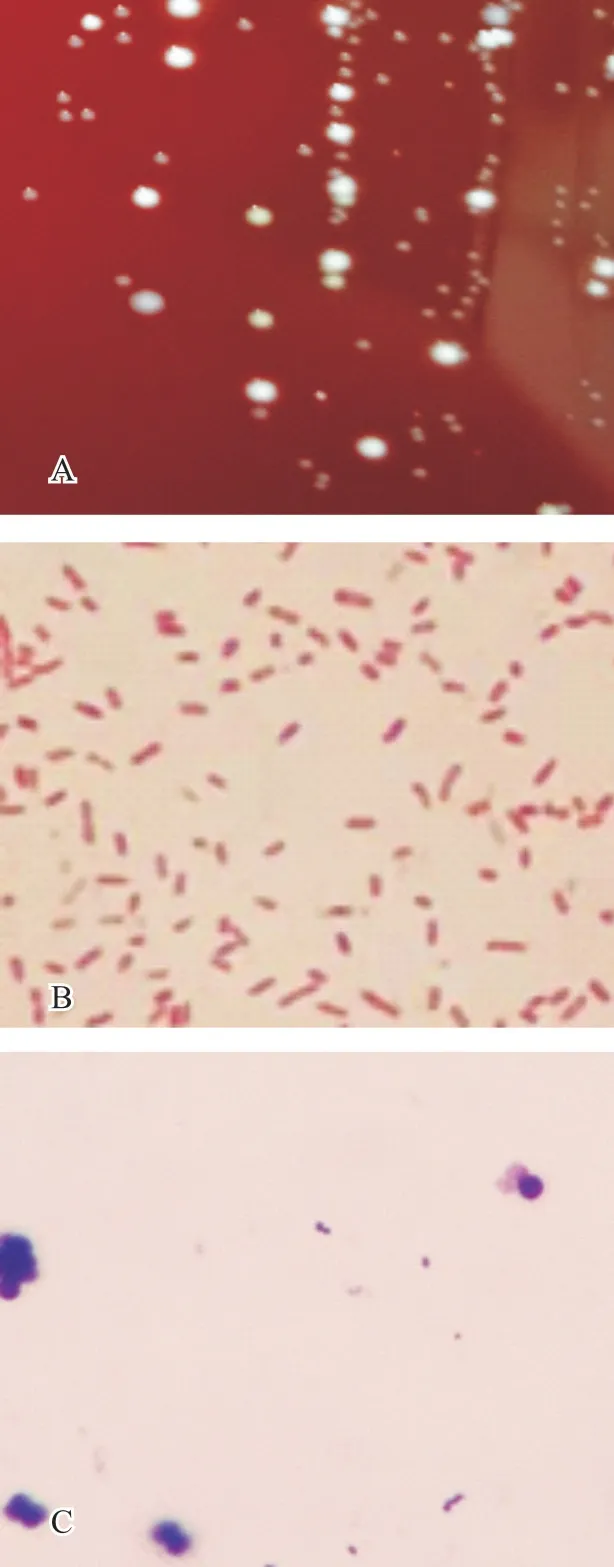
A. 血平板;B. 革兰氏染色(1 000×);C. 瑞氏染色(1 000×)。图1 分离菌株血平板培养生长情况及革兰氏、瑞氏染色镜检结果
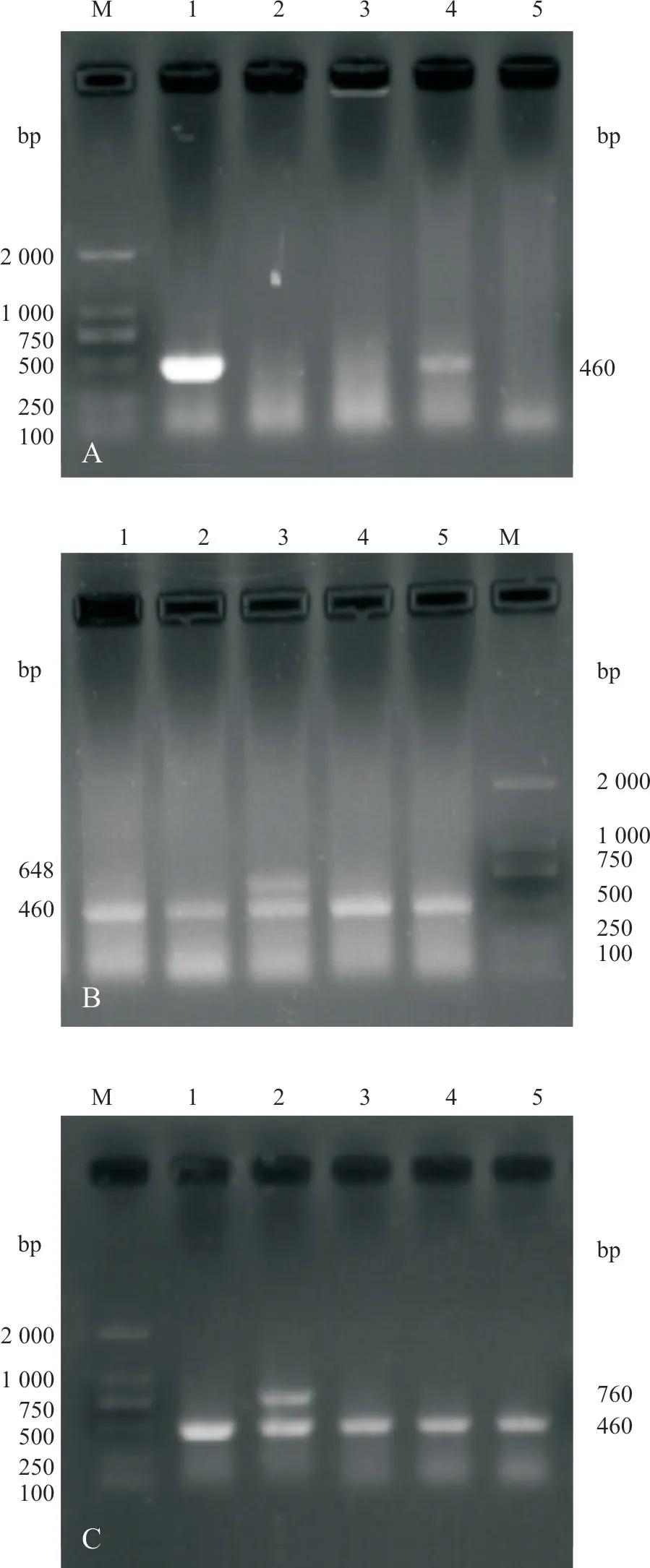
A. KMT1 引物鉴定;B. D 群荚膜血清群鉴定;C. B 群荚膜血清群鉴定;M. DL 2 000 bp DNA Maker;1~5.样品。图2 部分样品多杀性巴氏杆菌PCR 以及荚膜血清群鉴定结果
2.3 测序结果比对和遗传进化分析
试验分离到12 株B 群多杀性巴氏杆菌,序列一致(命名HLBEB);9 株D 群多杀性巴氏杆菌,序列一致(命名HLBED)。应用生物软件MEGA 7.0,对获得的B 群、D 群巴氏杆菌进行序列分析,绘制了遗传进化树(图3)。将获得的两种荚膜血清群基因序列与国内外已发表的参考菌株基因序列进行同源性分析,结果发现B 群与CP023305 同源性最高,D 群与KY825087 同源性最高,均为100%,二者与其他地区提交序列也有较高同源性,在97%~100%之间。

图3 分离菌株KMT1 基因遗传进化分析
2.4 各地区菌株分离鉴定
35 份病料采自呼伦贝尔市5 个旗市区,共分离出21 株多杀性巴氏杆菌,包括B 群12 株、D群9 株。其中:鄂温克族自治旗采集13 份病料,鉴定出8 份阳性,以D 群为主;新巴尔虎左旗采集7 份病料,鉴定出4 份阳性,以B 群为主;新巴尔虎右旗采集6 份病料,鉴定出5 份阳性,以B群为主;海拉尔区采集4 份病料,鉴定出4 份阳性,B 群、D 群均存在;阿荣旗采集5 份病料,未分离出多杀性巴氏杆菌(表2)。

表2 各地区羊源多杀性巴氏杆菌分离与鉴定结果单位:份
2.5 药敏试验
不同地区分离出的菌株对9 种抗生素的耐药结果略有差异:鄂温克族自治旗、新巴尔虎右旗、海拉尔区分离菌株,均对青霉素、链霉素产生了耐药性,而新巴尔虎左旗的分离菌株这两种药中度敏感;新巴尔虎左旗、海拉尔区分离菌株都对卡那霉素产生了耐药,而鄂温克族自治旗、新巴尔虎右旗分离菌株对其中度敏感。不同地区分离菌株对9 种抗菌药的耐药情况见表3。

表3 不同地区分离菌株B 群、D 群的药敏试验结果
总体来看,呼伦贝尔市流行的B 群多杀性巴氏杆菌,对青霉素、链霉素、卡那霉素耐药率较高,分别为66.7%、66.7%、50.0%,对克林霉素、复方新诺明趋于耐药(均为16.7%);D 群多杀性巴氏杆菌,对青霉素、链霉素、克林霉素、复方新诺明耐药率较高,分别为100%、100%、66.7%、66.7%,对卡那霉素趋于耐药(22.2%);二者对氯霉素、四环素、诺氟沙星、环丙沙星均敏感,未产生耐药性(表4)。

表4 21 株多杀性巴氏杆菌分离株耐药统计结果
3 讨论
多杀性巴氏杆菌是引起绵羊及山羊呼吸道疾病的常见病原,绵羊比山羊、幼龄羊比成年对其更易感[11]。据不完全统计,近3 年呼伦贝尔市羊巴氏杆菌病累计发生70 余起,给养殖业造成很大经济损失,因此定期进行预防接种,增强机体对该病的特异性免疫力,是防控巴氏杆菌病最有效、最直接的方法。由于多杀性巴氏杆菌存在多种血清群,且各血清群之间大多无交叉免疫原性,因此建立分子生物学诊断方法,对于调查确定本地区流行的荚膜血清群、研制针对性血清群疫苗、减少经济损失十分必要。本研究建立了分子生物学诊断方法,利用双重PCR,对呼伦贝尔市羊源多杀性沙门氏杆菌进行荚膜血清群分子流行病学调查,结果从35份疑似病料中分离出21 株 B 群、D 群多杀性巴氏杆菌,未分离出其他血清群,说明该市流行的羊源多杀性巴氏杆菌以B 群、D 群为主。经序列比对及遗传进化分析发现,B 群、D 群菌株分别与CP023305、KY825087 同源性最高,达到100%,与其他地区提交序列同源性也较高,在97%~100%之间,说明不同地区间的菌株基因变异并不明显。对21 株分离菌株进行药物敏感性分析,发现分离菌株对青霉素、链霉素、克林霉素、复方新诺明及卡那霉素等常见抗菌药产生了不同程度的耐药,其中对青霉素、链霉素耐药水平最高,B 群、D 群分别达到66.7%、100%。抗菌药耐药性的产生与农牧民长期滥用抗菌药物、饲料中任意添加抗菌药物、出现疫病随意加大药物剂量等不无关系。因此,建议相关部门加大抗菌药物的生产和使用管理力度,同时呼吁养殖场(户)在日常饲养管理用药时,减少对抗菌药物的滥用和依赖,尤其是青、链霉素;驻场兽医及乡村兽医在疾病治疗时,应因地制宜,优化用药方案,科学选择抗菌药物,避免反复使用同种药物,防止耐药菌株的产生与增加。本研究不仅为研制相应的疫苗及科学防治巴氏杆菌病提供了依据,也对多杀性巴氏杆菌病流行病学监测和基因多样性研究奠定了基础,并且找到了针对呼伦贝尔市流行的荚膜血清群敏感药物,为该市羊巴氏杆菌病防控提供了有效的技术支撑。
