兔源F型多杀性巴氏杆菌双重PCR检测方法的建立
2021-07-16王锦祥孙世坤陈岩峰陈冬金谢喜平
王锦祥,孙世坤,陈岩峰,陈冬金,桑 雷,谢喜平
(福建省农业科学院畜牧兽医研究所,福建 福州 350013)
0 引言
【研究意义】兔巴氏杆菌病是由多杀性巴氏杆菌感染兔引起的一种传染病。该病一年四季均可发生,且所有日龄的兔均可发病。临床上,兔巴氏杆菌病以呼吸道症状多见,也可见中耳炎和结膜炎[1−2]。该病是兔的常发病和多发病,是危害兔产业发展的重要疾病。根据多杀性巴氏杆菌的荚膜抗原可将其分为5种血清型,即A、B、D、E和F型[3]。其中,A和D型菌株是兔群中的优势流行菌株[4−5]。【前人研究进展】F型多杀性巴氏杆菌最早在美国的火鸡中发现[6],该菌株主要感染禽类[7],其感染能引起禽霍乱[8]。然而,研究表明国内外兔群中也存在F型多杀性巴氏杆菌,且该菌株对兔具有强致病性[9−11]。由此可见,兔群中F型多杀性巴氏杆菌的出现,使兔巴氏杆菌病的病因更加复杂,也使该病的确诊更加困难。因此,实现对F型多杀性巴氏杆菌的快速检测,掌握其在兔群中的流行情况,对兔产业的发展具有重要意义。【本研究切入点】目前,用于F型多杀性巴氏杆菌的实验室检测方法有细菌分离鉴定和多重PCR[3,10]。多杀性巴氏杆菌营养需求高、生长较缓慢,容易受其他生长较快的细菌污染。多重PCR用于多杀性巴氏杆菌的荚膜分型[3],反应体系中包含6对引物,对反应体系的组成和反应条件都要求很高,否则会出现非特异性扩增或假阴性结果。【拟解决的关键问题】为了建立一种快速且简便的F型多杀性巴氏杆菌检测方法,本研究根据多杀性巴氏杆菌kmt1基因和F型多杀性巴氏杆菌fcbD基因的保守序列分别设计了2对特异性引物,建立了检测F型多杀性巴氏杆菌的双重PCR检测方法,为兔源F型多杀性巴氏杆菌的快速检测提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 主要试剂 2×PCR Mix、pEASY-T1克隆载体、细菌基因组DNA提取试剂盒和胶回收试剂盒购自 北京全式金生物技术有限公司。
1.1.2 菌株 兔源A、D和F型多杀性巴氏杆菌(Pasteurella multocida)、支气管败血波氏杆菌(Bordetella bronchiseptica)、肺炎克雷伯菌(Klebsiellapneumonia)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)由本实验室分离保存。
1.2 方法
1.2.1 引物设计 根据GenBank中公布的多杀性巴氏杆菌kmt1基因(登录号:KX348143)和F型多杀性巴氏杆菌的fcbD基因(登录号:AF302467),利用Primer Premier 5.0软件设计了2对分别针对kmt1基因和fcbD基因保守序列的特异性引物,kmt1基因引物序列为:kmt1-F:5′-gttttatgccacttgaaatgggaa-3′/kmt1-R:5′-taagaaacgtaactcaacatggaaatatt-3′;fcbD基因引物序列为:fcbD-F:5′-ctaaagatcttgttcttgctccattg-3′/fcbD-R:5′-tctgcggtaatattatgagtatccac-3′,扩增的目的片段分别为260 bp和490 bp。引物由上海铂尚生物技术有限公司合成。
1.2.2 单重PCR方法的建立及扩增产物的鉴定 以提取的兔源F型多杀性巴氏杆菌基因组DNA为模板,分别利用kmt1基因和fcbD基因引物进行单重PCR扩增。单重PCR反应体系为:2×PCR Mix 25 μL,基因组DNA 1 μL,上下游引物(10 μmol·L−1)各2 μL,灭菌ddH2O 20 μL,共50 μL反应体系。单重PCR反应程序为95 ℃ 5 min;95 ℃ 30 s、59 ℃ 30 s、72 ℃ 30 s,35个循环;72 ℃ 10 min。PCR产物纯化后克隆至pEASY-T1克隆载体,送上海铂尚生物技术有限公司测序。
1.2.3 双重PCR方法的建立及反应条件的优化 将kmt1基因和fcbD基因引物调整至40 μmol·L−1,等体积混匀后作为双重PCR的引物。双重PCR反应体系为:2×PCR Mix 25 μL,兔源F型多杀性巴氏杆菌基因组DNA 1 μL,混合引物4 μL,灭菌ddH2O 20 μL,共50 μL反应体系。双重PCR反应程序为95 ℃ 10 min;95 ℃ 30 s、59 ℃ 90 s、72 ℃ 2 min,35个循环;72 ℃10 min。在此基础上,设置双重PCR方法的退火温度在54~60 ℃、混合引物终浓度在0.4、0.5、0.6、0.7、0.8、0.9、1.0 μmol·L−1进行优化,确定最佳的退火温度和引物浓度。
1.2.4 双重PCR方法的特异性试验 分别以提取的兔源A、D和F型多杀性巴氏杆菌、支气管败血波氏杆菌、肺炎克雷伯菌、大肠杆菌、金黄色葡萄球菌的基因组DNA为模板,应用建立的双重PCR方法进行检测,设置阴性对照(灭菌ddH2O),评估该双重PCR方法的特异性。
1.2.5 双重PCR方法的敏感性试验 将荚膜F型多杀性巴氏杆菌的基因组DNA 10倍倍比稀释,使双重PCR反应体系中DNA模板的含量为1×107~1×100拷贝·μL−1,设置阴性对照(灭菌ddH2O),评估该方法的敏感性。
1.2.6 双重PCR方法的重复性试验 取90份已知结果的病死兔肺脏样品,平均分为3组,每组30份(A型多杀性巴氏杆菌样品5份,D型多杀性巴氏杆菌5份,F型多杀性巴氏杆菌5份,支气管败血波氏杆菌3份,肺炎克雷伯菌3份,大肠杆菌3份,金黄色葡萄球菌3份,阴性样品3份)。利用细菌基因组DNA提取试剂盒分别提取样品的基因组DNA,平均分为3份,利用建立的双重PCR方法分3次检测(每次检测90份),每次检测时每份样品重复3次,统计批内和批间变异系数,评估该双重PCR方法的重复性。
1.2.7 双重PCR方法的初步应用 选取从龙岩、三明、南平、福州和宁德5个地区收集的87份已知结果的呼吸道病死兔肺脏样品,应用本实验建立的双重PCR方法和已报道的多重PCR方法[3]同时对87份临床样品进行检测。统计检测结果,比较两种PCR方法检测结果与已知结果的一致性以及两种PCR方法检测结果的一致性。
2 结果与分析
2.1 单重PCR方法的建立及扩增产物的鉴定
以兔源F型多杀性巴氏杆菌的基因组DNA为模板,利用设计的kmt1基因和fcbD基因引物分别进行单重PCR扩增。结果显示,扩增产物分别为260 bp和490 bp(图1),与预期目的片段大小相符。将上述2条目的片段克隆至pEASY-T1克隆载体并测序,测序结果显示2条目的片段序列与相应参考基因的序列同源性均为100%。

图1 单重PCR扩增结果Fig. 1 Detection by single PCR amplification
2.2 双重PCR方法的建立及反应条件的优化
以兔源F型多杀性巴氏杆菌的基因组DNA为模板,应用kmt1基因和fcbD基因引物进行双重PCR扩增。结果显示,在同一反应体系中,2对引物均能特异地扩增出相应的目的片段(图2)。在此基础上,进一步对双重PCR的退火温度和引物浓度进行优化。结果显示,当退火温度为54~60 ℃时,该双重PCR的扩增效果均较好(图3);当混合引物浓度为0.8 μmol·L−1时(图4),双重PCR扩增效果最好。退火温度高,则特异性强。因此,确定该双重PCR的最佳反应条件为退火温度60 ℃,混合引物浓度0.8 μmol·L−1。

注:M:DNA Marker; 1:kmt1和fcbD基因; 2:阴性对照 。Note: M: DNA marker; 1: kmt1 and fcbD genes; 2: negative control.
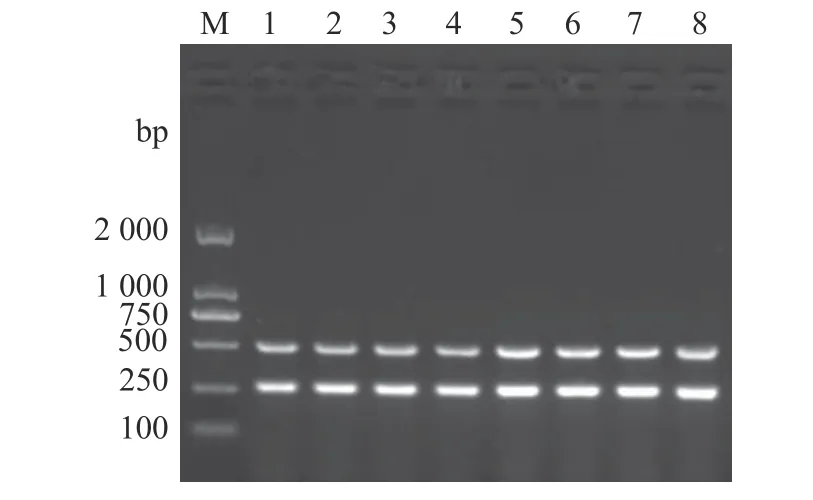
图3 双重PCR方法反应温度的优化Fig. 3 Optimization on reaction temperature for duplex PCR assay
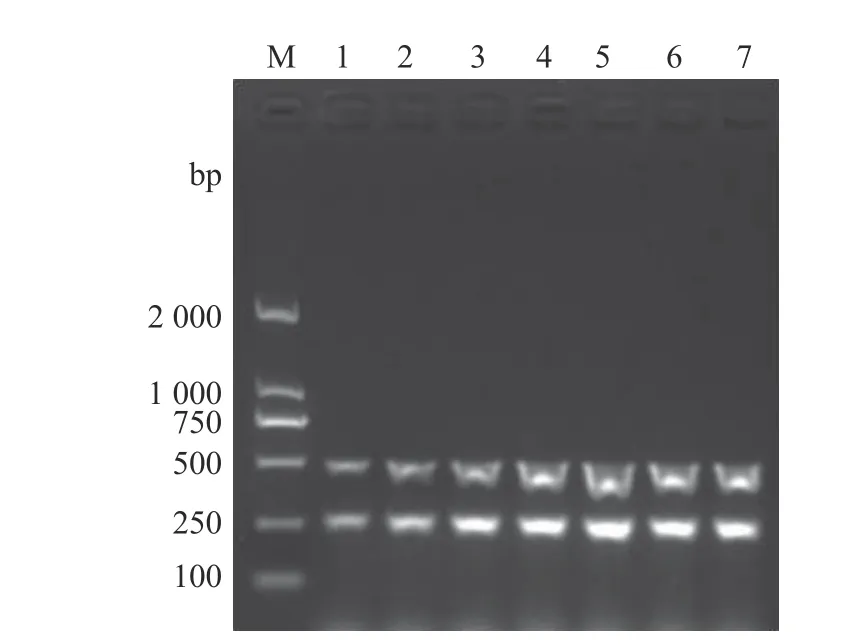
图4 双重PCR检测方法引物浓度优化Fig. 4 Optimization on primer concentration for duplex PCR assay
2.3 双重PCR方法的特异性
利用建立的双重PCR能同时特异地扩增出兔源F型多杀性巴氏杆菌的kmt1基因片段和fcbD基因片段,能扩增出兔源A型和D型多杀性巴氏杆菌的kmt1基因片段,对兔源支气管败血波氏杆菌、肺炎克雷伯菌、大肠杆菌、金黄色葡萄球菌和阴性对照(灭菌ddH2O)则为阴性(图5)。结果表明,该双重PCR方法具有较强的特异性。

图5 双重PCR检测方法特异性试验Fig. 5 Specificity of duplex PCR assay
2.4 双重PCR方法的敏感性
将兔源F型多杀性巴氏杆菌的基因组DNA 10倍倍比稀释(1×107~1×100拷贝·μL−1)。结果显示,该双重PCR的最低检测限为1×103拷贝·μL−1基因组 DNA(图6),表明该双重PCR具有良好的敏感性。

图6 双重PCR检测方法敏感性试验Fig. 6 Sensitivity of duplex PCR assay
2.5 双重PCR方法的重复性
应用建立的双重PCR对90份已知结果的病死兔肺脏样品(3组,每组30份)分3批次进行批内和批间重复性试验。结果显示,重复性试验批内和批间结果均一致,表明该双重PCR具有良好的重复 性。
2.6 双重PCR方法的初步应用
>应用建立的双重PCR方法和已报道的多重PCR方法同时对87份已知结果(A型多杀性巴氏杆菌阳性样品30份,D型多杀性巴氏杆菌阳性样品应用建立的双重PCR方法和已报道的多重PCR方法同时对87份已知结果(A型多杀性巴氏杆菌阳性样品30份,D型多杀性巴氏杆菌阳性样品9份,F型多杀性巴氏杆菌阳性样品8份,支气管败血波氏杆菌阳性样品11份,肺炎克雷伯菌阳性样品2份,大肠杆菌阳性样品1份,金黄色葡萄球菌阳性样品3份,阴性样品23份)的呼吸道病死兔肺脏样品进行检测。结果显示,双重PCR检测出多杀性巴氏杆菌阳性样品49份(其中F型多杀性巴氏杆菌阳性样品8份),阴性样品38份。多重PCR检测出多杀性巴氏杆菌阳性样品43份(其中A型多杀性巴氏杆菌阳性样品30份,D型多杀性阳性样品7份,F型多杀性巴氏杆菌阳性样品6份),阴性样品39份,非特异扩增样品5份。双重PCR方法检测结果和已报道的多重PCR方法检测结果与已知结果的符合率分别为97.70%和94.25%。双重PCR方法检测结果与已报道的多重PCR方法检测结果的符合率为93.10%。上述结果表明,本试验建立的双重PCR方法准确性高,具有较好的临床应用价值。
3 讨论与结论
多杀性巴氏杆菌感染是引起兔呼吸道疾病的重要病原之一,常常引起致死性感染。临床上,致死性病例以50~70日龄的商品兔、怀孕后期母兔和哺乳母兔多见,给养兔业造成严重的经济损失[12]。兔巴氏杆菌病主要由A和D型多杀性巴氏杆菌感染引起[4−5]。F型多杀性巴氏杆菌首次分离自火鸡[6],主要在禽类中流行病且致病性强[7−8]。然而,在国内外兔群中也发现有该菌的存在,且其感染能引起兔的严重致死性呼吸道疾病[9−11]。由此可见,F型多杀性巴氏杆菌在兔群中的出现使兔巴氏杆菌病病因更加复杂,导致该病的确诊更加困难。
本试验根据多杀性巴氏杆菌的kmt1基因和F型多杀性巴氏杆菌fcbD基因的保守序列分别设计了2对特异性引物,建立了检测F型多杀性巴氏杆菌的双重PCR方法。kmt1基因是多杀性巴氏杆菌的种特异性基因,以该基因为目的基因能建立检测多杀性巴氏杆菌的特异性PCR检测方法[13−14]。fcbD基因编码F型多杀性巴氏杆菌荚膜中的软骨素,是F型菌株中的特异性基因,以该基因为目的基因能建立鉴定F型多杀性巴氏杆菌荚膜血清型的多重PCR方法[3]。由此可见,以kmt1基因和fcbD基因为目的基因能建立特异的检测兔源F型多杀性巴氏杆菌的双重PCR检测方法。本试验建立的双重PCR方法快速简便,不仅克服了细菌分离鉴定的费时,还克服了多杀性巴氏杆菌荚膜分型多重PCR方法的费力。此外,该双重PCR方法特异性强、重复性好、准确性高,具有很好的临床应用价值,为掌握兔群中F型多杀性巴氏杆菌的流行情况提供了有力的技术手段。
