唐古特莨菪中生物碱的分离鉴定与杀虫活性研究
2019-09-04王玉灵郭致杰胡冠芳李国锋牛树君赵峰
王玉灵 郭致杰 胡冠芳 李国锋 牛树君 赵峰


摘要 本文采用MCI柱层析、硅胶柱层析等天然产物分离方法,从唐古特莨菪地上部甲醇粗提物中分离得到了2个莨菪烷类生物碱单体。通过化合物特征反应,质谱、碳谱和氢谱数据,并结合相关文献报道鉴定了其结构,分别为樟柳碱和山莨菪碱。采用微量点滴法和玻片浸渍法测定了2种生物碱对甘蓝蚜等6种常见蚜虫和朱砂叶螨等4种常见叶螨处理24 h的触杀活性,结果表明,樟柳碱对豆蚜、棉蚜、麦长管蚜和山莨菪碱对棉蚜具有较强的触杀活性,处理24 h的LC50依次为0.495、0.429、0.881和0.404 mg/mL,其活性均高于对照药剂鱼藤酮或与其相当,相对毒力分别为鱼藤酮的1.246、1.017、1.168和1.078倍;樟柳碱对朱砂叶螨、二斑叶螨和山莨菪碱对朱砂叶螨、二斑叶螨具有较强的触杀活性,处理24 h的LC50依次为0.484、0.446和0.331、0.430 mg/mL,其活性均高于鱼藤酮,相对毒力分别为鱼藤酮的1.136、1.154和1.662、1.198倍。
关键词 唐古特莨菪; 莨菪烷类生物碱; 分离鉴定; 杀虫活性
中图分类号: S 482.3
文献标识码: A
DOI: 10.16688/j.zwbh.2018330
生物碱是自然界中广泛存在的一大类碱性含氮化合物,具有广泛的生理活性[1],往往是许多中草药及药用植物的有效成分[2]。生物碱的发现起始于19世纪初,是人们研究最早且最多的一类天然有机化合物,迄今为止,从植物中分离出的生物碱大约有5 000多种[3],《全国医药产品大全》收载的生物碱药物及其制剂有62种,临床应用的生物碱也有80余种[4]。由于诸多生物碱具有抗肿瘤、抗菌、低毒性和成本低的特性,因而受到人们极大的关注[56]。在植物源农药的研制中,生物碱作为极具开发潜质的一个大类而被广泛重视和应用[7]。截至目前,一些生物碱因具有杀虫抑菌等活性而被开发为农药产品,如烟碱(nicotine)、苦参碱(matrine)、喜树碱(camptothecin)、小檗碱(berberine)、百部碱(stemonine)及藜芦碱(veratrine)[8]等。
唐古特莨菪Anisodus tanguticus (Maxim.) Pascher是我国特有的一种茄科Solanaceae山莨菪属Anisodus多年生草本高山植物,主要分布于青海、西藏以及四川和甘肃的部分地区,在藏药和中草药领域研究应用较广[912]。近年来,随着对唐古特莨菪有效成分研究的不断深入,认识到莨菪烷类生物碱化合物是唐古特莨菪中主要的生物活性成分。莨菪烷类生物碱在临床上具有抗胆碱、麻醉、活血化瘀等多种功效[5,6,13],但其作为农药活性分子的研究报道甚少。张兴等[14]、张国洲等[15]、胡冠芳等[16]研究了唐古特莨菪对赤拟谷盗Tribolium castaneum、菜青虫Pieris rapae、黏虫Mythimna separata、
麦长管蚜Sitobion miscanthi等害虫的生物活性,但只停留在粗提物阶段,尚未涉及活性化合物单体研究。鉴于此,作者前期结合活性示踪,从唐古特莨菪地上部分甲醇粗提物中分离获得了2个莨菪烷类生物碱化合物单体,分别为莨菪碱hyoscyamine和东莨菪碱scopolamine,并测定了其杀蚜、杀螨活性,结果显示,莨菪碱对豆蚜Aphis craccivora、禾谷缢管蚜Rhopalosiphum padi、桃蚜Myzus persicae和棉蚜A.gossypii具有较强的触杀活性,东莨菪碱对豆蚜和禾谷缢管蚜具有较强的触杀作用;莨菪碱和东莨菪碱对截形叶螨Tetranychus truncatus、山楂叶螨Amphitetranychus viennensis、二斑叶螨T.urticae和朱砂叶螨T. cinnabarinus具有较强的触杀作用,2种生物碱对4种叶螨的毒力相当,均表现出对二斑叶螨和朱砂叶螨的毒力高于截形叶螨和山楂叶螨[1718]。
基于莨菪碱和东莨菪碱对蚜虫和叶螨具有较强的触杀活性,本课题组对唐古特莨菪中的生物碱进行了再次分离鉴定,以期得到更多的生物碱单体,为进一步完善莨菪烷类生物碱活性数据,指导莨菪烷类生物碱结构优化与衍生物合成,发现活性更强的新化合物,创制新型高效、低毒、低残留植物源农药提供技术支撑。
1 材料與方法
1.1 活性成分分离鉴定
1.1.1 供试材料、试剂与仪器
供试材料:唐古特莨菪于2016年7月中旬采自甘南藏族自治州临潭县海拔为3 420 m的天然草地。取其地上部茎、叶及青果(未成熟果实),洗净切碎,自然阴干,粉碎过40目筛,室温下保存备用。
试剂与仪器:鱼藤酮(rotenone)、樟柳碱(anisodine)、山莨菪碱(anisodamine)标准品购于百灵威科技有限公司。柱层析硅胶(48~75 μm)、薄层层析硅胶(GF254)、小孔树脂凝胶MCI CHP 20P(75~150 μm)均由青岛海洋化工厂生产。乙酸乙酯、正丁醇等试剂均为分析纯。BrukerAPEXⅡ质谱仪和BrukerDRX400核磁共振波谱仪,由德国Bruker公司生产;ZF7c三用紫外分析仪,由上海康华生化仪器制造有限公司生产。
1.1.2 活性成分提取与分离方法
称取2.2 kg唐古特莨菪植物粉末,用甲醇浸提3次(时间依次为72、48、24 h),合并滤液,减压浓缩至膏状,悬浮于蒸馏水中,用4 mol/L HCl调悬浮液pH=1~2,静置过夜,抽滤,再用4 mol/L NaOH调悬浮液pH=9~10,静置过夜,用氯仿等体积萃取,减压浓缩,回收氯仿,得到唐古特莨菪总生物碱150 g。
将150 g总生物碱用MCI柱(填料约3.5 L树脂)层析,用甲醇∶乙腈∶水(16∶4∶80、26∶4∶70、36∶4∶60、46∶4∶50)依次洗脱,薄层检测并收集相同流段,共得到A、B、C、D 4个组分,参照标准品,发现生物碱成分存在于B、C组分内。
将B组分浸膏25.3 g硅胶柱层析,用氯仿甲醇(含1‰三乙胺)梯度(40∶1、30∶1、20∶1、10∶1)洗脱,后用甲醇冲柱。以每1 000 mL的流出液作为分段,每个分段蒸除溶剂后用薄层层析硅胶板检测,合并TLC显示结果一样或者相近的流段,共得到5个组分:B-Fr1(40∶1)、B-Fr2(30∶1)、B-Fr3(30∶1~20∶1)、B-Fr4(20∶1~10∶1)、B-Fr5(氯仿、甲醇冲柱)。将組分B-Fr3(氯仿∶甲醇=30∶1~20∶1,约6.7 g)用丙酮石油醚(1∶1)溶解,用硅胶湿法拌样柱层析,用石油醚丙酮(含2%氨水)梯度(8∶1、4∶1、2∶1、1∶1)洗脱,得到4个组分:B-Fr3-1、B-Fr3-2、B-Fr3-3、B-Fr3-4,将B-Fr3-2(2.1 g)用硅胶湿法拌样,以石油醚∶丙酮(2∶1,1∶1,0.5∶1)梯度洗脱,得化合物2。
将C组分浸膏19.5 g用硅胶湿法上柱,氯仿甲醇(含1‰三乙胺)梯度(30∶1,20∶1,10∶1)洗脱,后用甲醇冲柱。以每1 000 mL流出液作为分段,每个分段蒸除溶剂后用薄层检测,将TLC显示结果一样或者相近的流段合并,共得到4个组分:C-Fr1(30∶1)、C-Fr2(20∶1)、C-Fr3(20∶110∶1)、C-Fr4(10∶1)。将组分C-Fr3(氯仿∶甲醇=5∶1,约6.1 g)用氯仿甲醇(10∶1)溶解,用硅胶湿法拌样柱层析,用氯仿甲醇(含2%氨水)梯度(20∶1,10∶1,5∶1,2.5∶1)洗脱,依据TLC检测得到4个组分:C-Fr3-1、C-Fr3-2、C-Fr3-3、C-Fr3-4,将C-Fr3-2(3.2 g)用硅胶湿法拌样,以反向硅胶柱进行层析纯化,在甲醇水条件下进行梯度(10∶1,5∶1,2.5∶1)洗脱,得化合物4。
1.2 杀蚜杀螨活性测定
1.2.1 供试蚜虫与叶螨
甘蓝蚜Brevicoryne brassicae、麦长管蚜S.miscanthi、豆蚜A.craccivora、禾谷缢管蚜R.padi、桃蚜M.persicae和棉蚜A.gossypii分别采自甘肃省农业科学院不施药的甘蓝Brassica oleracea田、小麦Triticum aestivum田、蚕豆Vicia faba田、玉米Zea mays田、油菜Brassica napus田和棉花Gossypium hirsutum田。朱砂叶螨T.cinnabarinus、二斑叶螨T.urticae、截形叶螨T.truncatus及山楂叶螨Amphitetranychus viennensis分别采自甘肃省农业科学院不施药的大豆Glycine max、菜豆Phaseolus vulgaris、桃树Prunus persica或苹果树Malus pumila叶片上。
1.2.2 供试药剂浓度设置
樟柳碱、山莨菪碱和对照药剂鱼藤酮均用丙酮水(9∶1)溶解,并加入1%表面活性剂JFC(C7~C9烷醇聚氧乙烯醚)。依据预试验结果,将樟柳碱、山莨菪碱测定浓度在166.7~4 000.0 mg/L之间设置5个不同梯度浓度。溶剂对照及药剂对照均按处理的同等梯度浓度设置。
1.2.3 杀蚜杀螨活性测定方法
对蚜虫的触杀作用测定参照已报道的权威经典测试方法—点滴法[19]。挑选大小一致的无翅成蚜,用0.046 μL的微量点滴器将药液点滴在蚜虫的前胸背板上,置于已放入新鲜寄主植物叶片并铺有滤纸保湿的直径为12 cm的培养皿中,每皿放30头蚜虫,每个浓度重复3次。以等量的丙酮水+JFC用蒸馏水稀释成同样浓度作为溶剂对照,以相同方法配制不同浓度梯度的鱼藤酮作为药剂对照。在温度(25±1)℃、湿度60%~80%、L∥D=14 h∥10 h条件下饲养,24 h后检查死亡数,计算死亡率、校正死亡率及相对毒力。用SPSS 17.0软件对数据进行回归及方差分析,得毒力回归方程(Y=A+BX),致死中浓度LC50及95%置信限。
死亡率=(死亡虫数/处理虫数)×100%;
校正死亡率=[(处理死亡率-对照死亡率)/(100-对照死亡率)]×100%;
相对毒力=对照药剂的LC50/供试药剂的LC50。
对叶螨的触杀作用测定采用FAO推荐的玻片浸渍法[20]。用毛笔挑选大小一致、体色鲜艳、行动活泼的雌成螨,将其背部粘在载玻片一端的双面胶带上(保证螨足、螨须和口器可自由活动),每片粘30头。在温度(25±1)℃、湿度60%~80%、L∥D=14 h∥10 h条件下饲养,及时加水保湿,4 h后用双目镜观察,剔除死亡或不活泼个体。将带螨玻片的一端浸入药液中,轻轻摇动5 s后取出,用吸水纸迅速吸干螨体及其周围多余的药液,每个浓度重复3次。处理后将试螨置于上述条件的生化培养箱中培养。24 h后用双目镜调查死亡数,计算死亡率、校正死亡率及相对毒力。计算公式及分析方法同上。
2 结果与分析
2.1 活性成分化学结构表征
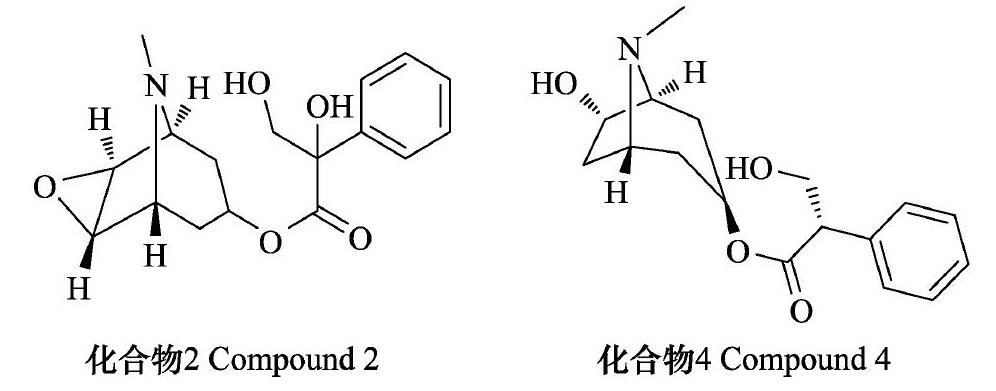
化合物2,无色针状晶体,经改良碘化铋钾溶液后显色,表明该化合物可能为生物碱类。1H NMR(400 MHz,CDCl3)δ:7.31~7.40(5H,m,Ar-H),5.04(1H,t,H-3),4.19(1H,m,H-11α),3.79(1H,m,H-11β),3.38(1H,d,J=4.8 Hz,H-5),3.13(1H,m,H-1),3.11(1H,m,H-7),2.46(3H,s,NCH3),2.17(2H,m,H-4α),2.00~2.07(1H,m,H-6),2.05(1H,m,H-2α),1.60(1H,d,J=15.2 Hz,H-4β),1.36(1H,d,J=15.6 Hz,H-2β);13C NMR(100 MHz,CDCl3)δ:174.2(C-9),136.7(C-12),128.4(2C,C-14,C-16),128.1(2C,C-13,C-17),126.59(C-15),82.1(C-10),69.5(C-11),68.0(C-3),59.7(2C,C-1,C-5),55.2(C-6),54.6(C-7),33.3(C-8),29.7(C-4),25.9(C-2).Anal.calcd.for C17H21NO4:C,63.94,H,6.63;N,4.39.Found:C,64.00;H,6.60;N,4.42.ESI-MS m/z:320.35[M+H]+。依据文献及谱图分析结果,确定化合物2为樟柳碱[21]。
化合物4,无色针状晶体,经改良碘化铋钾溶液后显色,表明该化合物可能为生物碱类。1H NMR(400 MHz,CDCl3)δ:7.32~7.43(5H,m,Ar-H),4.99(1H,m,H-3),4.26(1H,m,H-6),4.18(1H,m,H-10),3.85(2H,m,H11α),3.37(1H,m,H-1),3.11(1H,d,J=2.4 Hz,H-5),2.46(3H,s,NCH3),2.29(1H,m,H-4α),2.07(1H,m,H-2α),1.70(1H,d,J=16.0 Hz,H-4β),1.53(1H,m,H-2β).13C NMR(100 MHz,CDCl3)δ:175.3(C-9),137.6(C-12),131.6(2C,C-14,C-16),130.6(2C,C-13,C-17),129.5(C-15),72.6(C-6),71.6(C-5),67.5(C-3),64.4(2C,C-1,C-11),56.0(C-10),42.7(C-8),36.8(C-7),36.5(C-2),35.2(C-4);Anal.calcd.for C17H23NO4:C,66.86;H,7.59;N,4.59.Found:C,67.00;H,7.55;N,4.62.ESI-MS m/z:306.24[M+H]+。依据文献及谱图分析结果,确定化合物4为山莨菪碱[22]。
2.2 杀蚜杀螨活性测定结果
毒力测定结果(表1)表明,樟柳碱对豆蚜、棉蚜、麦长管蚜具有较强的触杀活性,其LC50依次为0.495、0.429、0.881 mg/mL,其活性稍高于鱼藤酮或与其相当(0.617、0.436、1.030 mg/mL),相对毒力分别为鱼藤酮的1.246、1.017、1.168倍。樟柳碱对甘蓝蚜、禾谷缢管蚜和桃蚜的触杀活性不及鱼藤酮。山莨菪碱对棉蚜的触杀活性(0.404 mg/mL)与鱼藤酮相当,相对毒力为鱼藤酮的1.078倍,对甘蓝蚜、禾谷缢管蚜、桃蚜、豆蚜和麦长管蚜的触杀活性低于鱼藤酮。
毒力测定结果表明(表2),樟柳碱对朱砂叶螨、二斑叶螨具有较强的触杀活性,LC50为0.484、0.446 mg/mL,其活性稍高于鱼藤酮,相对毒力为鱼藤酮的1.136、1.154倍。山莨菪碱对朱砂叶螨、二斑叶螨的触杀活性(0.331、0.430 mg/mL)高于鱼藤酮,相对毒力分别为鱼藤酮的1.662、1.198倍。2种生物碱对截形叶螨和山楂叶螨的毒力均低于鱼藤酮。
3 结论与讨论
本研究借鑒项目组前期从唐古特莨菪中分离获得2种生物碱化合物(莨菪碱和东莨菪碱)并发现其具较强杀蚜杀螨活性的思路及方法,继续分离并表征了2种生物碱结构,分别为山莨菪碱和樟柳碱。以同样来源于植物(豆科Leguminosae鱼藤属Derris等植物)的鱼藤酮为药剂对照,通过测定2种生物碱对甘蓝蚜等6种蚜虫和朱砂叶螨等4种叶螨的触杀活性,发现樟柳碱对豆蚜、棉蚜、麦长管蚜以及朱砂叶螨和二斑叶螨具有较强的触杀活性,LC50在0.429~0.881 mg/L之间;山莨菪碱对棉蚜以及朱砂叶螨和二斑叶螨也具有较强的触杀活性,LC50在0.331~0.430 mg/L之间,2种生物碱对供试蚜虫和叶螨的活性均稍高于对照药剂鱼藤酮或与其相当。
莨菪烷类生物碱是含莨菪烷骨架且生理活性很强的一类天然产物化合物,人工合成之衍生物数量也较多,但有关其活性的研究偏重于医药、植物化学等领域[13,23]。关于莨菪烷类生物碱的农药活性,作者报道过莨菪碱、东莨菪碱的杀蚜杀螨活性[17],结合本文对山莨菪碱和樟柳碱的杀蚜杀螨活性研究结果,总体认为这4种生物碱具有较强的杀蚜杀螨活性,且对有些蚜虫和叶螨的活性高于鱼藤酮,为利用莨菪烷类生物碱创制新农药提供了线索和新思路。但其在农药上的应用可能会因原料来源而受到限制,其化学合成在经济上可行性不强,因此这些化合物在农药上能否商业化很大程度上还取决于它们在茄科植物中的含量及分离程度。今后的研究方向是:1)开展三维定量构效关系研究指导化合物的结构优化和衍生合成,通过农药生物活性测定筛选出高活性化合物,结合高活性化合物的作用机理研究,为创制新农药提供技术支撑和理论依据;2)用生物反应器替代植物自身生产系统,即扩增、克隆莨菪烷生物碱生产过程中的关键性基因序列,导入替代生物反应器,甚至通过基因过表达来指导生物碱的高效生产。
参考文献
[1] LONG Zhen, WANG Chaoran, GUO Zhimou, et al. A non-aqueous solid phase extraction method for alkaloid enrichment and its application in the determination of hyoscyamine and scopolamine [J]. Analyst, 2012, 137: 14511457.
[2] CHEN Huaixia, CHEN Yong, DU Peng, et al. Structural elucidation of in vivo and in vitro metabolites of anisodine by liquid chromatography-tandem mass spectrometry [J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 44(3): 773778.
[3] 张鑫, 叶非. 植物源农药中生物碱提取和纯化技术进展[J].农药科学与管理,2007, 25(2): 2831.
[4] 周文华, 杨辉英, 岳庆磊. 生物碱提取和分离方法的研究新进展[J]. 当代化工, 2003, 32(2): 111113.
[5] CHEN Yong, DU Peng, HAN Fengmei, et al. Characterization of in vivo and in vitro metabolic pathway of anisodamine by liquid chromatography-tandem mass spectrometry [J]. Journal of Liquid Chromatography & Related Technologies, 2007, 30(13): 19331949.
[6] CHEN Huaixia, WANG Hong, CHEN Yong, et al. Liquid chromatography-tandem mass spectrometry analysis of anisodamine and its phase I and II metabolites in rat urine [J]. Journal of Chromatography B, 2005,824(1/2): 2129.
[7] LIZUKA N, MIYAMOTO K, OKITA K, et al. Inhibitory effect of Coptidis Rhizoma and berberine on the proliferation of human esophageal cancer cell lines [J]. Cancer Letter, 2000, 148(1): 1925.
[8] 呂梅香,曾和平,王晓娟,等.农药用生物碱的研究进展[J].农药,2004,43(6):249253.
[9] 中国科学院“中国植物志”编辑委员会.中国植物志(第六十七卷第一分册)[M].北京:科学出版社,1978:26.
[10]李积顺,吴义祥.草药唐古特莨菪治疗幼犬皮肤病有奇效[J].青海畜牧兽医杂志,2006(3):41.
[11]王质彬,林华,吴先琪.青藏高原特有药用植物—唐古特莨菪[J].植物学杂志,1975(3):2930.
[12]叶培磷.唐古特莨菪治疗家畜膈痉挛[J].青海畜牧兽医杂志,1996(3):20.
[13]LAN Xiaozhong, ZENG Junlan, LIU Ke, et al. Comparison of two hyoscyamine 6 β-hydroxylases in engineering scopolamine biosynthesis in root cultures of Scopolia lurida [J]. Biochemical and Biophysical Research Communications, 2018, 497(1): 2531.
[14]张兴,杨崇珍,王兴林.西北地区杀虫植物的筛选[J].西北农业大学学报,1999,27(2):2127.
[15]张国洲,徐汉虹,赵善欢,等.青藏高原18种植物的杀虫活性筛选[J].青海大学学报(自然科学版),2000,18(1):36.
[16]胡冠芳,刘敏艳,余海涛,等.甘青赛莨菪粗提物的杀虫活性研究[J].草原与草坪,2013,33(1):1115.
[17]王玉灵,胡冠芳,刘敏艳,等.唐古特莨菪中生物碱的分离、鉴定与生物活性研究[J].草业学报,2015,24(12):188195.
[18]王玉灵.唐古特莨菪提取物与分离所得生物碱的杀虫杀螨活性研究[D].兰州:甘肃农业大学,2015.
[19]薛广厚,范海延,李航,等.生物碱在植物源农药中的应用研究[J].北方园艺,2009(6):131134.
[20]陈年春.农药生物测定技术[M].北京:中国农业大学出版社,1991:6871.
[21]王国兴,李丽云,沈联芳,等.山莨菪碱和樟柳碱的NMR研究[J].波谱学杂志,1987,4(3):249252.
[22]中国科学院西北高原生物研究所.藏药志[M].西宁:青海人民出版社,1991:140.
[23]杨俊山.莨菪烷生物碱的研究概况[J].药学学报,1982,17(11):868880.
(责任编辑:杨明丽)
