国外草地贪夜蛾化学防治技术的研究与应用
2019-09-04崔丽芮昌辉李永平王芹芹杨代斌闫晓静郭永旺袁会珠
崔丽 芮昌辉 李永平 王芹芹 杨代斌 闫晓静 郭永旺 袁会珠
摘要 草地贪夜蛾Spodoptera frugiperda(J. E. Smith)是一种适应性和迁徙能力很强的农业害虫,并具有暴发为害的特点。几十年来,化学防治一直是防治草地贪夜蛾的重要技术措施。20世纪80年代以前,美洲国家防治草地贪夜蛾以有机磷类和氨基甲酸酯类杀虫剂为主;随后拟除虫菊酯类杀虫剂得到了广泛使用;20世纪90年代中后期,美洲特别是美国推广种植转基因Bt玉米后,防治草地贪夜蛾杀虫剂的用量显著减少;近年来,甲氨基阿维菌素苯甲酸盐、乙基多杀菌素、除虫脲、虱螨脲、茚虫威、氯虫苯甲酰胺、氟苯虫酰胺、溴氰虫酰胺等一系列新型杀虫剂品种在防治草地贪夜蛾中发挥了突出的作用。伴随着不同种类杀虫剂的使用,草地贪夜蛾对杀虫剂抗性也相应地呈现出明显的变化,20世纪80年代后,美洲的草地贪夜蛾先后對有机磷类和氨基甲酸酯类杀虫剂产生了抗药性,截至2017年,美洲地区的草地贪夜蛾至少对包括氨基甲酸酯类、有机磷类、拟除虫菊酯类及Bt杀虫蛋白等不同类型共29种杀虫剂产生了抗药性;2016年,采自北美洲波多黎各的草地贪夜蛾田间种群对双酰胺类杀虫剂氟苯虫酰胺和氯虫苯甲酰胺抗性倍数最高分别达500倍和160倍。草地贪夜蛾的抗药性机制主要是解毒代谢增强和靶标基因突变。种子处理可以预防作物苗期草地贪夜蛾的为害,并且有利于天敌保护。雾滴粒径不仅影响杀虫剂对草地贪夜蛾的防治效果,还影响草地贪夜蛾对杀虫剂抗药性的发展,因此,防治田间草地贪夜蛾适宜采用细雾喷雾方式。使用得当,化学杀虫剂可以与天敌和生物杀虫剂协同增效防治草地贪夜蛾。航空施药要和地面施药联合使用才能对玉米田严重发生的草地贪夜蛾达到好的防治效果。
关键词 草地贪夜蛾; 化学防治; 抗药性机制; 种子处理; 雾滴粒径
中图分类号: S 48
文献标识码: A
DOI: 10.16688/j.zwbh.2019300
Abstract The fall armyworm, Spodoptera frugiperda (J. E. Smith) displays an outstanding adaptable and migratory capacity,and is an agricultural pest characterized by outbreaks. Over the past decades, chemical control has been an important method to control this pest. Before the 1980s, organophosphates and carbamates were main insecticides to control the fall armyworm in the American continent. Then pyrethroid insecticides were widely used in field. In the mid to late 1990s, after the commercialization of genetically engineered (GE) crops producing Bacillus thuringiensis (Bt) insecticidal proteins in the American continent, particularly in the United States, the amount of synthetic insecticide applied significantly decreased. Recently active ingredients with novel modes of action are available for the control of the fall armyworm, including emamectin benzoate, spinetoram, diflubenzuron, lufenuron, indoxacarb, chlorantraniliprole, flubendiamide and cyantraniliprole, and have played an outstanding role in the management of the pest. Along with the use of different types of insecticides, the insecticide-resistance of the fall armyworm also presents a significant time-associated succession rule. Many cases on organophosphate and carbamate resistance were reported in the American continent since the 1980s. Up to 2017, the fall armyworm has become resistant to 29 active ingredients belong to carbamate, organophosphorus, pyrethroids and Bt insecticidal protein in the Americas. It was reported that the field population of fall armyworm collected from Puerto Rico in 2016 showed the resistance ratio of 500- and 160-fold to diamides insecticides, flubendiamide and chlorantraniliprole. The insecticide-resistance of the fall armyworm was mainly caused by enhanced detoxification and target mutation. Seed treatment can prevent seedling damage caused by the pest and protect natural enemies. Spraying using a large droplet size nozzle significantly decreased the control efficacy of insecticides and may promote the tolerance to insecticides than that using a small droplet size nozzle. Therefore, small-drop spray mode is recommended for the control of this pest in field. Combination of chemical insecticides and natural enemies or biological insecticides may exhibit synergisms against the fall armyworm when properly used. Combination of aerial application and ground application will play vital role for the control of outbreaks of the fall armyworm in maize field.
Key words Spodoptera frugiperda; chemical control; insecticide-resistance mechanism; seed treatment; spray droplet
草地贪夜蛾自2019年1月入侵我国云南后,截至6月中旬,已经蔓延到全国18个省市,并呈继续北上之势,防控形势严峻。目前,我国草地贪夜蛾化学防治技术的研究数据十分有限,我们综述分析了国外对草地贪夜蛾化学防治技术方面的研究与应用情况,希望为我国目前针对草地贪夜蛾的应急防控提供参考。
1 草地贪夜蛾的发生与化学防治药剂
草地贪夜蛾Spodoptera frugiperda(J.E.Smith)属鳞翅目Lepidoptera夜蛾科Noctuidae,又名秋黏虫,是美洲地区特有的一种害虫[13]。草地贪夜蛾可以取食353种植物,包括玉米、水稻、高粱、小米、甘蔗、蔬菜和棉花等作物[4]。草地贪夜蛾在美洲是最具破坏性的玉米害虫之一,如果防治措施不力,可以造成重大损失。自2016年草地贪夜蛾在非洲暴发为害,现已成为非洲中西部主要玉米害虫。该害虫2019年1月自东南亚侵入我国云南、广西,现已在18个省(市、自治区)发生为害,严重威胁我国玉米等粮食生产。
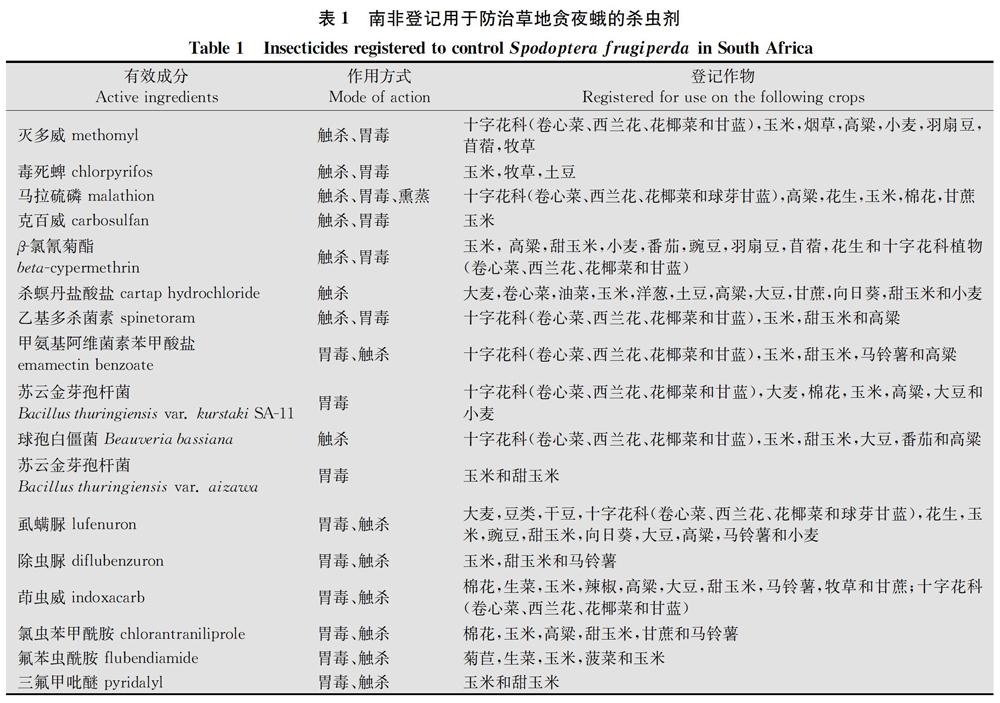
草地贪夜蛾是一种适应性和迁徙能力很强的农业害虫,并具有暴发为害的特点[57]。草地贪夜蛾的防治主要依赖化学农药。在防治用药品种的选择上,随着杀虫剂防治效果及害虫抗药性的变化,以及新品种和新作用机制杀虫剂的开发应用,用药品种也相应发生变化。在20世纪80年代以前美洲国家防治草地贪夜蛾以有机磷类、氨基甲酸酯类杀虫剂为主[8],主要品种包括敌百虫、二嗪磷、甲基对硫磷、辛硫磷、毒死蜱、硫丙磷、甲萘威、硫双灭多威等。随后拟除虫菊酯类杀虫剂得到了广泛使用,如氯菊酯、氯氰菊酯、溴氰菊酯、高效氯氟氰菊酯等。至20世纪90年代中后期,在美洲特别是美国推广种植表达苏云金杆菌Bacillus thuringiensis(Bt)杀虫蛋白的转基因玉米等作物后,杀虫剂用量下降47.8%[9],显著减少了防治草地贪夜蛾杀虫剂的用量。近年来,随着草地贪夜蛾的扩散和多种新型杀虫剂的开发应用,在该害虫发生为害比较严重的地区,一系列杀虫剂新品种在草地贪夜蛾的防治上发挥了突出的作用[10],如:甲氨基阿维菌素苯甲酸盐、乙基多杀菌素、除虫脲、虱螨脲、茚虫威、氯虫苯甲酰胺、氟苯虫酰胺、溴氰虫酰胺等。目前,南非登记用于防治草地贪夜蛾的杀虫剂品种见表1。纵览世界上草地贪夜蛾的防治历史,若不重视其暴发为害的特点,防治措施不及时或不得力,则极有可能造成重大损失;而重视其发生为害,并根据该害虫暴发为害的特点科学选择杀虫剂品种,及时进行药剂防治,将大幅度降低其发生为害。
2 草地贪夜蛾对杀虫剂抗药性发展历程
害虫对杀虫剂的抗性是一种生物进化现象,是杀虫剂使用后存在的普遍问题。主要依赖化学农药控制其发生为害的草地贪夜蛾也随杀虫剂的使用不断检测到对杀虫剂的抗药性问题。20世纪80年代中期,美国东南部地区普遍检测到草地贪夜蛾对甲萘威、甲基对硫磷、敌百虫的抗药性,在佛罗里达州草地贪夜蛾田间种群对灭多威的敏感性出现了明显下降。而在中、南美洲,草地贪夜蛾田间种群对甲萘威、辛硫磷、甲基对硫磷、敌百虫、灭多威出现了低到中等程度的抗药性[7]。
截至2017年,美洲地区的草地贪夜蛾至少对29种杀虫剂产生了抗性,主要包括氨基甲酸酯类、有机磷类、拟除虫菊酯类及苏云金芽孢杆菌Cry1F杀虫蛋白等[11]。随着转Bt抗虫基因作物的广泛推广应用,草地贪夜蛾对Bt蛋白产生抗性的报道越来越多,如Cry1Fa、Cry1Ac和Cry1Ab在波多黎各[1213],Cry1A.105和Cry1F在美国大陆[1416],Cry1F和Cry1Ab在巴西[1719],Cry1F在阿根廷[20]均已经出现了草地贪夜蛾的抗性问题。
Gutiérrez-Moreno等报道,墨西哥和波多黎各地区草地贪夜蛾田间种群对毒死蜱、灭多威、硫双威、氯菊酯、zeta-氯氰菊酯(zeta-cypermethrin)、溴氰菊酯、乙基多杀菌素、多杀霉素、甲氨基阿维菌素苯甲酸盐、阿维菌素和杀铃脲的抗性倍数最高分别达47、223、124、48、35、25、14、8、7、7和20倍。而对氟苯虫酰胺和氯虫苯甲酰胺的抗性倍数最高分别达500倍和160倍[21]。
草地贪夜蛾是典型的迁飞性害虫,在我国已呈现快速暴发和向玉米主产区快速扩散为害的态势。因此,特别需要重视其抗药性发展动态变化,并尽早开展草地贪夜蛾抗药性治理策略的研究,以便长期有效地控制其发生为害。
3 草地贪夜蛾对杀虫剂抗性机制
草地贪夜蛾对杀虫剂的抗性机制主要包括两个方面:即解毒代谢机制和靶标抗性机制。解毒代谢酶活性的升高是草地贪夜蛾对杀虫剂产生抗性的一个重要原因。生化研究结果表明:对甲萘威(RR=562)和甲基对硫磷(RR=354)产生高水平抗性的草地贪夜蛾解毒代谢酶活性显著高于敏感种群。抗性草地贪夜蛾幼虫中肠中,微粒体氧化酶(环氧酶、羟化酶、亚砜酶、N-脱甲基酶和O-脱甲基酶)和水解酶(酯酶,羧酸酯酶,β-葡萄糖苷酶)的活性分别提高1.2倍和1.9倍。抗性草地贪夜蛾幼虫脂肪体中,微粒体氧化酶(环氧酶、羟化酶、亚砜酶、N-脱甲基酶、O-脱甲基酶和S-脱甲基酶)、谷胱甘肽S-转移酶、水解酶(酯酶、羧酸酯酶、β-葡萄糖苷酶、羧胺酶)、还原酶(细胞色素c还原酶)的活性相比对敏感种群提高了1.3倍~7.7倍。细胞色素P450的活性升高了2.5倍[22]。而且,谷胱甘肽S-转移酶、细胞色素P450及羧酸酯酶基因的过量表达也介导了草地贪夜蛾对毒死蜱和高效氯氟氰菊酯的抗性。此外,靶标敏感性降低是草地贪夜蛾对杀虫剂产生抗性的另一重要原因;酶动力学研究结果表明:氨基甲酸酯类和有机磷类杀虫剂对田间抗性草地贪夜蛾乙酰胆碱酯酶的抑制活性降低17倍~345倍,乙酰胆碱酯酶与氨基甲酸酯类和有机磷类杀虫剂的亲和力降低,Km值和Vmax在抗性种群中升高2倍以上[22-23]。Carvalho等的研究结果表明:毒死蜱抗性草地贪夜蛾乙酰胆碱酯酶基因发生A201S,G227A和 F290V氨基酸突變。高效氯氟氰菊酯抗性草地贪夜蛾电压门控钠离子通道基因存在抗性相关的T929I,L932F和L1014F氨基酸突变[24]。此外,室内选育的对氯虫苯甲酰胺(RR=225)和氟苯虫酰胺(RR>5 400)产生高水平抗性的草地贪夜蛾,其鱼尼丁受体基因发生与抗性相关的I4734M氨基酸突变[25]。
4 种子处理对草地贪夜蛾的防治效果
种子包衣省时省力,是防治草地贪夜蛾的重要措施,可以在作物生长早期对草地贪夜蛾起到持续控制作用,但在作物生长中后期控制作用较弱。因此,作为草地贪夜蛾IPM治理的重要一环,还需要与其他防治措施,如喷雾防治等相结合。
美国在20世纪60年代即开始拌种防治大豆上草地贪夜蛾。室内试验结果表明,采用75%克百威可湿性粉剂以有效用量125 g/kg对大豆拌种处理,播种2周和3周后对草地贪夜蛾的防治效果分别达到88.9%和96.9%[26]。在田间,硫双威和克百威是种子包衣防治草地贪夜蛾的常用活性成分[8]。随着鱼尼丁受体抑制剂的问世,氯虫苯甲酰胺和溴氰虫酰胺也可以通过种子包衣防治草地贪夜蛾,但这两种药剂通过种子包衣防治草地贪夜蛾其效果发挥较慢。按有效成分用量,用氯虫苯甲酰胺 65.4 g/hm2、溴氰虫酰胺8.99 g/hm2拌种,大豆苗接虫后1 d,两个处理均对草地贪夜蛾没有影响;接虫后2~3 d,氯虫苯甲酰胺处理可以有效减少草地贪夜蛾虫口数量,但溴氰虫酰胺处理对虫口数量没有影响;接虫后4 d,氯虫苯甲酰胺处理对草地贪夜蛾的防治效果为80%,溴氰虫酰胺处理的防治效果为50%[27]。此外,用氯虫苯甲酰胺等药剂对种子包衣对草地贪夜蛾捕食性天敌黑刺益蝽Podisus nigrispinus的影响较小,有利于保护天敌[28]。研究还发现,常用的新烟碱类杀虫剂种子包衣对草地贪夜蛾无效。
5 雾滴粒径对草地贪夜蛾抗药性发展的影响
杀虫剂雾滴粒径对草地贪夜蛾的抗性发展速度有重要影响。不同的施药器械(不同粒径的喷头)会产生不同粒径的雾滴,雾滴粒径将直接影响雾滴在作物冠层的沉积和分布,从而影响杀虫剂的效果以及害虫对杀虫剂抗性的发展速度。研究结果表明,以大雾滴和小雾滴施药,草地贪夜蛾均会对氯氰菊酯产生抗性,但是在大雾滴沉積模式下抗性发生速度显著高于小雾滴。小雾滴的沉积覆盖度和均匀度高于大雾滴,因而在作物叶面上有效成分的沉积量高于大雾滴。而且,雾滴的分布会影响害虫的运动和取食行为,杀虫剂分布不均匀时,部分个体接触到的杀虫剂会更少;Al-Sarar等的研究结果表明,小雾滴施药,草地贪夜蛾幼虫会移动到叶片的边缘,取食面积小,仅在叶片上留下小洞。而大雾滴沉积模式下,草地贪夜蛾幼虫会待在某个地方持续取食,取食面积大[29]。同样,Adams等发现,大小均匀的氯菊酯雾滴对小菜蛾取食的抑制能力更强[30]。综上,小雾滴沉积模式下,幼虫通过取食将接触到致死剂量的药剂,而大雾滴沉积模式下,幼虫可能接触到亚致死剂量的药剂,从而诱导害虫的多基因抗性[31]。
6 不同作用机制杀虫剂对草地贪夜蛾的交互抗性
采自Puerto Rico地区的草地贪夜蛾对Cry1F毒素产生了7 717倍的高水平抗性,同时该种群对乙酰甲胺磷产生了19倍的交互抗性。生化研究结果表明:碱性磷酸酶活性的降低介导了草地贪夜蛾对Cry1F毒素的抗性,而羧酸酯酶和谷胱甘肽S-转移酶活性的升高介导了其对乙酰甲胺磷的抗性[32]。从佛罗里达州北部采集的2个草地贪夜蛾种群对甲萘威产生了高水平抗性(分别为626倍和1 159倍),对甲基对硫磷产生了中等水平抗性(分别为30倍和39倍)。然而,这两个草地贪夜蛾种群对茚虫威不存在交互抗性。进一步的研究结果表明,这两个种群的解毒代谢酶(微粒体氧化酶、谷胱甘肽S-转移酶及酯酶)活性显著升高,但这些解毒代谢酶活性的升高并没有诱导其对茚虫威的抗性[33]。类似的研究结果发现:对茚虫威产生100倍抗性的果蝇对菊酯类、有机磷类、氨基甲酸酯类及氯代烃类杀虫剂仅表现为低水平抗性[34]。而且,对氯菊酯产生高水平抗性(RR=987)的小菜蛾对茚虫威也不存在交互抗性[32]。因此,茚虫威作为一种作用机制独特的杀虫剂可以与有机磷类、氨基甲酸酯类和拟除虫菊酯类杀虫剂轮换使用,从而延缓草地贪夜蛾抗性的发展速度。
7 化学杀虫剂与生物杀虫剂对草地贪夜蛾协同增效作用
岛甲腹茧蜂Chelonus insularis 是一种可以寄生草地贪夜蛾的重要寄生蜂。Zenner等的研究结果表明:被岛甲腹茧蜂寄生的草地贪夜蛾2龄幼虫对毒死蜱的敏感性提高了3.93倍,对灭多威的敏感性提高了3.71倍,对氯氰菊酯的敏感性提高了14.11倍,而岛甲腹茧蜂寄生对苏云金芽孢杆菌的毒力影响较小。这种增效作用可能是由于天敌寄生对寄主幼虫的削弱作用导致其解毒代谢酶活性降低[35]。因此,岛甲腹茧蜂可以与灭多威、氯氰菊酯等杀虫剂复配使用,从而起到协同增效、减少杀虫剂用量的目的。此外,Rivero-Borja等[36]报道,乙基毒死蜱和多杀霉素与球孢白僵菌Beauveria bassiana和金龟子绿僵菌Metarhizium anisopliae同时使用可以显著提高两种菌的毒力。当这两种真菌单独使用时,<1%的幼虫会有真菌孢子形成,而与毒死蜱和多杀霉素同时使用时,31%~47%的幼虫会有真菌孢子形成,死虫则有68%~93%有真菌孢子形成。同时,当球孢白僵菌(Bb88)与多杀霉素同时使用时,可以将多杀霉素的致死率提高34%;然而,当球孢白僵菌(Bb88)与毒死蜱同时使用或先于毒死蜱使用,或者金龟子绿僵菌先于毒死蜱使用时,会使幼虫的死亡率分别降低31%、27%和19%[36]。因此,当杀虫剂与虫生真菌联合使用防治草地贪夜蛾时需注意使用的次序,才能达到协同增效的目的。
8 植物生长调节剂和助剂使用对草地贪夜蛾防治的增效机制
相关研究表明,植物生长调节剂壬二酸(AA)、苯并噻二唑(BTH)、赤霉酸(GA3)、效应蛋白(harpin)、茉莉酸(JA)可以激活植物的信号通路,导致次生代谢物产生和其他抗性相关信号增强,从而降低蚜虫等害虫在玉米、棉花、水稻和大豆等作物上的适应性,阻碍它们的进食,并吸引有益昆虫[3738]。研究发现茉莉酸(JA)可以诱导双子叶作物棉花和大豆对草地贪夜蛾的抗性,然而对单子叶作物玉米和水稻却影响不大。加入有机硅助剂(Dyne-Amic)、非离子表面活性剂(penetrator plus)和高分子助剂(Triton X-100、Tween-20)不会增加茉莉酸对棉花和大豆的抗性诱导作用,但从有害生物综合防控的角度来看,助剂的添加有助于茉莉酸在作物叶片上的渗透和吸收,可以降低茉莉酸的用量,具有很好的经济效益[39]。
[8] PITRE H N. Chemical control of the fall armyworm (Lepidoptera:Noctuidae):an update [J]. Florida Entomologist, 1986, 69(3):570578.
[9] BROOKES G, BARFOOT P. Environmental impacts of genetically modified (GM) crop use 1996-2015:impacts on pesticide use and carbon emissions[J]. GM Crops Food,2017, 8(2):117147.
[10]IRAC.Integrated pest management (IPM) & insect resistance management (IRM) for fall armyworm in South African maize[R/OL].IRAC South Africa.www.irac-oline.org,May 2018.
[11]MOTA-SANCHEZ D, WISE J C. Arthropod pesticide resistance database [DB/OL]. Michigan State University. https:∥www.pesticideresistance.org/, 2019.
[12]BLANCO C A, PORTILLA M, JURAT-FUENTES J L, et al. Susceptibility of isofamilies of Spodoptera frugiperda (Lepidoptera:Noctuidae) to Cry1Ac and Cry1Fa proteins of Bacillus thuringiensis [J]. Southwestern Entomologist, 2010, 35:409415.
[13]STORER N P, BABCOKE J M, SCHLENZ M, et al. Discovery and characterization of field resistance to Bt maize:Spodoptera frugiperda (Lepidoptera:Noctuidae) in Puerto Rico [J]. Journal of Economic Entomology, 2010, 103(4):10311038.
[14]HUANG Fangneng, QURESHI J A, MEAGHER R L, et al. Cry1F resistance in fall armyworm Spodoptera frugiperda:single gene versus pyramided Bt maize[J/OL]. PLoS ONE, 2014, 9(11):e112958.
[15]LI Guoping, DOMINIC R, MIAO Jin, et al. Frequency of Cry1F non-recessive resistance alleles in north Carolina field populations of Spodoptera frugiperda (Lepidoptera:Noctuidae)[J/OL]. PLoS ONE, 2016, 11(4):e0154492.
[16]HUANG F, QURESHI J A, HEAD G P, et al. Frequency of Bacillus thuringiensis Cry1A.105 resistance alleles in field populations of the fall armyworm, Spodoptera frugiperda, in Louisiana and Florida [J]. Crop Protection, 2016, 83:8389.
[17]OMOTO C, BERNARDI O, SALMERON E, et al. Field-evolved resistance to Cry1Ab maize by Spodoptera frugiperda in Brazil [J]. Pest Management Science, 2016, 72:17271736.
[18]FARIAS J R, ANDOW D A, HORIKOSHI R J, et al. Field-evolved resistance to Cry1F maize by Spodoptera frugiperda (Lepidoptera:Noctuidae) in Brazil [J].Crop Protection, 2014, 64:150158.
[19]BERNARDI O, SORGATTO R J, BARBOSA A D, et al. Low susceptibility of Spodoptera cosmioides,Spodoptera eridania and Spodoptera frugiperda (Lepidoptera:Noctuidae) to genetically-modified soybean expressing Cry1Ac protein[J]. Crop Protection, 2014, 58:3340.
[20]CHANDRASENA D I, SIGNORINI A M, ABRATTI G, et al. Characterization of field-evolved resistance to Bacillus thuringiensis-derived Cry1F δ-endotoxin in Spodoptera frugiperda populations from Argentina[J]. Pest Management Science, 2017, 74:746754.
[21]GUTIERREZ-MORENO R, MOTA-SANCHEZ D, BLANCO C A, et al. Field-evolved resistance of the fall armyworm (Lepidoptera:Noctuidae) to synthetic insecticides in Puerto Rico and Mexico[J]. Journal of Economic Entomology, 2019, 112:792802.
[22]YU S J, NGUYEN S N, ABO-ELGHAR G E. Biochemical characteristics of insecticide resistance in the fall armyworm, Spodoptera frugiperda (J.E.Smith)[J]. Pesticide Biochemistry and Physiology, 1991, 39(1):8491.
[23]YU S J. Insensitivity of acetylcholinesterase in a field strain of the fall armyworm, Spodoptera frugiperda (J. E. Smith)[J].Pesticide Biochemistry and Physiology,2006,84(2):135142.
[24]CARVALHO R A, OMOTO C, FIELD L M, et al. Investigating the molecular mechanisms of organophosphate and pyrethroid resistance in the fall armyworm Spodoptera frugiperda [J/OL]. PLoS ONE, 2013, 8(4):e62268.
[25]BOAVENTURA D, BOLZAN A, PADOVEZ F, et al. Detection of a ryanodine receptor target-site mutation in diamide insecticide resistant fall armyworm, Spodoptera frugiperda [J/OL]. Pest Management Science, 2019. DOI:10.1002/ps.5505.
[26]BOWLING C C, FLINCHUM W T. Interaction of propanil with insecticides applied as seed treatments on rice [J]. Entomological Society of America, 1968, 61(1):6769.
[27]THRASH B, ADAMCZYK J J, LORENZ G, et al. Laboratory evaluations of Lepidopteran-active soybean seed treatments on survivorship of fall armyworm (Lepidoptera:Noctuidae) larvae [J]. Florida Entomologist, 2013, 96(3):724728.
[28]GONTIJO P C, ABBADE NETO D O, OLIVEIRA R L, et al. Non-target impacts of soybean insecticidal seed treatments on the life history and behavior of Podisus nigrispinus, a predator of fall armyworm [J]. Chemosphere, 2017, 191:342349.
[29]AL-SARAR A, HALL F R, DOWNER R A. Impact of spray application methodology on the development of resistance to cypermethrin and spinosad by fall armyworm Spodoptera frugiperda (J. E. Smith)[J]. Pest Management Science, 2006, 62:10231031.
[30]ADAMS J A, HOY C W, HALL F R, et al. Larval feeding and movement in two Plutella xylostella (Lepidoptera:Plutellidae) populations exposed to discrete deposits of permethrin[J]. Pest Management Science,2010, 35(3):243247.
[31]PRAAT J P, MANKTELOW D, SUCKLING D M, et al. Can application technology help to manage pesticide resistance?[C]∥Proceedings of the 49th New Zealand Plant Protection Conference, 1996:177182.
[32]ZHU Yucheng, BLANCO C A, PORTILLA M, et al. Evidence of multiple/cross resistance to Bt and organophosphate insecticides in Puerto Rico population of the fall armyworm, Spodoptera frugiperda [J]. Pesticide Biochemistry and Physiology, 2015, 122:1521.
[33]YU S J, MCCORD E. Lack of cross-resistance to indoxacarb in insecticide-resistant Spodoptera frugiperda (Lepidoptera:Noctuidae) and Plutella xylostella (Lepidoptera:Yponomeutidae)[J]. Pest Management Science, 2007, 63(1):6367.
[34]SHONO T, ZHANG L, SCOTT J G. Indoxacarb resistance in the house fly, Musca domestica [J]. Pesticide Biochemistry and Physiology, 2004, 80:106112.
[35]ZENNER I, LVAREZ A, BARRETO S, Influence of parasitism by Chelonus insularis Cresson (Hymenoptera:Braconidae) on the susceptibility of Spodoptera frugiperda (J.E. Smith) (Lepidoptera:Noctuidae) to insecticides [J]. Neotropical Entomology, 2006, 35(6):818822.
[36]RIVERO-BORJA M, GUZMAN-FRANCO A W, RODRIGUEZ-LEYVA E, et al. Interaction of Beauveria bassiana and Metarhizium anisopliae with chlorpyrifos ethyl and spinosad in Spodoptera frugiperda larvae [J]. Pest Management Science, 2018, 74:20472052.
[37]COTTRELL T E, WOOD B W, NI Xinzhi. Application of plant growth regulators mitigates chlorotic foliar injury by the black pecan aphid (Hemiptera:Aphididae)[J]. Pest Management Science, 2010, 66(11):12361242.
[38]BAKERC J, ORLANDI E W, MOCK N M. Harpin, an elicitor of hypersensitive response in tobacco caused by Erwinia amylovora, elicits active oxygen production in suspension cells[J]. Plant Physiology, 1993, 102:13411344.
[39]GORDY J W, LEONARD B R, BLOUIN D, et al. Comparative effectiveness of potential elicitors of plant resistance against Spodoptera frugiperda (J. E. Smith) (Lepidoptera:Noctuidae) in four crop plants [J/OL]. PLoS ONE, 2015, 10(9):e0136689.
[40]KUHN C W, JELLUM M D, ALL J N. Effect of carbofuran treatment on corn yield, maize chlorotic dwarf and maize dwarf mosaic virus diseases, and leafhopper populations [J].Phytopathology, 1975, 65(9):10171020.
[41]YOUNG J R. Fall armyworm:control with insecticides [J]. The Florida Entomologist, 1979, 62(2):130133.
[42]HERZOG G A, LAMBERT W R, LAW S E, et al. Evaluation of an electrostatic spray application system for control of insect pests in cotton[J]. Journal of Economic Entomology, 1983, 76(3):637640.
[43]GROSS H R, YOUNG J R, WISEMAN B R. Relative susceptibility of a summer-planted dent and tropical flint corn variety to whorl stage damage by the fall armyworm (Lepidoptera:Noctuidae)[J]. Journal of Economic Entomology, 1982, 75(6):11531156.
[44]TAMEZ-GUERRA P, TAMAYO-MEJIA F, GOMEZ-FLORES R, et al. Increased efficacy and extended shelf life of spinosad formulated in phagostimulant granules against Spodoptera frugiperda [J]. Pest Management Science, 2018, 74:100110.
(責任编辑:杨明丽)
