双靶向紫杉醇聚酰胺聚合物胶束的体内评价
2019-08-29王彦会刘月平
王 莹,王彦会,刘月平,姜 琳
(吉林省肝胆病医院,吉林 长春130051)
紫杉醇(PTX)可以作用于细胞分裂过程中组成纺锤体的微管蛋白的特定部位从而起到防止其解聚的作用,在细胞分裂过程中,不能由微管蛋白迅速合成纺锤体微管,使细胞的分裂永远停留在G2和M期,导致其无法复制,从而起到杀死癌细胞的作用[1-5]。而PTX的溶解性问题是其制剂的首要问题[6]。另外,PTX作为细胞毒性的抗肿瘤药物,因为缺乏肿瘤靶向性,甚至导致全身性毒性[7],特别是中性粒细胞减少症等免疫性疾病,这使得其临床应用受到很大限制。我们在前期研究中已制备出以聚酰胺聚合物 (PAMAM)-聚乙二醇(PEG)为骨架的叶酸(FA)/透明质酸(HA)双靶向载PTX胶束,载药量为18.5%,本研究利用此类自制的胶束,考察其在小鼠的瘤内分布及抗肿瘤活性。
1 材料与方法
1.1 材料
1.1.1试剂 十八胺、N,N一二甲基甲酰胺、甲酰胺、N,N一二环己基碳二亚胺、FA、HA、1-(3-二甲基丙基)-3-乙基碳二亚胺均购自麦克林;硼酸购自天津市恒兴化学试剂制造有限公司;十水合四硼酸钠、二甲亚砜均购自国药集团化学试剂有限公司;NH2-PEG2000-COOH、透析袋均购自北京索莱宝科技有限公司;PAMAM购自威海晨源分子新材料有限公司。SKOV-3 细胞株及B16细胞株购自南昌乐悠生物科技有限公司;PTX购自大连美仑生物技术有限公司。
1.1.2仪器 H-J磁力加热搅拌器(巩义市裕华仪器有限责任公司),PH400基础型酸度计(安莱利斯有限公司),TY96-11IV超声波细胞粉碎机(宁波新艺生物科技葛粉有限公司),高速冷冻离心机(Thermo),电热鼓风干燥箱(上海博迅有限公司),GOLD-SIM冷冻干燥机(美国金西盟国际集团),小动物活体成像仪capliper(lumina series),激光共聚焦显微镜(德国Leica公司)。
1.2 方法
1.2.1荧光标记的载PTX胶束的制备 利用PAMAM的氨基末端与异硫氰酸荧光素的异硫氰基可以共价结合的化学反应,制备荧光标记物。称取PAMAM适量,溶于PBS缓冲液中(pH=7.4),缓慢滴加异硫氰酸荧光素的丙酮溶液。摩尔比为PAMAM:异硫氰酸荧光素=1∶1.2。避光磁力搅拌36 h,透析袋中透析3 d,离心除去未反应的异硫氰酸荧光素,冻干得到异硫氰酸荧光素标记的PAMAN聚合物。异硫氰酸荧光素,在488 nm激发波长下,显示特征绿色荧光。称取硼砂1.8953 g、硼酸 1.2357 g 溶于1 L蒸馏水中,得到pH=8的缓冲溶液,避光保存。将PAMAM 2.0796 g和PEG 0.1410 g溶于20 mL硼砂-硼酸缓冲液中,室温,避光,磁力搅拌12 h。将反应混合物转移至50 Kd截留分子量的超滤管中超滤,转速为4000 rpm/min,30 min/次,共超滤7次,收集上层液体,冻干后称重、密封保存。按参考文献的方法合成HA-C18[8],并进一步合成FA-HA-C18[9],冻干后称重、密封保存。称取PTX 50 mg,溶于2.5 ml无水乙醇中,用无水乙醇溶解的PTX缓慢滴加至FA-HA-C18的溶液中,磁力搅拌24 h,冰浴超声10 min,溶液于4000 rpm/min离心30 min,上清液经过0.45 μm滤膜,得到FA-HA-PTX混合物。在上述混合液中加入N-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,室温避光反应12 h,加至PEG-PAMAM的水溶液中。用盐酸调节PH值至8.0,室温避光反应12 h。反应结束后,用蒸馏水透析,离心除杂质,冻干后称重、密封保存。
1.2.2建立SKOV-3荷瘤裸鼠模型及小动物活体成像检测 取处于对数生长期的SKOV-3细胞5×106个,接种至5-6周的雌性荷瘤裸鼠的右侧腋下,待肿瘤体积长至1 cm3时分为三组,经尾静脉注射进行给药,第一组为对照组,给予生理盐水溶液,第二组为给药组,给予荧光标记的载PTX胶束(紫杉醇3 mg/kg)。分别于注射后0.5 h,2 h,6 h,12 h,24 h乙醚麻醉小鼠,进行小动物活体荧光成像实验,记录肿瘤部位的荧光强度。小动物活体成像仪测定载PTX胶束的荧光(绿光)。
1.2.3建立B16荷瘤小鼠模型及抑瘤率、生存情况的评价 取处于对数生长期的B16细胞1×106个,接种至6-8周的雄性C57BL/6小鼠的右侧腋下,待肿瘤体积长至1 cm3时分为三组,经尾静脉注射进行给药,第一组为对照组,给予生理盐水溶液,第二组为阳性组,给予小分子PTX 3 mg/kg,第三组为给药组,给予载PTX胶束(紫杉醇3 mg/kg),分别于接种后1 d、7 d、14 d和21 d经尾静脉注射,每天观察小鼠的生存状况,并隔天记录肿瘤大小,按如下公式计算肿瘤体积、抑瘤率、绘制生存曲线,计算平均生存时间和生存延长期。肿瘤体积:V=a×b2/2(a 长径,b 短径)。抑瘤率(%)=(1-D/S)×100 (D,治疗组肿瘤体积;S,生理盐水组肿瘤体积)。生存期延长率(%)=(T/C-1)×100(T,治疗组的平均生存时间,C,对照组的平均生存时间)。
2 结果
2.1 肿瘤的荧光成像
如图1所示,随着时间的延长,荧光标记载PTX胶束的肿瘤部位荧光蓄积逐渐增多,均显著高于对照组,尤其在12 h时及24 h时最多,说明荧光标记载PTX胶束的肿瘤靶向性较好。
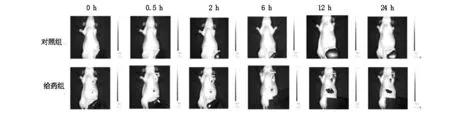
图1 肿瘤内荧光成像(对照组:给予生理盐水溶液;给药组:给予荧光标记的载PTX胶束,含紫杉醇3 mg/kg)
2.2 肿瘤的抑瘤效果及小鼠生长情况
如图2所示,载PTX胶束(给药组)的抑瘤效果与小分子PTX(阳性组)类似,随着时间的延长,给药组和阳性组肿瘤的体积逐渐降低,从接种20 d开始,给药组肿瘤体积较阳性组略有降低,说明载PTX胶束的抑瘤效果明显,且略强于小分子PTX。
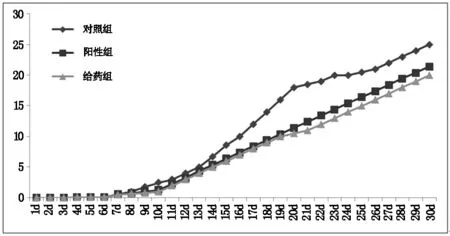
图2 各组小鼠的肿瘤生长情况(对照组:给予生理盐水溶液;阳性组:给予小分子PTX 3 mg/kg,给药组:给予载PTX胶束,含紫杉醇3 mg/kg)
如图3所示,载PTX胶束组小鼠的平均生存时间随着时间的延长无明显变化,阳性组和对照组小鼠的平均生存时间逐渐降低,阳性组小鼠的平均生存时间显著长于对照组,说明载PTX胶束组小鼠的平均生存时间明显长于对照组和小分子PTX组。

图3 各组小鼠的平均生存时间(对照组:给予生理盐水溶液;阳性组:给予小分子PTX 3 mg/kg,给药组:给予载PTX胶束,含紫杉醇3 mg/kg)
如表1所示,载PTX胶束组小鼠的抑瘤率显著强于对照组,略强于阳性组;载PTX胶束组小鼠的平均生存时间显著长于对照组及阳性组;载PTX胶束组小鼠的生长期延长率显著高于对照组及阳性组。

表1 各组小鼠的抑瘤率、平均生长时间及生长期延长率统计结果
注:对照组给予生理盐水溶液;阳性组给予小分子PTX 3 mg/kg,给药组给予载PTX胶束,含紫杉醇3 mg/kg。
3 讨论
恶性肿瘤已经成为影响人类健康的主要疾病之一,据统计,2010年有超过1200万人被确诊患上癌症,有760万病人死于各种癌症。我国流行病学调查显示,恶性肿瘤的死亡率居城市和农村全部死亡病例之首,并有明显上升趋势。如今,恶性肿瘤的治疗方法中,化疗是主要方法之一[10-13],但化疗药物又存在缺乏靶向性和毒副作用大的缺陷。所以设计构建毒副作用小,靶向性高的抗肿瘤靶向载体系统具有很好的药学研究前景。
分子物质和脂质在肿瘤组织透过性增强及滞留效应称作实体瘤的高通透性和滞留效应(EPR)[14,15],EPR效应促进了大分子类物质在肿瘤组织的选择性分布,可以增加药效并减少系统副作用,本研究基于EPR效应原理,将高分子聚合物与小分子化疗药物的偶联物,通过药剂学手段结合到高分子材料表面,有效地缓解了传统纳米粒的突释效应,因而具有独特的优势。并且通过双靶向载药系统设计进一步提高PTX抗肿瘤作用,并改善其毒副作用。本研究中采用了FA和HA作为肿瘤靶向基团,对PTX-PAMAM进行了双靶向的修饰,并组装成胶束进行了体内评价。
体内评价首先采用了半定量的小动物活体成像实验,初步考察了载PTX胶束在SKOV-3荷瘤裸鼠肿瘤部位的蓄积,结果表明,随着时间的延长,荧光标记载PTX胶束的肿瘤部位荧光蓄积逐渐增多,均显著高于对照组,尤其在12 h时及24 h时最多,说明荧光标记载PTX胶束的肿瘤靶向性较好。其次,采用B16荷瘤小鼠的体内抗肿瘤活性研究,通过肿瘤生长曲线、小鼠生存曲线及抑瘤率等观察,均可看出载PTX胶束组在小鼠的抑瘤率、生存时间、生存率等方面均显示出明显的优势。由此可见,将高分子聚合物与小分子化疗药物PTX偶联,并以双主动靶向基团修饰载体后组装成纳米胶束,在体内抑瘤效果及肿瘤靶向标记等方面均是一种可行的途径,但其作用机制有待进一步研究。
