光质对小豆芽苗菜生长和类黄酮的影响及其机理初步探究
2019-08-28陈景斌陈华涛薛晨晨袁星星苏娜娜
居 鑫,陈 沁,陈景斌,陈华涛,薛晨晨,袁星星,李 娜,苏娜娜,崔 瑾,*,陈 新,*
(1.南京农业大学生命科学学院,江苏南京 210095;2.江苏省农业科学院经济作物研究所,江苏南京 210014;3.江苏省高效园艺作物遗传改良实验室,江苏南京 210014)
小豆(VignaangularisL.),又称红小豆、饭豆,俗称红豆,为豆科植物,原产地为中国[1],小豆的营养价值很高,在7种豆类中,它的类黄酮和单体种类及含量都是最高的,约0.501 mg/g[2]。小豆芽是一种口感鲜嫩、营养丰富的芽菜,等到芽苗长到3~15 cm左右高时采割食用[3]。小豆芽苗菜也富含类黄酮等物质,类黄酮是植物中具有营养功能的次生代谢产物,具有抗癌和抗肿瘤等药理作用[4],槲皮素和芦丁是最典型的类黄酮单体[5]。类黄酮又称黄酮类物质。研究如何提高小豆芽苗菜中黄酮类化合物含量具有重要意义。
近年来,光质和光周期对植物次生代谢的影响及其机理研究引起国内外学者的广泛关注。不同光质通过特定光受体传导影响植物适应环境能力和发育进程,调控植物光形态建成,光质在光环境调控植物生长发育过程中扮演着至关重要的角色[6]。有研究表明,适当的UV-B处理可以诱导酚类物质及黄酮类物质的生物合成和积累,例如UV-B光处理可提高苦荞麦芽花青苷和芦丁的含量[7];UV-B处理可以提高大豆异黄酮、花青苷和芦丁等[8-9]含量;UV-B处理显著提高了总酚物质尤其是丁香酸、对-香豆酸和阿魏酸三种单体含量[10]。目前关于UV-B 诱导小豆芽苗菜黄酮类物质积累及其合成机理尚不明确。
本试验以小豆(VignaangularisL.)为试验材料,根据文献选用适宜光质,探索出最适宜的光质和光周期,为工厂化生产光环境调控设施提供重要的科学依据,并且较为系统地研究了不同光质对小豆芽苗菜生长发育和营养品质等的影响,初步探索了UV-B对小豆芽苗菜光形态建成和黄酮类物质合成机理。
1 材料与方法
1.1 材料与仪器
供试小豆(珍珠粒小豆) 北京农林科学院;乙腈和甲醇 色谱纯,天津市科密欧化学试剂有限公司;芦丁、槲皮素和山奈酚 纯度≥ 98%,源叶生物公司;其余试剂 均为分析纯。
Agilent 1100型高效液相色谱仪(G1311A四元泵,G1379A真空再线脱气机,G1315 DAD检测器,G1316A柱温箱) 美国Agilent公司;GXZ型智能光照培养箱 宁波江南仪器厂;GLZ-A型光量子计 浙江托普仪器有限公司;T8 LED灯管 荷兰飞利浦公司;T5 UV-A灯管 日本东芝公司;G15T8E UV-B灯管 日本SANKYO公司。
1.2 实验方法
1.2.1 芽苗菜的培养 用人工清洗的方法,剔除虫蛀、残破、畸形、霉变的种子及杂质,用水浸泡8~10 h,去除漂浮的种子和种皮上的粘液,沥去多余水分。然后取出种子沥干水分,均匀洒在底部铺有4层潮湿纱布的白瓷盘中,并在种子上覆盖2层潮湿纱布,催芽12~18 h。待种子发芽近0.5~1 cm时,将种子播种到铺有蛭石的育苗盘中,培养60 h后置于不同光质条件下培养,测定各项指标。
1.2.2 不同光质处理 LED冷光源培养箱内培养小豆芽苗菜,设置黑暗(Dark,D)和各光质处理(图1),相对湿度为80%左右,温度为(25±2) ℃,光周期为12 h·d-1。箱内顶置LED光源,包括白光(White Light,W)、蓝光(Blue Light,B),紫外光A(Ultraviolet A,UV-A,波长320~400 nm)和紫外光B(Ultraviolet B,UV-B,280~320 nm)(由于目前国内市场中LED产品中UV-B价格昂贵且不易购买,故用UV-B紫外窄谱灯管替代)。调节电流、占空比以及光源与植株的距离,使用光量子计测量光量,使光量均为30 mol·m-2·s-1左右。紫外光(UV-A、UV-B)辐射度为5 W/m2。以W为对照,待小豆芽苗菜培养48 h后采收备用。

图1 光源小区示意图
1.2.3 UV-B处理时长研究 在LED冷光源培养箱内培养小豆芽苗菜,设置不同UV-B时长处理,相对湿度为80%左右,温度为(25±2) ℃,光周期为12 h·d-1(即12 h光照后12 h黑暗)。以 W为对照,将UV-B光照时长设置为2、4、6、8、12 h,补充W光照时长对应为10、8、6、4、0 h(光照总时长为12 h),依次表示为“UV-B 2 h”、“UV-B 4 h”、“UV-B 6 h”、“UV-B 8 h”、“UV-B 12 h”。测定生长指标和类黄酮含量。
1.2.4 UV-B光照时间进程处理 UV-B光照时间进程处理在LED冷光源培养箱内培养,相对湿度为80%左右,温度为(25±2) ℃,光周期为12 h·d-1。
每隔12 h取一次样,测定12~120 h类黄酮含量;测定12~60 h类黄酮合成关键酶活性。
1.2.5 生长指标测定 随机取样,不同处理分别取15株,用直尺测量株高和根长;另外,不同处理分别取15株,用万分之一天平测定不含根的可食鲜质量和全株鲜质量,然后105 ℃杀青15 min,85 ℃烘至恒质量,测定可食干质量和全株干质量,3次重复。
可食率(%)=可食鲜质量×100/全株鲜质量
含水率(%)=(全株鲜质量-全株干质量)×100/全株鲜质量
1.2.6 生理生化指标测定
1.2.6.1 总酚类物质和类黄酮含量测定 随机取样,称取1 g小豆芽苗菜茎部,总酚类物质含量采用Folin-Ciocalteu比色法测定[11],绘制总酚类物质含量标准曲线为A=0.0004C+0.0008,相关系数r=0.9994;类黄酮含量采用氯化铝-亚硝酸钠比色法[12],绘制类黄酮含量标准曲线为A=0.0007C+0.1985,r=0.9977。
1.2.6.2 类黄酮单体测定 类黄酮单体芦丁(rutin)、槲皮素(quercetin)、山奈酚(kaempferol)含量采用高效液相色谱(HPLC)进行定性定量分析。提取方法及色谱条件参考文献[13],标样为芦丁、槲皮素、山奈酚。色谱条件:色谱柱:Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相乙腈(A)-0.1%磷酸水溶液(B)进行梯度洗脱(0~7 min,A相20%→32%;7~10 min时,A相32%;10~25 min,A相32%→55%;体积质量1.0 mL/min;柱温为室温;检测波长365 nm;进样量20 μL。所有指标设置3次重复。
1.2.6.3 类黄酮合成关键酶活测定 查尔酮合成酶(chalcone synthase,CHS)、黄酮醇合酶(flavonol synthase,FLS)粗酶液提取:随机取样,称取1 g小豆芽苗菜茎部,加入一定量的PBS,pH7.4。用液氮迅速冷冻保存备用。样品融化后仍然保持2~8 ℃的温度。加入一定量的PBS(pH7.4),或组织蛋白萃取试剂,用手工或匀浆器将标本匀浆化。离心20 min左右(2000~3000 r/min)。仔细收集上清。分装后,一份待检测,其余保存在-70 ℃冷冻备用。样品设置3次重复。
查尔酮合成酶(CHS)活性测定参照Li等[14]的方法;黄酮醇合酶(FLS)活性测定参照Li等[15]的方法。
1.2.7 类黄酮合成关键酶基因相对表达量测定 关键酶基因相对表达量测定:苯丙氨酸解氨酶基因(phenylalanine ammonia-lyase class,PALclass2)、查尔酮合成酶基因(chalcone synthase 17-like,CHS17like)、查耳酮异构酶基因(chalcone--flavonone isomerase-like,CHIlike)、黄酮醇合酶基因(flavonol synthase/flavanone 3-hydroxylase,FLS)、黄酮糖基转移酶基因(flavonoid 3-O-glucosyltransferase-like,UGT78D1like)相对表达量测定:总RNA采用Trizol法[16]提取,琼脂糖凝胶电泳验证后使用Thermo公司反转录试剂盒合成cDNA,-20 ℃保存。采用DBI®Bioscience试剂盒,使用三步法进行PCR反应。PCR引物设计均依据NCBI数据库Primer designing tool设计(表1)。以小豆Actin作为内参基因对试验结果进行标准化,目标基因相对表达量采用比较阈值法即2-ΔΔCT法。

表1 RT-qPCR引物表
1.3 数据处理
每个样品设置3次重复,采用Excel 2007软件进行数据整理,采用SPSS 20.0软件进行方差分析,采用Duncan’s新复极差法进行显著性检验,p<0.05。采用Origin 8软件进行柱形图和曲线图绘制。
2 结果与分析
2.1 不同光质对小豆芽苗菜生长的影响
由图2可以直观的看出,黑暗处理的小豆芽苗菜为黄化型芽苗菜,而光质处理的小豆芽苗菜为绿化型芽苗菜,光照处理降低了植物的株高。不同处理间的根长没有明显的变化。

图2 光质对小豆芽苗菜生长的影响
由表2可知,与W相比,B、UV-A和UV-B均显著降低(p<0.05)小豆芽苗菜株高,而且UV-B降低程度最大。不同光质之间小豆芽苗菜的根长和茎粗都无显著差异(p>0.05),即光质对小豆芽苗菜的根长和茎粗没有显著影响。另外,光照降低小豆芽苗菜可食鲜重,与W相比,B和UV-A均可小幅降低其可食鲜重,但不显著(p>0.05),UV-B可显著降低其可食鲜重(p<0.05),B和UV-B增加小豆芽苗菜可食干重,UV-A降低其可食干重,但不同光质处理之间均没有显著差异(p>0.05)。与W比,UV-A提高含水率,但差异不显著(p>0.05),而UV-B显著降低含水率(p<0.05)。总之UV-B显著降低了小豆芽苗菜株高、可食鲜重和含水率,其可食干重并未发生变化。

表2 光质对小豆芽苗菜生长的影响
2.2 不同光质对小豆芽苗菜总酚和类黄酮及其单体含量的影响
由图3A可知,与D对比,所有光质处理都显著(p<0.05)提高了小豆芽苗菜总酚的含量。与对照W相比,UV-B显著(p<0.05)提高小豆芽苗菜总酚含量。由图3B可知,与D相比,四种光质处理均显著提高小豆芽苗菜类黄酮含量。与W相比,不同单色光质处理均显著提高小豆芽苗菜类黄酮含量,其中UV-B提高程度最大,其次为B,最后为UV-A。这与张晓燕等[8]使用UV-B提高大豆芽苗菜下胚轴中大豆异黄酮含量、齐学会等[10]使用UV-B显著提高下胚轴中总酚类物质含量的结果类似。
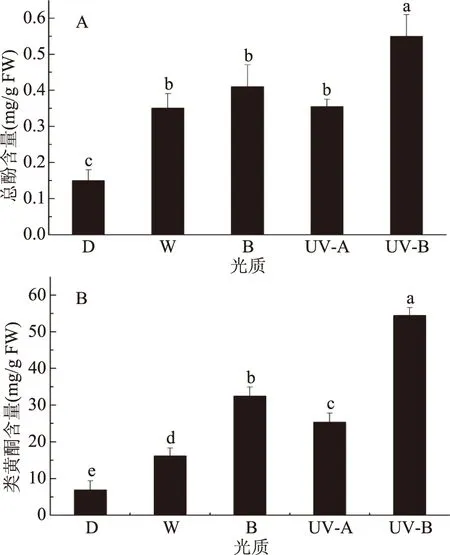
图3 光质对小豆芽苗菜总酚和类黄酮物质含量的影响
对不同光质下不同类黄酮单体含量进行分析(表3),发现UV-B下芦丁和山奈酚的含量最高,和D以及其他光质相比有显著性差异(p<0.05),其他光质之间的芦丁含量没有显著性差异;与D相比,W山奈酚含量显著提高(p<0.05),与B、UV-A相比差异不显著(p>0.05)。槲皮素的含量在D处理下最高,其次依次是W、UV-A、B,最后是UV-B。说明UV-B显著提高了芦丁和山柰酚,降低了槲皮素的含量。

表3 光处理下小豆芽苗菜中类黄酮单体含量
2.3 UV-B光照时长对小豆芽苗菜生长和类黄酮含量的影响
由图4可以发现,与W相比,随着UV-B光照时间的增加,小豆芽苗菜的生长逐渐受到抑制,在12 h时抑制最为严重。
由表4可以发现,随着UV-B时间增加,株高逐渐降低(12 h除外,但均低于W),并且都与对照(W)有显著差异(p<0.05);不同UV-B处理时间下的茎粗并没有显著差异;与W相比,2 h UV-B处理的可食鲜重没有显著下降,4 h及以上UV-B处理显著下降;2和4 h处理小豆芽苗菜可食干重增加,6、8和12 h处理则下降,但差异不显著(p>0.05);不同UV-B处理时长都降低了其含水率,4 h及以上显著降低。说明UV-B通过降低含水率减少小豆芽苗菜可食鲜重,因此2 h和4 h的UV-B处理是比较利于小豆芽苗菜生长的条件。
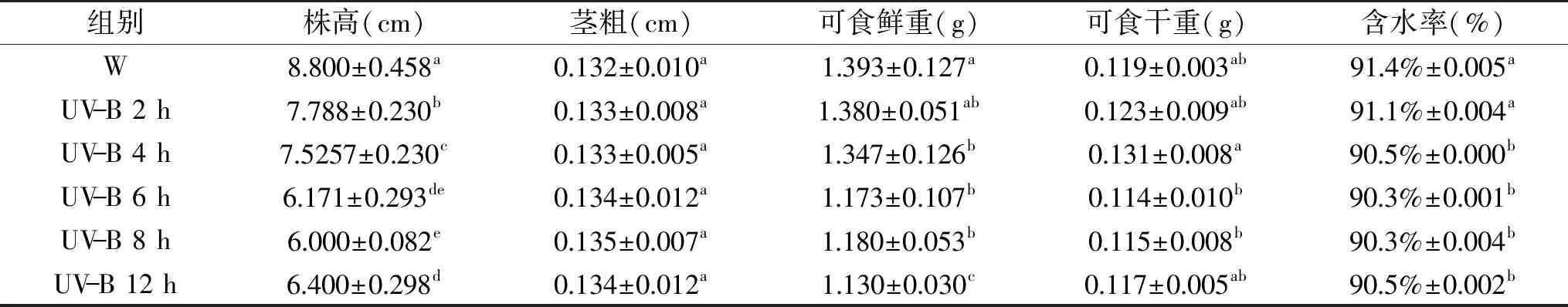
表4 UV-B处理时长对小豆芽苗菜生长的影响
由图5可知,与W相比,UV-B不同时间光照均显著提高了类黄酮含量(p<0.05),其中12 h处理最高,其次是4 h。说明在一定范围内,UV-B光照时间越久,类黄酮含量呈上升趋势。这与齐学会等[9]在UV-B光下8 h·d-1和12 h·d-1显著提高大豆芽苗菜下胚轴中总含量结果类似。本实验中4和12 h UV-B处理最好,这可能是由于品种差异。结合UV-B光照时长对小豆芽苗菜生长的影响结果,可以发现4 h的UV-B处理是比较适合小豆芽苗菜营养和生长的条件。

图5 不同UV-B时长对小豆芽苗菜类黄酮含量的影响
2.4 光照时间进程对小豆芽苗菜类黄酮含量的影响
每12 h取一次样,可以发现12~24 h,W处理的小豆类黄酮含量高于UV-B处理的类黄酮含量,并且都稍有下降。在36 h之后,UV-B处理的小豆类黄酮含量显著高于W处理的类黄酮含量(p<0.05),并且一直延续到120 h。另外,36 h之后,W处理的小豆类黄酮含量变化不大,UV-B处理的小豆类黄酮含量基本处于上升趋势(图6)。说明UV-B对小豆芽苗菜类黄酮物质含量的影响是持续且稳定的。
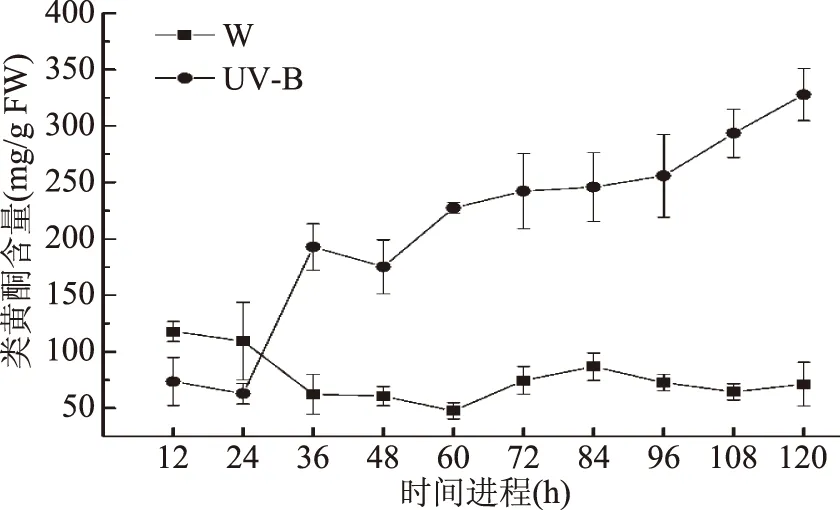
图6 UV-B光照时间进程对小豆芽苗菜类黄酮物质含量的影响
2.5 光照时间进程对小豆芽苗菜类黄酮关键酶活性的影响
由图7可知,UV-B光下,CHS和FLS的酶活在60 h之内均高于W处理。两种光下,两种酶的趋势保持一致,CHS酶在12~60 h中呈现先上升后下降,再上升继而缓慢下降的趋势;FLS酶则呈现先上升后下降,进而持续上升的趋势。说明光照能够促进相关酶活性提高,并且UV-B对CHS和FLS酶活的影响更为显著。
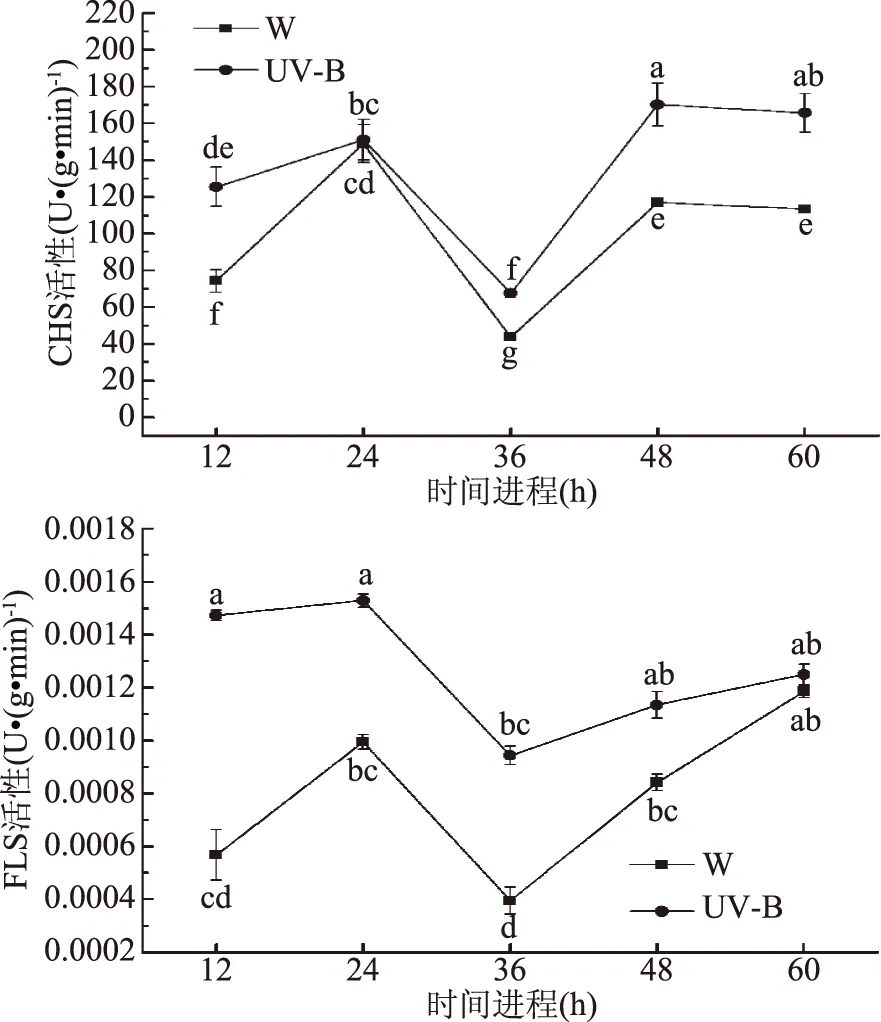
图7 光照时间进程对小豆芽苗菜类黄酮合成途径关键酶的影响
2.6 光照时间进程对小豆芽苗菜黄酮类物质关键酶基因表达量的影响
由表5可知,UV-B光下,PALclass2、CHS17like、FLS和UGT78D1like的酶基因表达量在60 h之内基本处于上升的趋势。其中PALclass2和CHS17like在48和60 h显著高于W(p<0.05),FLS在24 h和48 h显著高于W(p<0.05),UGT78D1like在48 h显著高于W(p<0.05)。两种光下,CHIlike的酶基因表达量都处于下降的趋势,且在60 h UV-B大于60 h W的酶基因表达量。说明光照促进PALclass2、CHS17like、FLS和UGT78D1like基因的表达,UV-B的效果高于W。W促进CHIlike基因的表达,UV-B抑制CHIlike基因的表达。
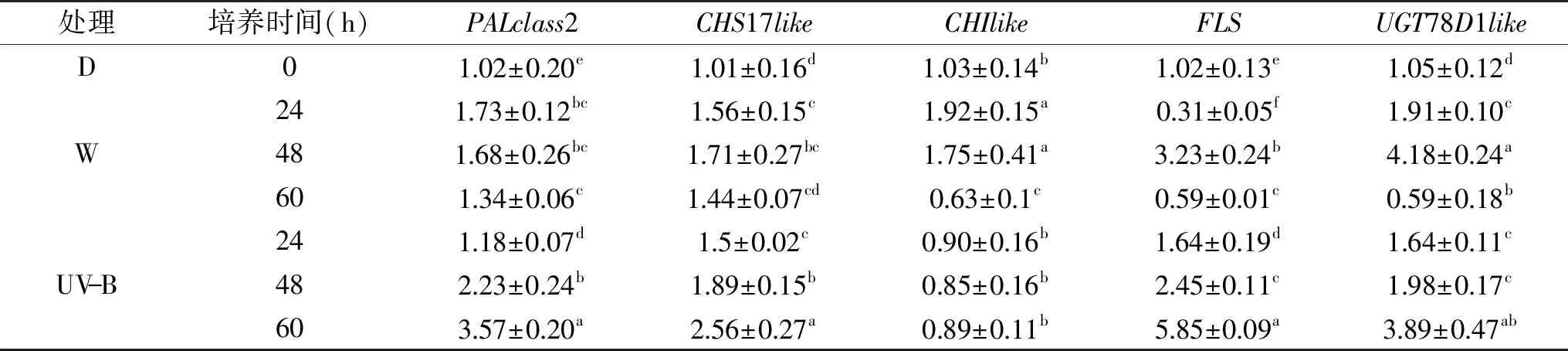
表5 光照时间对小豆芽苗菜类黄酮合成途径关键酶的影响
3 讨论
3.1 光质对小豆芽苗菜生长的影响
在本实验室的其他研究中,通过B连续光照,可以提高大豆芽苗菜的异黄酮含量,同时也抑制了下胚轴的生长[17];短波长紫外光对植物生长有一定的危害,在齐学会等[10]的研究中,UV-B显著抑制大豆芽苗菜下胚轴长。本实验中,光照降低了小豆芽苗菜的株高和鲜重,主要是通过降低其含水量,对其干重质量没有影响。说明通过单色光质提高小豆芽苗菜营养品质的生产方式是可行的。
3.2 光质对小豆芽苗菜总酚、类黄酮及主要类黄酮单体含量的影响
本实验利用W、B、UV-A和UV-B四种光质对小豆芽苗菜进行处理,以W作为对照,B、UV-A和UV-B提高了其总酚和类黄酮含量,其中UV-B显著增加了类黄酮及其单体芦丁和山奈酚的含量。与研究者[7,18-19]利用B、红光提高苦荞芽苗菜类黄酮及其单体含量的思路一致,B提高苦荞芽苗菜的单体含量最高。UV-B处理下类黄酮含量基本持续上升,但是其槲皮素含量却下降了,这是因为槲皮素是芦丁的前体,因此UV-B可能促进槲皮素转化为芦丁以及其他单体,增加类黄酮单体种类的多样化[20]。
槲皮素是重要的类黄酮单体,其在C3位羟基上结合糖分子即形成植物中普遍的成分-芸香苷(芦丁)。芦丁是合成曲克芦丁的主要原料,也可做食品抗氧剂和色素[21]。曲克芦丁为心脑血管用药,有防止血栓形成作用。国内提取芦丁的主要原料是槐花和槐米,但是其产量并不能达到要求[22]。本实验通过UV-B提高小豆芽苗菜芦丁含量极其显著,可能为将来芦丁提取原料的选择提供根据。
3.3 UV-B光照时长对小豆芽苗菜生长和类黄酮含量的影响
小豆芽苗菜总酚和类黄酮以及其单体含量在UV-B条件下提高最为显著(p<0.05),因此UV-B适合小豆芽苗菜营养品质改善。为找到适合工厂化生产的UV-B光照时长,减少UV-B光照时长补充W光照至12 h,其中4 h UV-B光照补充8 h W,其鲜重有所下降,但是其干质量却有所增加,并且类黄酮类物质最高。因此4 h UV-B光照时长可以作为小豆芽苗菜光环境调控的生产依据。
3.4 UV-B对小豆芽苗菜关键酶活性和基因表达量的影响
在12 h光照之后,类黄酮合成途径的关键合成酶CHS,其活性在UV-B下显著(p<0.05)高于W,在随后12 h的黑暗下立即下降,说明黑暗对其酶活性没有提高作用;在第二个12 h光照之后,CHS酶活性又迅速增加,并且超过首个光周期的酶活性,随后在黑暗条件下缓慢下降。说明光照总体增加了CHS酶活性,UV-B更加显著。类黄酮合成途径的另一个关键合成酶FLS有类似的趋势,除了在48 h即第二个周期之后保持继续上升的趋势。并且关键酶活基因表达量呈现类似的趋势。因此推测这两个酶与类黄酮以及单体的增加有关。
UV-B可以通过UVR8受体,调控HY5进而调控MYB转录因子的表达,从而调控下游类黄酮合成基因的表达[23]。例如,在Pandey等[24]的研究中,AtMYB111可以正向调控类黄酮合成途径关键酶基因,从而提高拟南芥中PAL、FLS、CHS、CHI、F3H等酶的活性;在烟草中过表达转录因子AtMYB12可以提高PAL等酶的活性[24];MYB182可以负调控氏烟草(Nicotianabenthamiana)中CHS基因表达量[25]。在Yuan等[26]的研究中,LIGHTAREAS1(LAR1)基因对FLS的表达正向调控功能,从而调节其酶活,提高其花青苷和黄酮醇类物质含量。在Feder等[27]的研究中,包含克尔希结构域的F-Box蛋白AtKFB01、AtKFB2和 AtKFB50,对拟南芥的类黄酮合成途径关键酶PAL有负调控作用,并且推测AtKFB50可能与CHS基因表达有关。至于UV-B提高小豆芽苗菜两个类黄酮合成关键酶活性的机理需要进一步研究。
4 结论
综上所述,B、UV-A和UV-B提高了小豆芽苗菜总酚和类黄酮含量。适当的UV-B辐射可以提高CHS和FLS酶活性,促进PALclass2、CHS17like、FLS和UGT78D1like基因的表达,显著(p<0.05)提高小豆芽苗菜中黄酮类物质含量,尤其是黄酮醇类单体含量。生产上可采用4 h的UV-B补充光照作为小豆芽苗光环境调控的培养方式,为利用光照改进芽苗蔬菜的种植方式及改善品质提供了试验依据。
