香蕉酵素发酵过程中的组分及抗氧化活性变化研究
2019-08-28黄涵年
阙 斐,黄涵年,赵 粼
(浙江经贸职业技术学院应用工程系,浙江杭州 310018)
香蕉果肉香甜软滑,含有丰富的蛋白质、膳食纤维、糖类、钾、镁、维生素A和C等,是人们喜爱的水果之一,它能够促进肠胃蠕动、润肠通便[1],具有降低血清胆固醇、防治胃肠溃疡、高血压、忧郁症、咳嗽和减肥等功效[2-3]。
蛋白酶和超氧化物歧化酶是酵素食品含有的主要功效酶[4],具有提高身体自愈力、促进体内新陈代谢、提高肠的蠕动、抗炎抗菌、增强人体免疫等多种功效[5- 6],其活性在一定程度上反应了酵素食品的品质。目前酵素食品在日本、台湾已经发展为成熟产业,形态丰富多样的酵素类产品让食用酵素成了日本人、台湾人认可的健康习惯[7]。但是日本、台湾酵素因其采用的原料多以蔬菜、药草为主,产品口感不佳,所以果蔬酵素的发展空间与市场潜力巨大。
传统酵素食品在加工过程中常用的微生物有植物乳酸菌、酵母菌和醋酸菌等。本文通过比较自然发酵、酵母菌发酵、植物乳杆菌发酵香蕉酵素发酵过程中抗氧化活性、蛋白酶活力、超氧化物歧化酶活力以及多糖的含量在发酵过程中的不同变化,对其发酵规律进行初步探究,以期获得美味和营养兼具的新型发酵饮品,同时为香蕉酵素产品的开发提供技术支持和理论基础。
1 材料与方法
1.1 材料与仪器
香蕉(产自厄瓜多尔) 大润发超市;YMC1005-B1植物乳杆菌(Lactobacillusplantarum) 河北一然生物科技有限公司;酵母菌 安琪葡萄酒高活性干酵母,安琪酵母股份公司;DPPH试剂、福林酚、Tris碱 Solarbio公司;无水乙醇 烟台三和化学试剂有限公司;邻苯三酚、酪氨酸溶液 上海源叶生物科技有限公司;苯酚 天津市北联精细化学品开发有限公司;碳酸钠 天津市巴斯夫化工有限公司;HCl 莱阳市康德化工有限公司;TCA 上海麦克林生化科技有限公司;以上试剂均为分析纯。
AR1140电子分析天平 奥豪斯国际贸易有限公司;WFZ UV-2000型紫外可见分光光度计 尤尼柯仪器有限公司;QYC-200型恒温培养摇床 上海福玛实验设备有限公司;DHP-9032型电热恒温培养箱 龙口市先科仪器公司。
1.2 实验方法
1.2.1 香蕉酵素的制作工艺 香蕉去皮,切成薄片→加入黄糖→调节pH与糖度→按照3%比例接菌发酵12 d→过滤取上清液→测定指标。
1.2.2 DPPH自由基清除能力测定 用无水乙醇配制0.1 mmol/L DPPH溶液,加入无水乙醇、浸提试剂(蒸馏水),再分别加入发酵后的酵素样品(表1),混匀后于517 nm测其吸光度[8]。
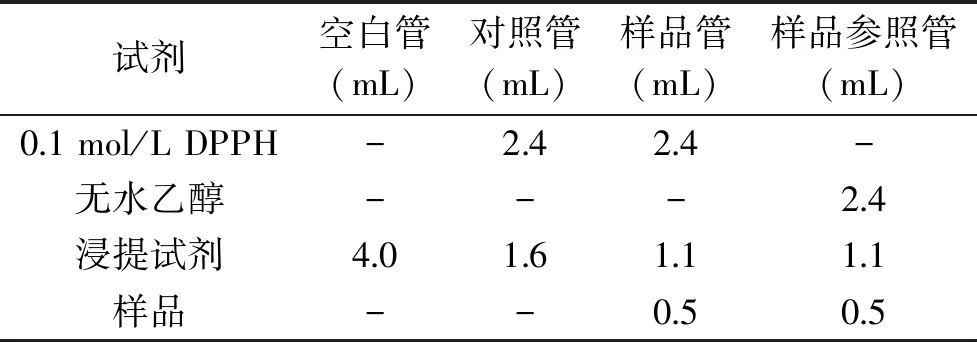
表1 DPPH清除自由基能力
1.2.3 清除羟自由基活性的测定 清除羟自由基的活性判定采用邻二氮菲-Fe2+法[9]。在一定量的待测样液中,依次加入邻二氮菲、硫酸亚铁和双氧水,混匀,37℃恒温水浴90 min,测定536 nm 处的吸光值。具体试剂加样量如表2。
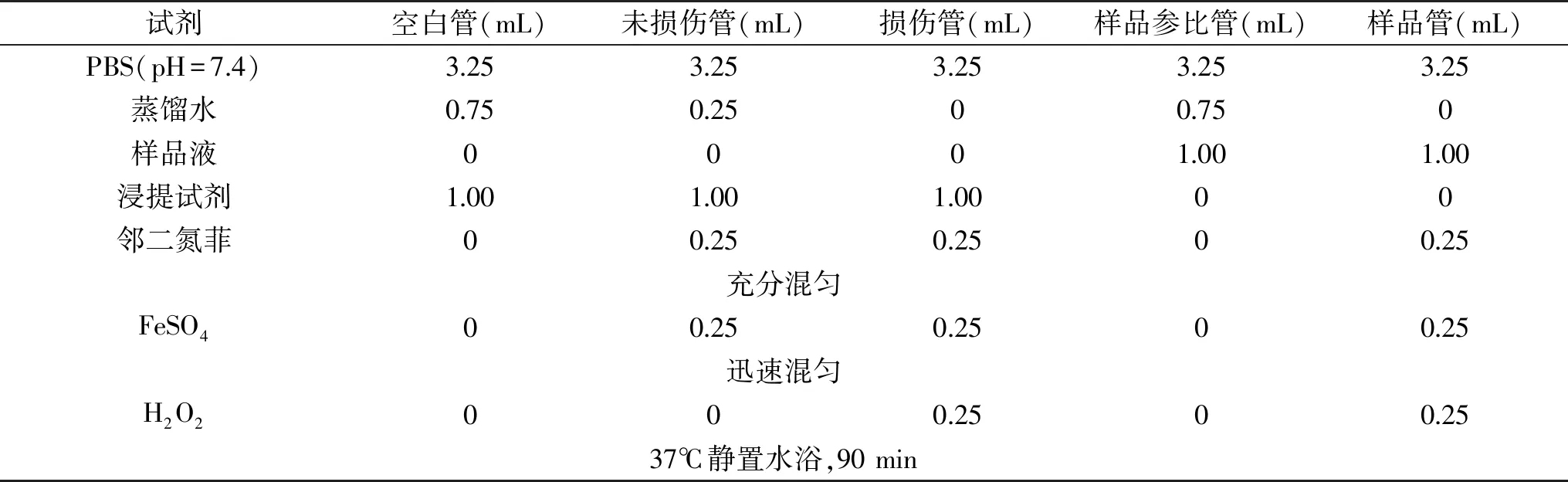
表2 清除羟自由基活性的测定
式中:A1为邻二氮菲与硫酸亚铁反应的吸光度;A2为邻二氮菲、硫酸亚铁和双氧水反应的吸光度;A3为样品吸光度;A4为样品与邻二氮菲、硫酸亚铁和双氧水的吸光度。
1.2.4 SOD酶活测定 采用邻苯三酚自氧化法[10]。邻苯三酚在碱性条件下能迅速氧化,释放出O2,生成带色的中间产物,反应开始后先变成黄绿色,几分钟后转换成黄色,线性时间维持在3~4 min,加入酶液则抑制其自氧化速度,见表3,325 nm处测定溶液的吸光度,计算SOD酶活。

表3 SOD活力测定实验
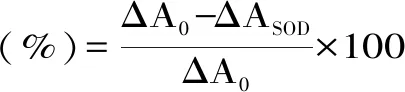
式中:A0:邻苯三酚自氧化的吸光度;ASOD:样品光密度值变化。

式中:V1:反应液总体积,mL;V2:测定样品体积,mL;n:酶液稀释倍数。
1.2.5 碱性蛋白酶活力的测定 采用Folin-酚法[11]。
1.2.5.1 标准曲线的制作 取105 ℃下,完全干燥后的酪氨酸0.5 g,用0.2 moL/L HCl 250 mL溶解,配成酪氨酸溶液,分别取0、1、2、3、4、5 mL酪氨酸溶液,用0.2 moL/L HCl定容至100 mL,取1 mL酪氨酸溶液加2.5 mL碳酸钠和0.5 mL福林试剂,混匀,37 ℃水浴30 min,测定660 nm吸光度,制作标准曲线[10]。
1.2.5.2 蛋白酶活力的测定 取2.5 mL 0.6%的酪蛋白底物,在37 ℃下水浴10 min,加入0.5 mL酵素样品混匀,在37 ℃水浴锅中振荡水浴10 min,加入2.5 mL TCA试剂混匀,在37 ℃静置水浴30 min,过滤收集1 mL滤液,加入2.5 mL Na2CO3和0.5 mL福林试剂混匀后在37 ℃水浴锅中静置水浴30 min,在660 nm处测定其吸光度。
蛋白酶酶活(U/g)=A×K×(11/2)×(1/10)×(1/W)
式中:A:样品吸光度;K:相当于标准曲线上吸光度为1时的酪氨酸数量,μg;W:1 mL溶液中加入的样品克数(稀释因子);11:反应总体积,mL;2:反应后收集的反应液;10:反应时间,min。
1.2.6 多糖含量的测定 多糖测定采用苯酚硫酸法[12]。以葡萄糖为标准品,于波长490 nm处测定吸光值,绘制标准曲线。取一定的发酵液,按照体积比1∶3加入70%乙醇,静置过夜,抽滤后获得残渣用70%乙醇清洗3次,烘干后,用蒸馏水溶解并定容至100 mL,按照标准物质测定方法操作并根据标准曲线计算样品中的多糖含量。
1.3 数据处理
实验采取三次重复实验,结果为平均值±标准偏差,采用Origin 9.3作图。
2 结果与分析
2.1 香蕉酵素发酵过程中清除DPPH自由基能力变化
发酵过程中DPPH自由基清除能力的变化如图1所示。酵母菌、植物乳杆菌发酵的香蕉酵素DPPH自由基清除率明显高于自然发酵的香蕉酵素。酵母菌发酵的香蕉酵素样品在约2 d时自由基清除率要高于接有植物乳杆菌的样品,并在第3 d时被植物乳杆菌发酵的香蕉酵素超过。随着时间的变化,植物乳杆菌发酵、酵母菌发酵的香蕉酵素清除率均呈现明显的上升趋势,最高清除率可分别达到79.54%和69.79%。
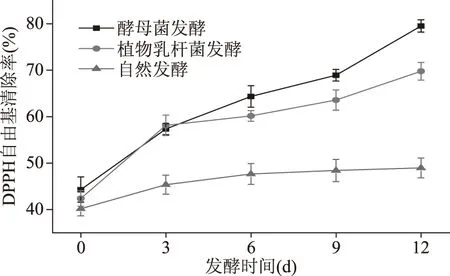
图1 香蕉酵素DPPH自由基清除能力
2.2 清除羟自由基活性的测定
如图2,在发酵的0~12 d中羟自由基清除率随发酵时间的增加呈上升趋势,酵母菌、植物乳杆菌发酵的香蕉酵素的羟自由基清除率最高分别达到49.97%和45.38%,明显高于自然发酵过程。
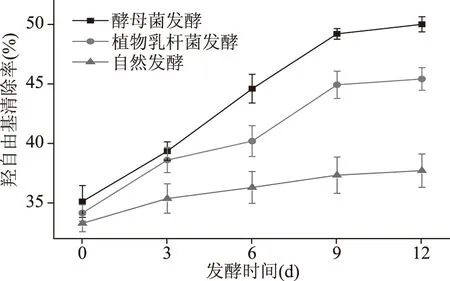
图2 发酵过程中羟自由基清除率的变化
2.3 SOD酶活力的变化趋势
由图3可见,在0~9 d酵母菌、植物乳杆菌发酵的香蕉酵素在发酵过程中其SOD酶活力均随着时间的变化呈现上升趋势,从第3~9 d期间酵母菌发酵的香蕉酵素SOD酶活要明显高于植物乳杆菌发酵的香蕉酵素酶活,第9~12 d,两者变化幅度很小,达到基本稳定的状态,发酵后的香蕉酵素酶活力最高可分别达到89.50和86.79 U/mL,高于自然发酵过程。
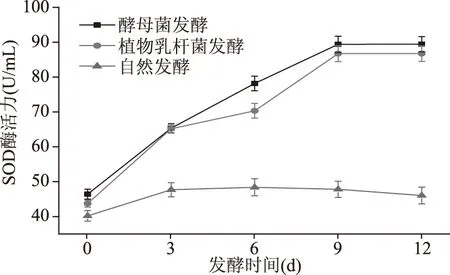
图3 香蕉酵素在发酵过程中SOD酶活力变化
2.4 蛋白酶活力的变化趋势
2.4.1 蛋白酶活力标准曲线的制作 以吸光度为纵坐标,以酪氨酸浓度为横坐标做标准曲线如下图4所示。回归方程y=0.1445x+0.0382,R2=0.9964,其中x为酪氨酸浓度,y对应吸光值。在酪氨酸浓度20~100 μg/mL范围内两者具有良好的线性关系。
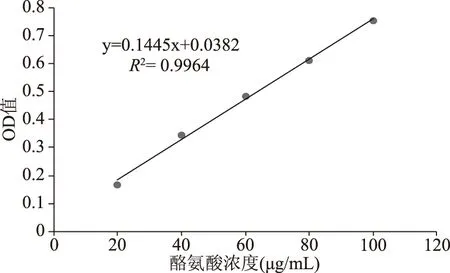
图4 Folin-酚法测定碱性蛋白酶活力标准曲线
2.4.2 蛋白酶活力的变化趋势 由图5可见,酵母菌、植物乳杆菌发酵的香蕉酵素在发酵过程中的蛋白质酶活力变化趋势基本一致,在第0~3 d酶活急剧增大,第3 d后达到缓慢增长趋势,第9 d后达到基本稳定状态,最高酶活分别为67.90和66.58 U/g,皆明显高于自然发酵过程的蛋白酶活力。酵母菌发酵的香蕉酵素在发酵过程中的蛋白质酶活力要略高于接有植物乳杆菌发酵的香蕉酵素,但差异不大,两者发酵后达到基本稳定状态后的酶活均比最开始发酵时的酶活增加将近3倍。
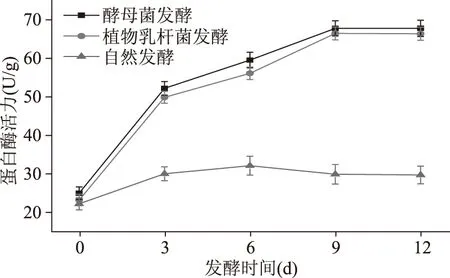
图5 香蕉酵素蛋白酶活力
2.5 多糖含量的计算
2.5.1 标准曲线的制作 以葡萄糖浓度x为横坐标,吸光度y为纵坐标做标准曲线如图6所示,回归方程y=0.0116x+0.18128,R2=0.99944,具有良好的线性关系。
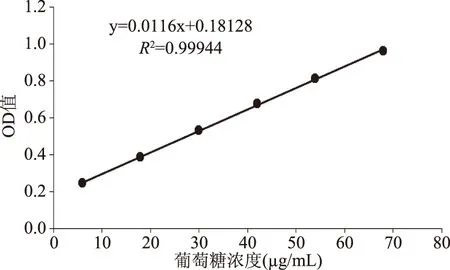
图6 苯酚硫酸法测定多糖含量标准曲线
2.5.2 多糖含量的变化趋势 多糖含量随时间的变化如图7所示,自然发酵和接有酵母菌、植物乳杆菌的香蕉酵素在0~6 d,多糖含量呈现增加的趋势,可能是因为在发酵过程中微生物产酶将香蕉中结合多糖充分酶解释放出来;第6 d之后达到一定程度自然发酵的酵素多糖含量呈逐渐下降趋势,酵母菌和植物乳杆菌发酵的香蕉酵素多糖含量趋于稳定。酵母菌发酵的香蕉酵素多糖含量高于接有植物乳杆菌的酵素,最高含量可达20.45 mg/g。
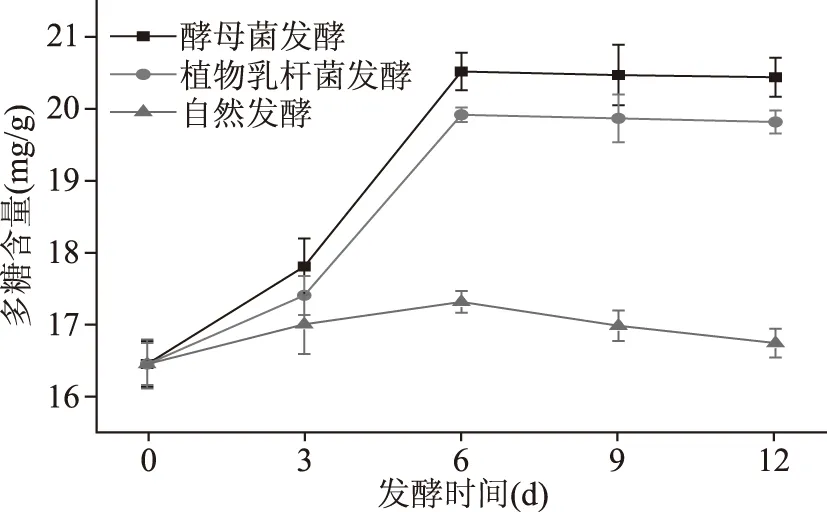
图7 香蕉酵素在发酵过程中多糖含量随时间变化趋势
3 结论
本实验以香蕉作为原料,比较了自然发酵、酵母菌发酵、植物乳杆菌发酵的香蕉酵素抗氧化活性、相关酶活及多糖含量在发酵过程中的变化。结果表明在香蕉的发酵过程中其清除自由基能力、碱性蛋白酶活力和SOD酶活力以及多糖含量都是随着时间的延长而逐渐增强,最后达到基本稳定状态,其DPPH自由基最高清除率分别可达到48.97%、79.54%和69.79%;其羟自由基清除率最高可分别达37.68%,49.97%和45.38%;其SOD最高酶活力分别达到48.35、89.5和86.79 U/mL;其碱性蛋白酶的最高酶活分别为32.28、67.90和66.58 U/g;其多糖最大含量为17.31、20.45 和19.9 mg/g。对比接种酵母菌和植物乳杆菌发酵的两组香蕉酵素,其品质指标差异并不显著,但两者都高于自然发酵组。酵母菌发酵的香蕉酵素各项指标都高于植物乳杆菌发酵的香蕉酵素,但差异不明显,说明这两种菌均可用于接种香蕉制作酵素。
