铜绿假单胞菌新西兰兔脓胸模型的建立
2019-08-28张真强李金垄韦球廖金玲覃雅婷邓鸿媚梁斌张士卿孔晋亮王可
张真强 李金垄 韦球 廖金玲 覃雅婷 邓鸿媚 梁斌 张士卿 孔晋亮 王可
病菌侵入胸膜腔,产生脓性渗出液积聚于胸膜腔内的化脓性感染,称为脓胸。脓胸患者的胸腔引流液为脓性液体。有报道称脓胸的发生多由肺部感染蔓延至胸膜腔所致。除此之外,胸腔穿刺置管引流也是脓胸形成的一部分原因[1]。铜绿假单胞菌是院内感染的常见原因,包括烧伤伤口感染、尿路感染、菌血症及医院获得性肺炎[2]。铜绿假单胞菌是常见的革兰阴性杆菌,它拥有广泛的代谢多样性,这让它能够在许多环境和营养条件下繁殖,也使得它能成为一种机会致病菌[3]。脓胸可因各种病原体感染累及胸膜腔而形成。常见的病原体有链球菌、金黄色葡萄球菌等革兰阳性菌;也有铜绿假单胞菌、肺炎克雷伯菌等革兰阴性菌;还可有厌氧菌及兼性厌氧菌,甚至是多种微生物的混合感染[1]。本研究通过铜绿假单胞菌建立新西兰兔脓胸模型,为进一步研究铜绿假单胞菌在胸腔环境中的生长特性、耐药机制及相应的治疗策略提供基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级雄性新西兰兔24 只,体重(2.5±0.5)kg,由广西医科大学动物实验中心提供。饲养条件:室温,空气流通,动物自由摄食饮水,随机分为实验组及对照组。实验组16 只,对照组 8 只。
1.1.2 菌株 本实验所用铜绿假单胞菌标准菌株PAO1 由新加坡南洋理工大学生命科学研究院惠赠。1.1.3 主要试剂及仪器 LB 琼脂粉、LB 肉汤(北京陆桥公司),戊巴比妥钠(SIGMA),HE 染色试剂盒(索莱宝),一次性输液用头皮针管(湖南康利莱医疗器械有限公司),超净台(苏州净化),生物安全柜(苏净安泰BHC-1300IIA2),分光光度计(普析通用T6),生化培养箱(恒宇SPX-300-II),冷冻离心机(HERMLE Z326K),超低温冰箱(Thermo 995),多功能酶标仪(Thermo Fisher3020),漩涡振荡器。
1.2 方法
1.2.1 菌液的制备 本研究使用的铜绿假单胞菌标准菌株PAO1/实验菌株储存于含15%甘油的LB肉汤培养基-80℃,接种至LB 琼脂培养皿中,培养18~24h,然后挑取单个菌落接种于LB 肉汤液体培养基中,37℃摇床培养过夜(14~16h),离心,4℃,3 000rpm,15min,沉淀物使用PBS 缓冲溶液洗涤2 次,用LB 肉汤稀释至OD600=0.1(菌量为107~108CFU/ml),稀释成105~106CFU/ml 的细菌悬浮液备用,使用菌落计数法验证菌液浓度。
1.2.2 实验分组及新西兰兔脓胸模型的建立 于广西医科大学动物实验中心清洁级实验室,将24 只新西兰兔随机分成对照组和实验组,对照组8 只,实验组16 只。均通过耳缘静脉注射2%戊巴比妥钠(30mg/kg)麻醉新西兰兔,固定,右侧胸壁第6 肋间定位,消毒,无菌条件下进行穿刺,置入剪除针头的6 号灭菌一次性输液针管,实验组注入新西兰兔2ml/kg 的105~106CFU/ml 上述菌液,对照组注入2ml/kg LB 肉汤培养液,各组均用1ml 无菌生理盐水冲洗管壁,以将管壁内浮游菌排入胸腔。将输液针管剪除头端置入胸腔内作为载体(导管长度13cm),缝合穿刺部位皮肤。
1.2.3 新西兰兔脓胸模型胸膜组织病理检查 取新西兰兔右侧胸腔壁层胸膜组织(胸壁及膈面胸膜)、脏层胸膜组织(肺组织),于10%甲醛溶液中固定24h,制作常规石蜡切片,HE 染色,光学显微镜下观察胸膜厚度及炎症细胞浸润情况。
1.2.4 新西兰兔胸腔积液/脓絮状物革兰染色 解剖时,无菌操作下打开新西兰兔胸腔,取胸腔积液/脓絮状物保存于灭菌离心管中,无菌操作下取少量胸腔积液/脓絮状物涂布于载玻片,过火固定。将玻片进行革兰染色,油镜下观察。
1.2.5 新西兰兔脓胸模型胸腔留置管的细菌培养 经消毒铺巾,使用灭菌器械剪开新西兰兔右侧胸壁,取出胸腔内留置导管,每个样本取管3cm 剪碎,收集至无菌试管中,PBS 缓冲溶液冲洗3 次,使用漩涡震荡仪震荡10min。取导管浸出液稀释涂盘,进行活菌计数,结果记作CFU/ml。
2 结果
2.1 脓胸模型评估 共有22 只新西兰兔存活并完成实验,对照组无死亡,实验组意外死亡2 只。术后第4 天解剖新西兰兔,实验组新西兰兔胸腔中可见不等量的胸腔积液或脓絮状物,胸膜表面粗糙;对照组胸腔内无明显胸腔积液及脓絮状物及粘连,胸膜表面光滑,见图1。脓胸模型成功标准:新西兰兔胸腔中可见胸膜产生粘连,胸腔中形成脓液或脓絮状物,胸膜病理学检查可见大量炎症细胞浸润,胸腔积液/脓絮状物革兰染色可见革兰阴性杆菌,即证明脓胸模型建立成功。
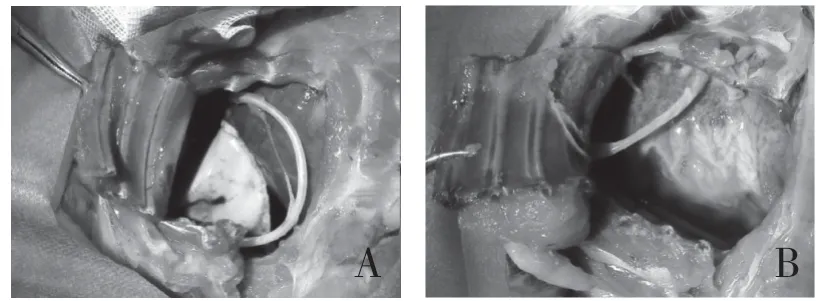
图1 新西兰兔胸腔大体观
2.2 胸膜组织的病理检查 相比于对照组,实验组新西兰兔胸膜明显增厚,胸膜中白细胞渗出增多,见图2。

图2 新西兰兔壁层胸膜组织HE 染色
2.3 胸腔积液/脓絮状物的革兰染色 对照组胸腔内无明显胸腔积液或脓絮状物形成,实验组胸腔积液/脓絮状物涂片革兰染色,镜下可见革兰阴性杆菌分布,见图3。
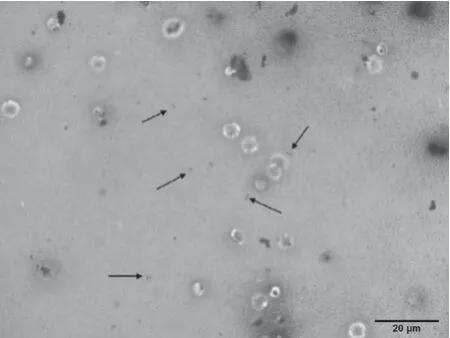
图3 实验组新西兰兔胸腔积液/脓絮状物革兰染色
2.4 胸腔留置导管的菌落计数 对照组新西兰兔胸腔留置导管未培养出细菌;实验组胸腔留置导管培养出铜绿假单胞菌菌落,菌量为(6.020±0.438)log(CFU/ml)。
3 讨论
实验动物的脓胸模型在近年的一些研究中偶有提及,包括金黄色葡萄球菌脓胸模型、肺炎链球菌脓胸模型等。早期学者实验证明了直接向动物胸腔中注入细菌并不能成功建立模型,结果是实验动物死于败血症或者胸腔内的细菌被完全清除[4]。近年来,大多研究者选择向胸腔内注入松节油诱发无菌性胸膜炎,产生渗出液以为细菌提供营养等生长条件,再向胸腔中注入细菌以诱导脓胸的发生[5]。亦有研究成功使用脑心浸液培养的肺炎链球菌注入大鼠胸腔以建立脓胸模型[6]。与其他研究不同的是,本研究一方面在未使用松节油刺激胸膜的前提下使用LB肉汤作为铜绿假单胞菌悬液的溶剂,将细菌注入胸腔,并留置导管,成功制造了新西兰兔的铜绿假单胞菌脓胸模型;另一方面,对留置于胸腔中的导管进行分析,这是其他动物脓胸模型研究中所未提及的。同时使用LB 肉汤单独注入新西兰兔胸腔作为对照组,最终发现对照组新西兰兔脓胸中LB 肉汤被完全吸收,胸腔内无明显粘连,且无脓絮状物及胸腔积液产生,证明脓胸的发生的确是由铜绿假单胞菌在胸腔内感染形成。
在临床中,胸腔闭式引流是常用的脓胸治疗手段之一[7,8],胸腔引流有利于排出胸腔内脓液,以减少肺组织所受积液压迫,促进肺复张及功能的恢复。同时,对于胸腔内存在粘连及分隔的患者,通过引流管向胸腔内注入纤维蛋白溶解药物也是常用的治疗方法。然而,闭式引流的引流管上是否会有细菌粘附及生长,也是个不容忽视的问题。引流管的留置是否会加重细菌在胸腔内的感染,导致脓胸迁延不愈,值得思考。首先,引流管是否对胸膜造成异物刺激,进而加重胸膜的炎性渗出,为细菌的生长提供营养条件;其次,引流管的表面可能更适宜细菌聚集及粘附生长,而为细菌提供了生长环境及庇护所。本研究发现,埋入胸腔内的引流管,经过冲洗后,震荡所得的悬浮液中可培养出大量铜绿假单胞菌,证明了引流管上也有细菌粘附生长。生长在引流管上的细菌是否持续向胸腔中释放,而导致脓胸迁延不愈,仍有待研究。
本课题组将在后续的研究中继续改进脓胸模型,并使用该模型研究脓胸发生的影响因素,如胸腔中pH 值,菌株种类及进一步的药物干预试验。
总之,本研究通过胸腔穿刺置管向新西兰兔胸腔中注入铜绿假单胞菌,且置入引流管,建立了新的铜绿假单胞菌新西兰兔脓胸模型,并发现了引流管上有大量细菌生长。使用该脓胸模型,可进一步研究铜绿假单胞菌脓胸的发生机制及影响脓胸形成的理化因素,为进一步研究脓胸的治疗提供了实验基础和理论依据。
